大西洋鳕鱼肌红蛋白血管紧张素转化酶抑制肽的计算机模拟评估
◎ 武 琦,徐春明,田 源,韩爱萍,刘孝飞,李振华
(1.北京工商大学 轻工科学技术学院,北京 100048;2.北京玫瑰日记生物科技有限公司,北京 100024;3.北京有肌时代科技有限公司,北京 100024)
高血压是常见的心血管疾病。在人体的血压调节中,肾素-血管紧张素系统(Renin-Angiotensin System,RAS)和激肽释放酶-激肽系统(Kallikrein-Kinin System,KKS)起重要作用[1],在RAS系统中,血管紧张素原水解产生血管紧张素Ⅰ(AngⅠ)在血管紧张素转化酶(Angiotensin Converting Enzyme,ACE)的作用下水解生成血管紧张素Ⅱ,在血管中促进平滑肌收缩,增大血管压力,引起升压反应[2]。而ACE抑制肽可阻碍ACE参与以上的生化反应,从而降低血压。目前市面上销售及临床应用的主要合成降压药物为血管紧张素转换酶抑制剂(Angiotensin Converting Enzyme Inhibitors,ACEI)、血管紧张素受体阻滞剂(Angiotensin Receptor Blockers,ARB)以及钙拮抗剂(Calcium Channel Blockers,CCB)[3],但长期服用药物会有一定的副作用,因此目前越来越关注从食物中寻找能降低血压的营养成分。
生物活性肽具有降血压、激素调节、免疫调节和抗血栓等生物学功能[4],但这些肽在经过胃肠时会被酶水解改变结构,从而影响ACE抑制肽的活性,因此利用计算机模拟评估肽的活性是必不可少的。计算机模拟评估的方法具有快速、高效以及高通量的优点,传统的体外模拟实验费时费力,实验结果受外界影响大,而计算机模拟研究能在更短的时间内对肽进行低成本的初级筛选[5]。因此,本研究将利用计算机模拟评估的方法从食物中提取生物活性肽,并进行分子对接,分析其ACE抑制肽的活性。
大西洋鳕鱼(Gadus morhua)因高经济价值被人类广泛食用。鱼蛋白的水解物具有多种生物活性[6],被人体消化后具有一定的降压效果。研究表明存在于骨骼、肌肉中的内源性生物活性肽[7]对降低高血压具有重要作用[8]。因此,本研究针对大西洋鳕鱼肌红蛋白的生物学活性,通过计算机模拟来分析该肌红蛋白产生ACE抑制肽的潜力,提出了一种可替代ACE抑制肽药物的方法,为从食品中寻找ACE抑制肽提供参考。
1 材料与方法
1.1 蛋白质氨基酸序列查找
在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中输入大西洋鳕鱼的拉丁名Gadus morhua选择protein检索出该鳕鱼的所有蛋白质序列,找到并下载由145个氨基酸组成的肌红蛋白序列。
1.2 计算机模拟胃肠道消化
将从NCBI数据库中得到的肌红蛋白氨基酸序列在Peptide Cutter(https://web.expasy.org/peptide_cutter/)模拟酶解。
选用胃蛋白酶(EC 3.4.23.1)来模拟胃消化,胰蛋白酶(EC 3.4.21.4)和胰凝乳蛋白酶(EC 3.4.21.1)模拟胃肠消化,将肌红蛋白序列切割为2~13个肽的短肽链,将短肽在Peptide Rank中根据具有生物活性的预测概率对肽进行排序。
1.3 BIOPEP分析
利用BIOPEP数据库(https://biochemia.uwm.edu.pl/biopep-uwm/)预测大西洋鳕鱼肌红蛋白中潜在的ACE抑制肽,并与该数据库内已知的具有ACE抑制活性的肽相匹配,找到活性最高的短肽并对其进行后续分析。将已切成短肽的血红蛋白依次导入BIOPEPUWM的“酶促工具”分析中,在结果界面将会显示其是否具有潜在的生物活性,可根据A、B值的大小从中选择具有潜在ACE抑制活性的肽并做进一步分析。
1.4 计算机模拟水解后释放短肽的理化特性
利用Expasy(https://web.expasy.org/)和Toxin Pred(https://webs.iiitd.edu.in/raghava/toxinpred/design.php)分析肌红蛋白经模拟胃肠消化得到短肽的分子量大小(Molecular Weight,MW)、等电点(Isoelectric Point,PI)、理化性质、Peptide Ranker值、净电荷和毒性特征,为后续的分析做准备。
1.5 分子对接
从PDB数据库(https://www.rcsb.org/)中下载ACE(PDB ID:1O86)的晶体结构式并在Pymol中对受体结构进行预处理,使用原结晶的坐标为ACE对接的盒子中心。使用ChemDraw 19.0绘制肌红蛋白的三维结构式,将两者在AutoDock Tools 1.5.7进行分子对接,根据能量筛选最佳对接点位,对接完成后在Discovery Studio 2017中进行可视化处理。
2 结果与分析
2.1 肌红蛋白理化性质分析
大西洋鳕鱼肌红蛋白经过模拟胃肠消化后产生ACE抑制肽,利用软件对ACE抑制肽进行分析,结果如表1所示。

表1 大西洋鳕鱼肌红蛋白中鉴定出的ACE抑制肽的肽序列、理化性质和毒性预测表
由表1可知,大西洋鳕鱼肌红蛋白获得的20种肽中既有二肽、三肽,也有少数多肽,所有肽都只出现1~2次,且分子量在188.25~1 414.83 Da,CW、LG、AGL、IPINN和ITEVIAK这5种肽的PI值为5.85~6.35,净电荷值均为0;HMAEK、NTHGGL和AASVAVASHGATV这3种肽的PI值均为7.10,净电荷值为0.5;TR、LKP和LFPK这3种肽的PI值>9.0,净电荷数为1;LGE、MADY和AGVGE这3种肽的PI值≤4,净电荷数为-1。由表1分析可知,该大西洋鳕鱼肌红蛋白的短肽部分带负电荷偏弱酸性,少部分带正电荷偏弱碱性。
利用Toxin Pred软件进行毒性预测,结果显示从大西洋鳕鱼肌红蛋白模拟水解得到的短肽均没有潜在的毒性,可以进一步研究开发为食品或药品。
利用Peptide Ranker对20种肽具有生物活性的概率进行排序,从0到1分,Peptide Ranker评分的阈值设置为0.5,分值越高说明肽具有生物活性的可能性越大[9]。由表1可知,大西洋鳕鱼肌红蛋白计算机模拟水解肽中有4个肽的分值大于0.5,CW肽的分值最高为0.995 81、LFPK的分值为0.823 71,由此可知对大西洋鳕鱼肌红蛋白的分析是有研究意义的。
2.2 分子对接结果可视化
大西洋鳕鱼肌红蛋白经计算机模拟水解后,选取其中活性概率最高的二肽CW和四肽LFPK进行下一步的分子模拟和分子对接,结果见图1、图2。

图1 ACE-CW分子对接相互作用图
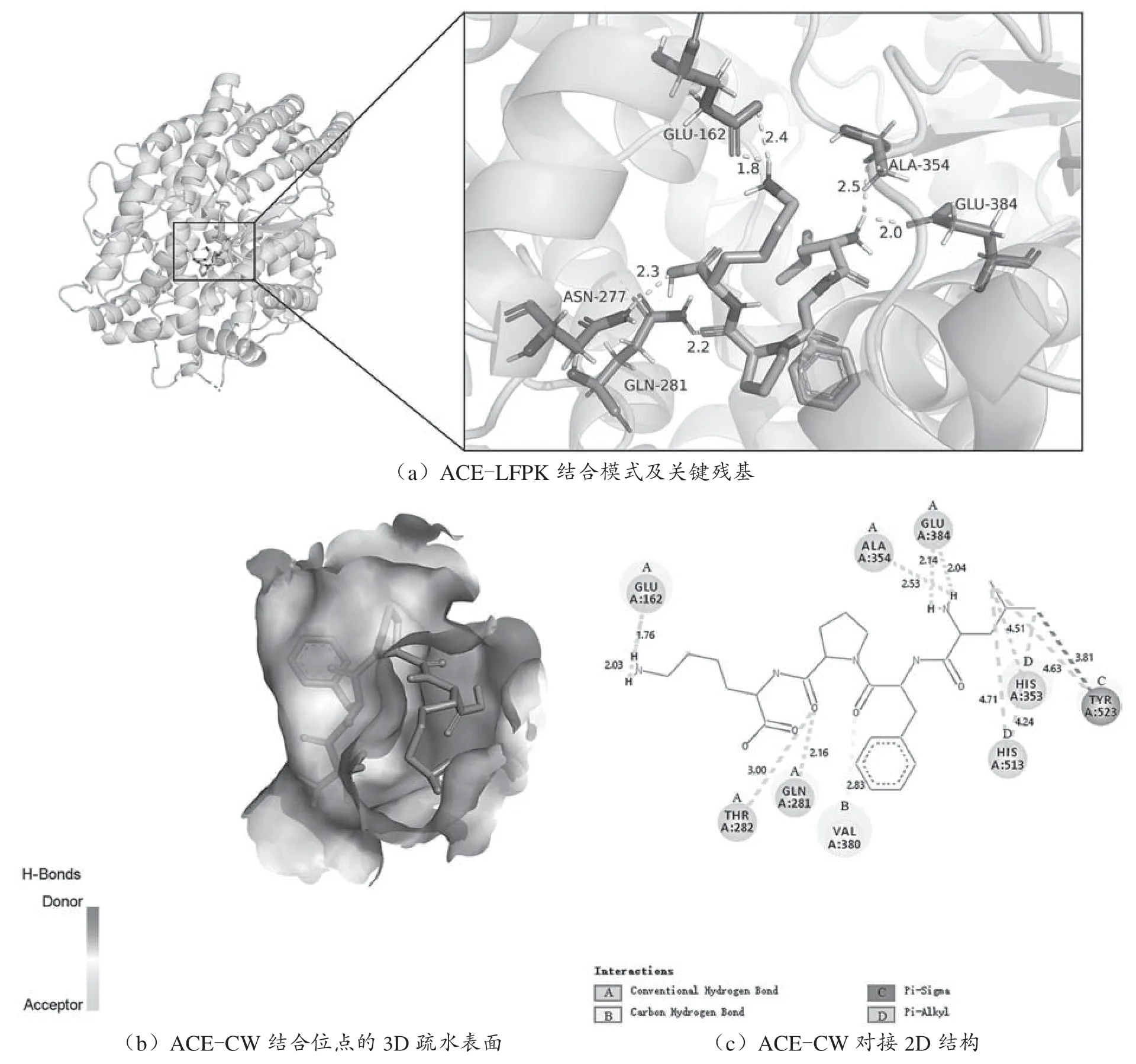
图2 ACE-LFPK分子对接相互作用图
分子对接是基于配体和受体的“锁-钥原理”,该过程实际上是将小分子配体逐一放在受体蛋白具有活性的位点,通过不断调整位置,寻找两者结合的最佳构象[10],从分子角度阐述CW、LFPK和ACE的作用机制。ACE的活性中心共有S1、S2、S3 3个必须结合位点。本文研究了小分子配体与ACE活性位点之间的相互作用,选择二肽CW的作用位点是S1和S2,LFPK的作用位点是S1、S2和S3,将CW和LFPK分别进行分子对接。
由图1(a)和1(c)可知,在ACE-CW复合物中,两者主要通过氢键作用、疏水作用、pipi-共轭作用发生结合。例如,CW与ACE的氨基酸残基Gln281(2.3 Å)、Lys511(1.9 Å)、His353(2.4 Å)、Ala354(2.2 Å)、Glu384(2.10 Å/1.97 Å)以及His387(2.74 Å)之间形成7个距离不同的氢键,其中与Lys511残基之间形成的氢键距离最短,结合最紧密;与His513(2.91 Å)形成碳氢键。CW与氨基酸残基Val380(4.75Å)形成pi-烷基键,与Phe457(4.75 Å)形成pi-pi共轭键,CW与氨基酸残基His383(4.44 Å)和Tyr523(5.98 Å)形成pi-硫相互作用。其中,CW与ACE活性位点S1的Tyr523形成pi-硫相互作用,Ala354、Glu384形成3个氢键;与活性位点S2的His353、Gln281、Lys511残基结合形成氢键,与His513结合形成碳氢键。CW与ACE活性中心的氨基酸残基相结合,占据ACE的活性中心,抑制ACE的活性。
由图2(a)和2(c)可知,在ACE-LFPK复合物中,两者主要通过氢键作用和pi-烷基键发生结合。LFPK与ACE的氨基酸残基Glu16(21.76 Å/2.03 Å)、Gln281(2.16 Å)、Thr282(3.00 Å)、Glu384(2.04 Å/2.14 Å)以及Ala354(2.53 Å)之间形成7个距离不同的氢键,其中与Glu162形成的氢键距离最短,结合最紧密;LFPK与ACE氨基酸残基Val380形成距离为2.16 Å的碳氢键,与Tyr523形成距离为3.81 Å的CH-π相互作用;LFPK与Tyr523(4.63 Å)、His353(4.51 Å)和His513(4.24 Å/4.71 Å)形成pi-烷基键。其中LFPK与ACE活性部位S1中的Ala354和Glu384形成氢键;与活性部位S2中的His353和His513形成pi-烷基键,Gln281形成氢键;与活性部位S3中的Glu162形成2个距离不同的氢键。LFPK与ACE活性中心中的氨基酸残基相结合,占据ACE的活性中心,抑制ACE的活性。
3 结论
本研究利用计算机初步筛选出大西洋鳕鱼肌红蛋白中的生物活性肽,它们均无毒,选取具有ACE抑制活性概率最大的CW和LFPK,利用分子对接技术分析了这2种肽的ACE抑制机制。结果显示,CW在ACE活性中心的结合位点是S1和S2,LFPK的结合位点是S1、S2和S3,此研究结果为在食品工业中开发大西洋鳕鱼肌红蛋白作为ACE抑制肽的前体提供了理论基础。

