三种伞形科蔬菜作物棕榈酰基转移酶基因家族的鉴定与分析
张新业,李文静,朱 姝,孙艳香,王聪艳,闫训友,周志国,*
(1.廊坊师范学院 生命科学学院,河北 廊坊 065000; 2.河北省动物多样性重点实验室,河北 廊坊 065000; 3.廊坊市细胞工程与应用研究重点实验室,河北 廊坊 065000)
脂质修饰是生物体内一种常见的蛋白质修饰机制,可将脂肪酸链添加到靶蛋白特定氨基酸残基上,增加蛋白质的疏水性,协助蛋白质锚定到膜或特定的脂筏上[1]。常见的脂质修饰类型包括:N-豆蔻酰化(N-myristoylation)、异戊烯化(prenylation)和S-酰化(S-acylation)。N-豆蔻酰化可在靶蛋白N末端的甘氨酸残基上引入14个碳原子的豆蔻酰基团,而异戊烯化则在C末端CaaX序列(a为任意脂肪族氨基酸,X为任意氨基酸)的半胱氨酸残基上添加15碳的法尼基(farnesyl)或20碳的牻牛儿基-牻牛儿基结构(geranyl-geranyl)。S-酰化通常又称为S-棕榈酰化(S-palmitoylation)或棕榈酰化(palmitoylation),通过硫酯键可将长链脂肪酸(通常为16碳的棕榈酸)共价结合到靶蛋白的半胱氨酸残基上[2-5]。蛋白质的棕榈酰化修饰具有可逆性,通常由棕榈酰基转移酶(S-palmitoyltransferases或proteinS-acyltransferase,PAT)催化棕榈酰化,由酰基蛋白硫酯酶(acyl protein thioesterases,APT)催化去棕榈酰化[6-8]。这种动态变化的修饰方式可对蛋白质的定位、功能及植物的整个生命活动产生诸多影响[1]。生物体内的PAT首先在酵母中被鉴定[9-10]。PAT一般为膜蛋白,含有4~6个跨膜结构域(transmembrane domain,TMD),其最显著的特征是含有50个氨基酸组成的DHHC-CRD (Asp-His-His-Cys cysteine-rich domain) 保守结构域[11],由于四肽DHHC高度保守且为催化所必需,因此PAT又称为DHHC-PAT[4,12]。近年来,植物中的PAT家族被陆续鉴定,且有多个已进行功能研究。AtPAT4、AtPAT5、AtPAT9、AtPAT10、AtPAT13、AtPAT14、AtPAT21、AtPAT24/TIP在拟南芥(Arabidopsisthaliana)生长发育、繁殖、器官衰老、胁迫及免疫响应等过程中具有重要作用[13-14]。OsDHHC1能够调控水稻(Oryzasativa)株型,并影响产量,而OsDHHC13可以调节水稻内源性H2O2的含量,参与水稻应答氧化胁迫[15-16]。ZmTIP1能够调节玉米(Zeamays)根毛长度及其抗旱性[17],MdPAT16影响了苹果(Malusdomestica)的抗盐性及糖分含量[18]。随着测序技术的发展,越来越多的植物基因组被破译,为全基因组水平上鉴定PAT家族奠定了基础。Yuan等[6]对31个已测序物种的PAT进行了鉴定,共获得804个PAT蛋白,这也是植物中首次较大规模的PAT家族挖掘鉴定工作。伞形科是高等植物中最大的类群之一,包含300~450个属3 000~3 700个种,可广泛用于食品、药品、香料及化妆品生产[19-20]。胡萝卜(Daucuscarota)、芹菜(Apiumgraveolens)、香菜(Coriandrumsativum)是3种重要的伞形科蔬菜作物,具有较高的食用及药用价值。到目前为止,还未见有关伞形科植物PAT家族鉴定分析的研究。胡萝卜、芹菜、香菜的基因组序列已分别于2016年[21]和2020年[22-23]公布,为这3种作物中PAT家族的鉴定奠定了基础。本研究将对伞形科3种代表性蔬菜作物的PAT基因家族进行鉴定,分析其在胡萝卜、芹菜、香菜中的组织表达模式,并探索其在胡萝卜胁迫响应中的表达模式,研究结果将为进一步研究PAT基因家族在伞形科植物生长发育过程中的作用奠定基础。
1 材料与方法
1.1 PAT基因家族成员鉴定及理化性质分析
从香菜基因组数据库网站(CGDB:http://cgdb.bio2db.com/)[23]下载胡萝卜、芹菜、香菜的全基因数据,通过2种方法对三种作物的PAT家族成员进行鉴定。首先,以拟南芥、水稻、玉米、苹果中功能已经得到验证的PAT蛋白——AtPAT4[24]、AtPAT5[14]、AtPAT9[14]、AtPAT10[25]、AtPAT13[26]、AtPAT14[26]、AtPAT15[27]、AtPAT21[13]、AtPAT24[28]、OsDHHC1[16]、OsDHHC13[15]、ZmTIP1[17]、MdPAT16[18]作为查询序列,分别在NCBI数据库(https://www.ncbi.nlm.nih.gov/)及CGDB数据库中进行BLAST检索(E-value=0.001)[29];其次,利用hmmsearch程序在胡萝卜、香菜及芹菜蛋白质数据库中筛选含有DHHC结构域(PF01529)的蛋白序列;然后合并两部分结果,去掉重复序列,在hmmer(https://www.ebi.ac.uk/Tools/hmmer/)和CD-search网站(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)进行蛋白结构分析,删除不含DHHC结构域的序列,最终得到胡萝卜、芹菜、香菜PAT家族成员。从3种作物的基因组注释文件(gff3)中获取各个PAT基因的染色体位置信息,利用TBtools[30]绘制PAT基因的染色体分布图,并根据其在染色体上的排列顺序进行命名和编号。
利用Expasy网站(https://web.expasy.org/protparam/)分析、预测PAT蛋白的等电点、分子量等。利用TMHMM-2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)进行跨膜区预测。利用在线工具CELLO v.2.5(http://cello.life.nctu.edu.tw/)和WoLF PSORT(https://www.genscript.com/wolf-psort.html)进行亚细胞定位预测。
1.2 PAT家族成员系统进化及结构分析
通过ClustalW程序(https://www.genome.jp/tools-bin/clustalw)对胡萝卜、芹菜、香菜及来源于拟南芥、水稻、玉米、苹果PAT蛋白的DHHC-CRD结构域进行多序列比对[31],再使用MEGA6采用邻接法(neighbor-joining method,NJ)构建系统进化树,校验参数Bootstrap 设置1 000次。利用在线工具MEME(https://meme-suite.org/meme/tools/meme)分析PAT蛋白中的保守基序。最后使用软件TBtools进行可视化分析。
1.3 PAT基因家族表达分析
1.3.1 胡萝卜PAT基因表达分析
将生长约50 d的黑田五寸胡萝卜幼苗分别进行盐胁迫(200 mmol·L-1NaCl)和低温(4 ℃)胁迫处理,12 h后取幼苗叶片,利用天根公司(北京)植物RNA提取试剂盒进行总RNA提取,经浓度、纯度检测后,反转录为cDNA,利用荧光定量PCR技术分析PAT基因胁迫响应情况。取生长约100 d的胡萝卜叶片及根组织,利用上述方法提取总RNA后,反转录获得cDNA,利用荧光定量PCR技术分析PAT基因的组织表达模式。PCR反应体系20 μL,包括10 μL PCR Mix、1 μL模板、1 μL引物(表1),8 μL超纯水。反应程序:95 ℃变性2 min;95 ℃变性15 s,60 ℃/63 ℃退火20 s(退火温度根据引物调整),72 ℃延伸25 s,循环40次;55.0~95.0 ℃制作熔解曲线。试验设置3次生物学重复,以DcActin基因[32]作为内参,利用2-ΔΔCT法计算基因相对表达量,利用TBtools绘制基因表达热图。

表1 引物信息
1.3.2 芹菜、香菜PAT基因表达分析
从CGDB网站下载芹菜、香菜的转录组数据,筛选获得AgPAT、CsPAT基因的FPKM(fragments per kilobase million)值,加1后以2为底取对数,经对数变换后,利用TBtools绘制基因表达热图。
2 结果与分析
2.1 胡萝卜、芹菜、香菜PAT基因家族成员信息
利用生物信息学手段从胡萝卜、芹菜及香菜基因组中鉴定出27、25、27个PAT基因家族成员,分别命名为DcPAT1~27、AgPAT1~25、CsPAT1~27。DcPAT在胡萝卜的9条染色体上均有分布,其中1、7、8号染色体上的成员最少(1个),2号染色体上最多(6个)。在芹菜中,除AgPAT23、AgPAT24、AgPAT25未被定位到染色体上外,其余AgPAT成员分布于除7、10号染色体外的其余9条染色体上,其中2、5、8、9号染色体上仅存在1个成员,3、6号染色体上成员数目最多(5个)。在香菜中,CsPAT25、CsPAT26、CsPAT27未被定位到染色体上,其余CsPAT成员在基因组中的分布亦不均匀,2、4、5、7号染色体上仅有1个成员,10号染色体上则有8个成员(图1)。
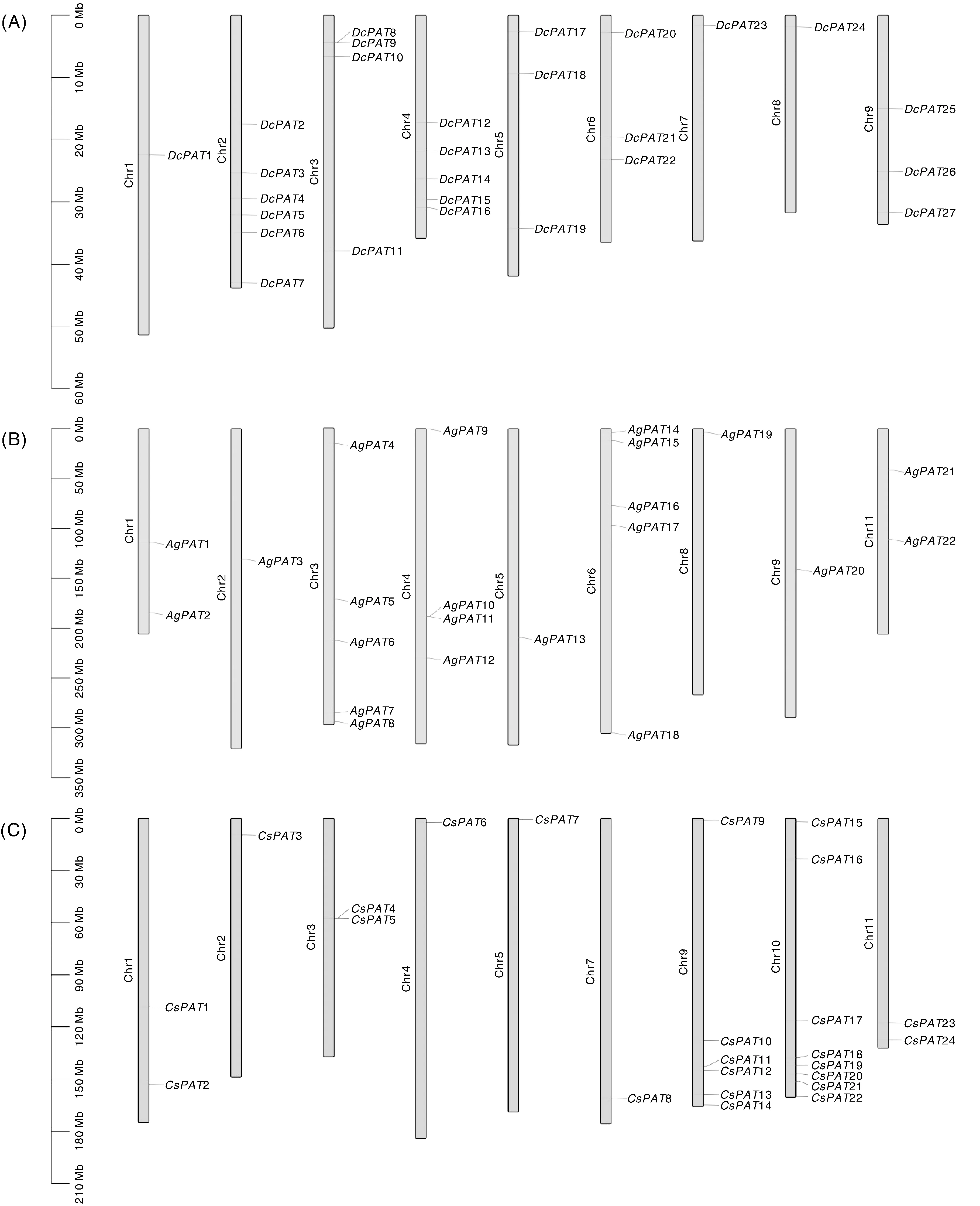
图1 胡萝卜(A)、香菜(B)、芹菜(C)PAT基因的染色体定位Fig.1 Chromosome distribution of DcPAT (A), AgPAT(B) and CsPAT(C)
理化性质分析预测结果表明,27个DcPAT基因长度范围为2 421~12 229 bp,外显子数目为4~13个,编码蛋白质序列长度为277~731 aa,DcPAT蛋白的分子量介于31.20~79.22 ku,等电点介于6.13~9.47。25个AgPAT基因长度为1 651~19 854 bp,外显子数目为3~14个,编码的蛋白质序列长度为230~727 aa,AgPAT蛋白分子量为25.85~79.76 ku,等电点为5.98~9.55。27个CsPAT基因长度介于2 050~13 537 bp,外显子数目介于4~13个,编码蛋白质序列长度介于250~720 aa,CsPAT蛋白分子量为27.89~78.10 ku,等电点为6.27~9.45。除DcPAT16、DcPAT18、AgPAT3、AgPAT13、CsPAT3、CsPAT16、CsPAT25含有2或3个跨膜区外,其他的DcPAT、AgPAT及CsPAT蛋白成员则含有4~6个跨膜区。此外,所有的DcPAT、AgPAT、CsPAT蛋白均主要定位于质膜上(表2)。
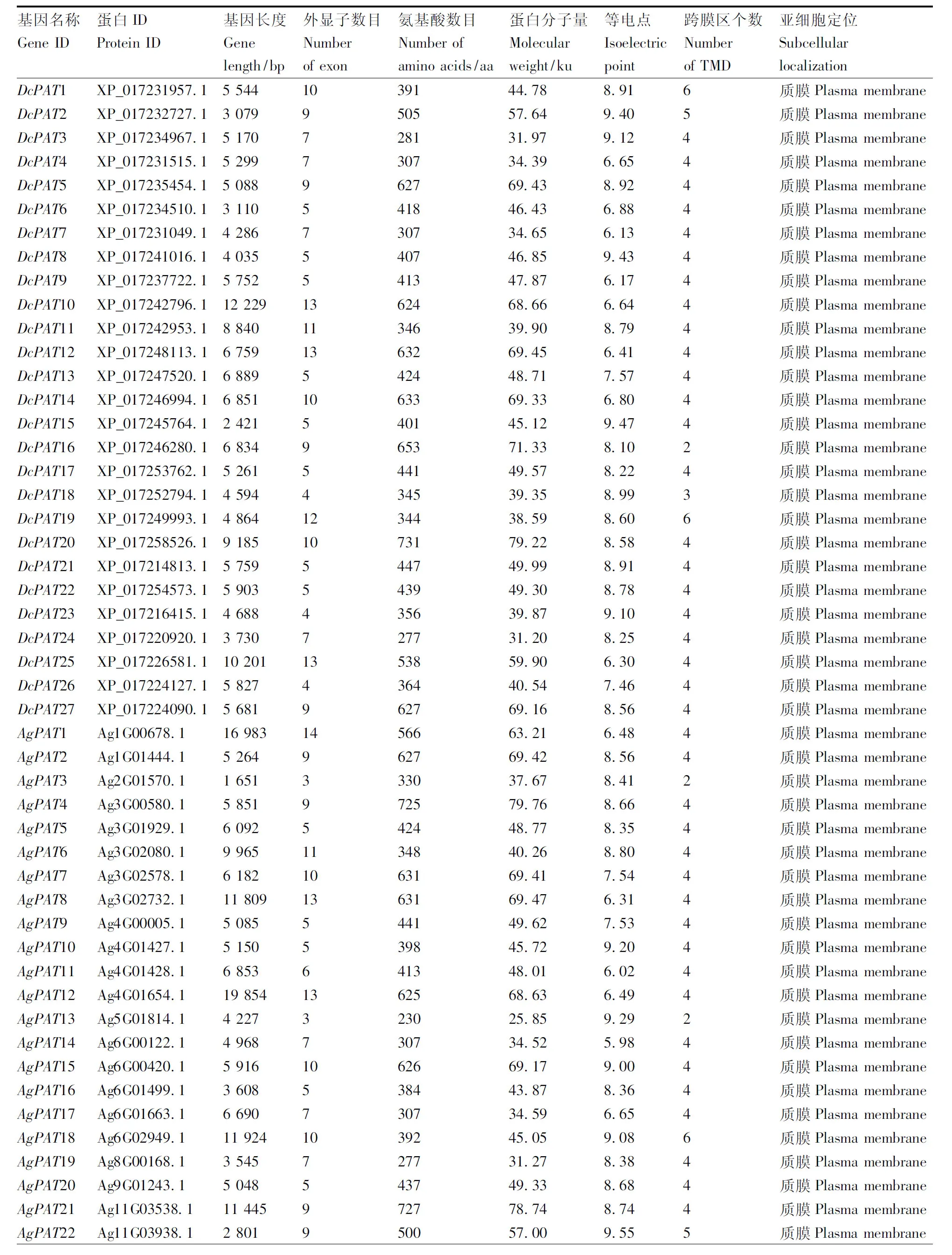
表2 胡萝卜、香菜、芹菜PAT基因家族成员信息
2.2 PAT家族成员系统进化及结构分析
为了分析不同来源PAT蛋白的遗传进化关系及结构多样性,本研究基于来自胡萝卜、芹菜、香菜及其他物种PAT蛋白的DHHC-CRD结构域序列构建系统进化树,并利用MEME进行保守基序分析。
根据进化关系,可将92个PAT蛋白分为7个类群。Group1中成员最多,包括29个伞形科PAT,及3个拟南芥PAT;Group2包括10个伞形科PAT,及苹果、玉米、拟南芥PAT各1个;Group3包括5个伞形科PAT和1个水稻PAT;Group4包括13个伞形科PAT,及3个拟南芥PAT、1个水稻PAT;Group5包括3个伞形科PAT和1个拟南芥PAT;Group6包括17个伞形科PAT和1个拟南芥PAT;Group7中成员最少,仅包括2个伞形科PAT。伞形科PAT蛋白在7个类群中均有分布(图2)。
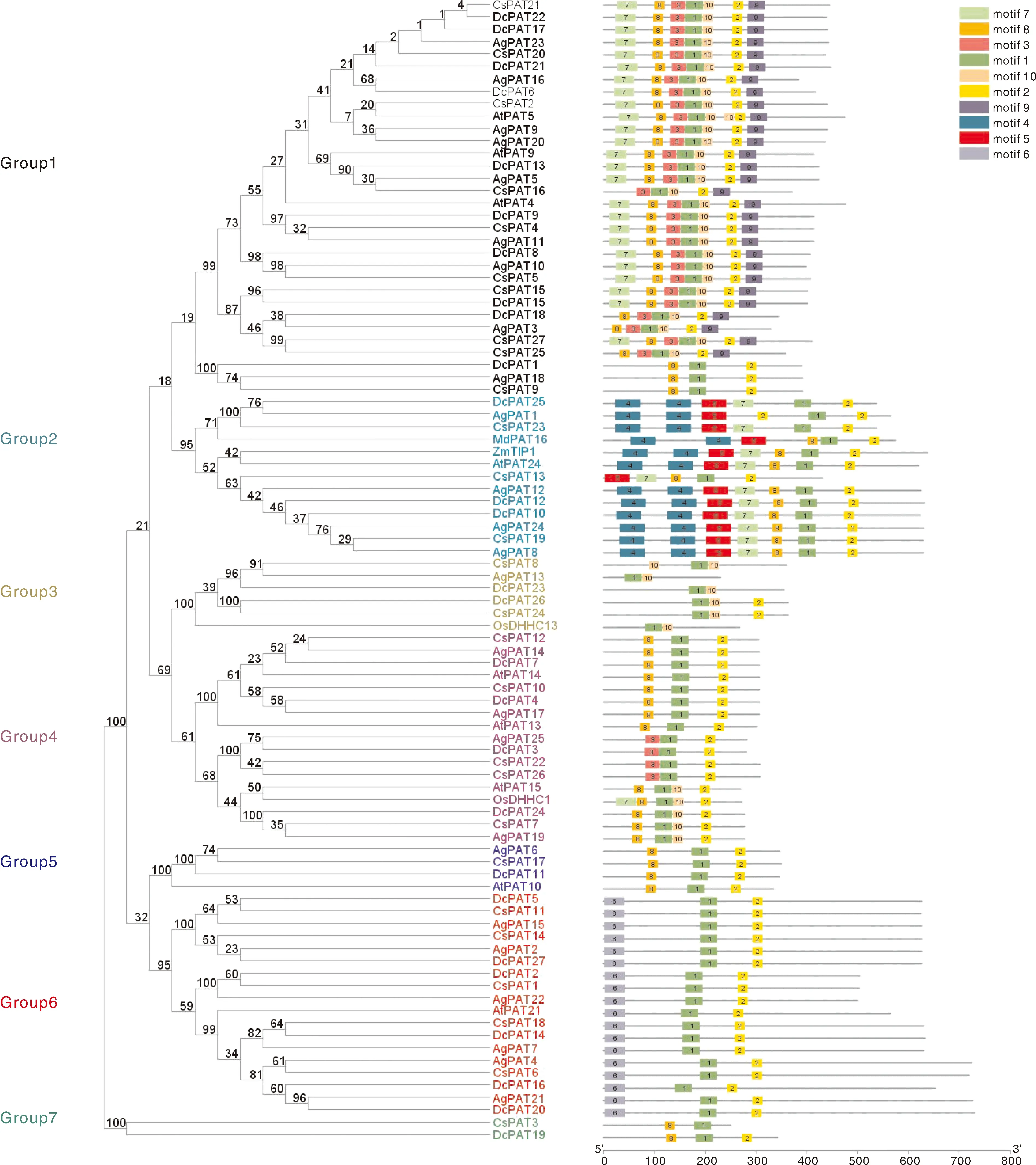
图2 PAT蛋白系统进化及保守基序分析Fig.2 Phylogenetic tree analysis
MEME分析显示,在92个PAT蛋白中存在10个保守基序,即motif1~10(图2)。同一类群中的大部分PAT蛋白具有相似的motif分布,而不同类群间的PAT蛋白所含的motif种类有所不同[33]。所有的PAT蛋白中均存在motif1,而该基序正好位于PAT蛋白的DHHC-CRD保守结构域内(图2、图3)。多数的成员亦含有motif2、motif8,它们分别对应PAT蛋白的保守基序TTxE(threonine-threonine-asparagine-glutamate)和DPG(aspartate-proline-glycine)[3,34]。此外,Group2成员中均含有锚蛋白重复序列(ankyrin repeat)基序motif4或motif5(图3)[35]。
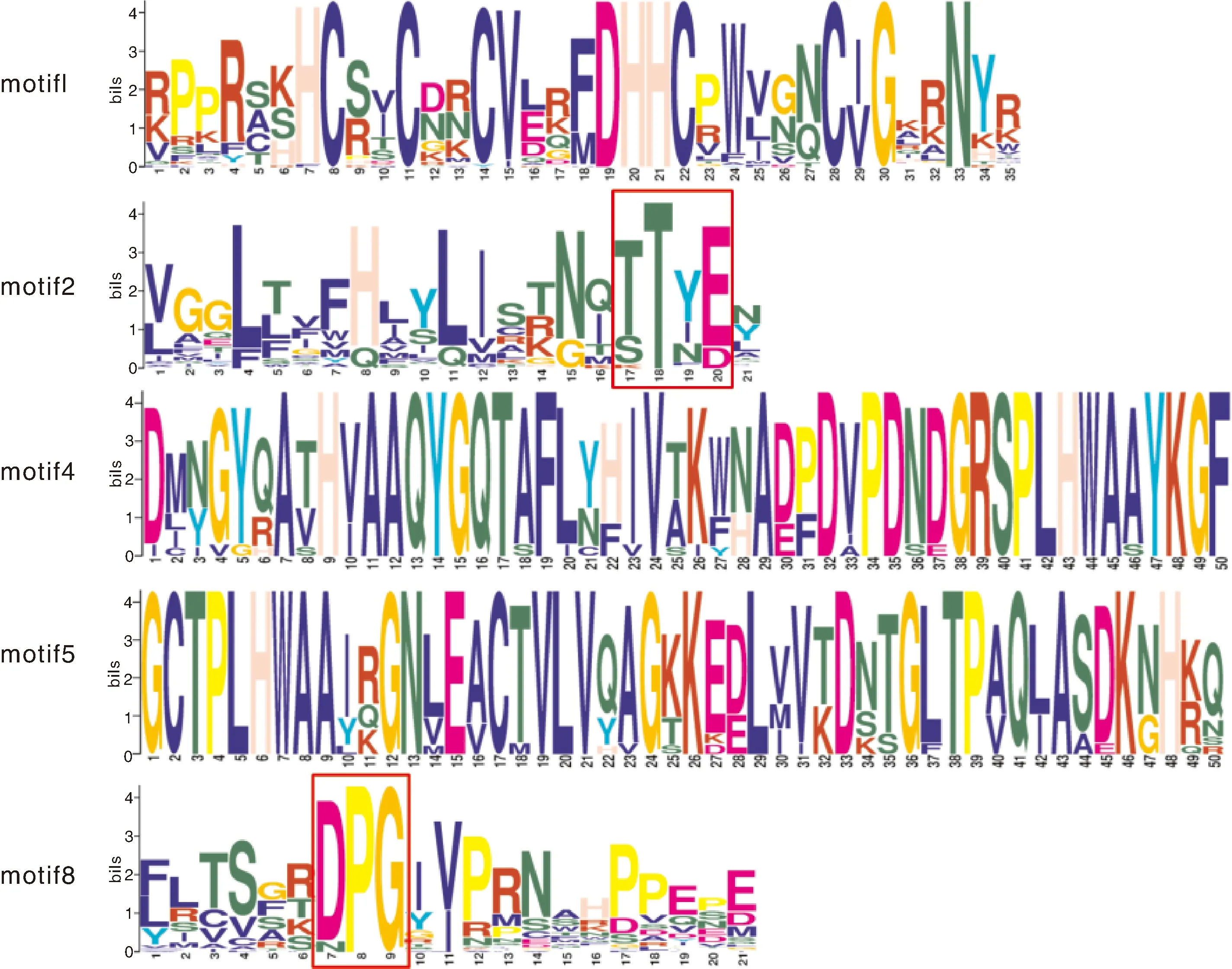
图3 保守基序氨基酸序列分析Fig.3 Sequences of several motifs
DHHC-CRD结构域是PAT蛋白氨基酸序列中较为保守的部位,在其功能发挥过程中具有重要作用。序列比对发现,不同物种间DHHC-CRD结构域的氨基酸序列保守性有所不同。DcPAT中该保守序列为C-x2-C-x7-DHHC-x5-C-x-G-x2-N,完全保守的氨基酸残基个数为9个;AgPAT中的保守序列为C-x2-C-x9-HC-x2-C-x2-C-x4-DHHC-x5-C-x-C-x2-N,完全保守的氨基酸残基个数为13个;CsPAT中保守序列为C-x2-C-x3-V-x3-DHHC-x5-C-x-G-x2-N,完全保守的氨基酸残基个数为10个。此外,在伞形科作物及其他物种来源的PAT蛋白中,序列C-x2-C-x7-DHHC-x5-C-x-G-x2-N的保守性最高(图4)。
2.3 PAT基因家族表达分析
利用荧光定量PCR技术分析胡萝卜PAT基因在根、叶中的表达情况及其在胁迫条件下的表达变化。结果表明,DcPAT10、DcPAT13、DcPAT17、DcPAT20、DcPAT25在叶中的表达量高于在根中的表达量;DcPAT13、DcPAT17、DcPAT20经盐胁迫和低温胁迫处理后均上调表达,但变化倍数不同;DcPAT10在盐胁迫处理后上调表达,而低温胁迫对其表达影响不大;DcPAT25在低温胁迫后下调表达,而盐胁迫对其表达影响不大(图5-A)。
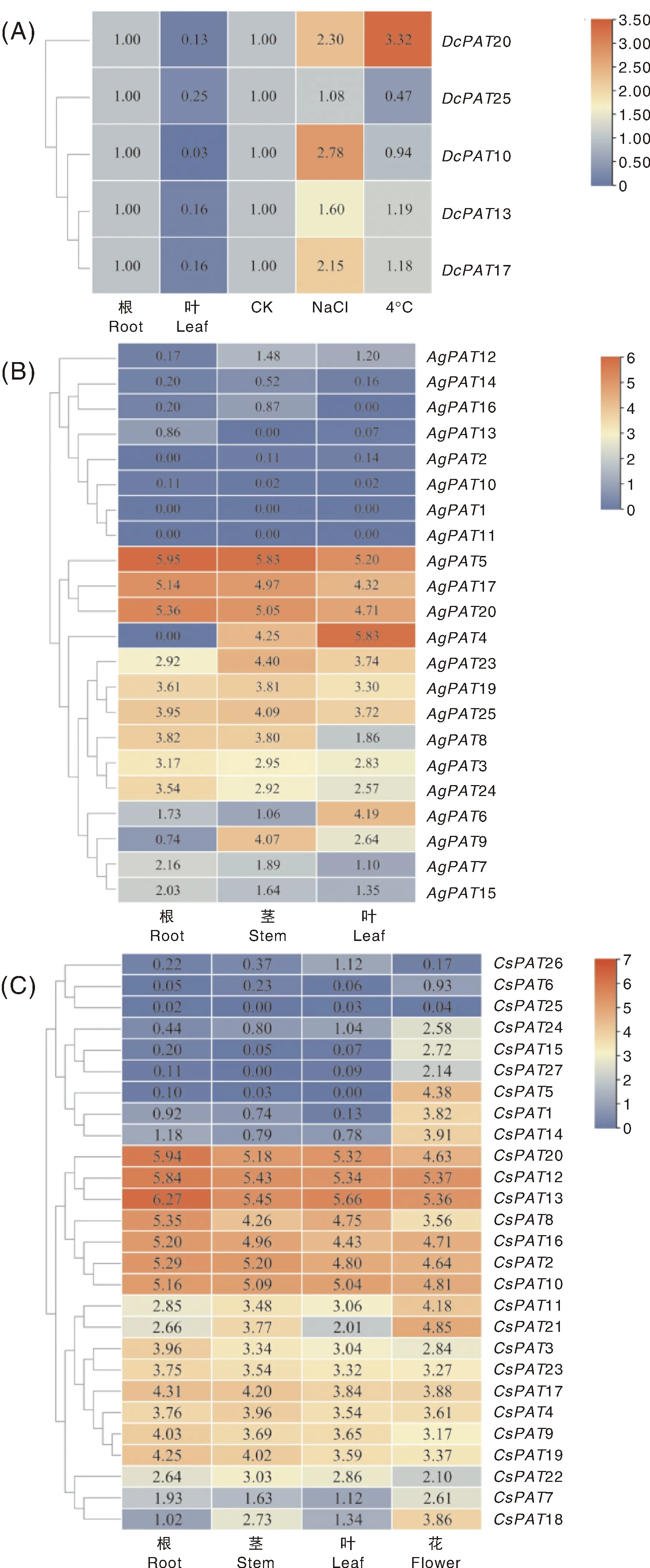
图5 DcPAT(A)、AgPAT(B)、CsPAT(C)基因表达分析Fig.5 Expression analysis of DcPAT(A), AgPAT(B) and CsPAT(B)
利用CGDB网站中芹菜、香菜的转录组数据,对AgPAT、CsPAT基因进行组织表达模式分析。结果表明,AgPAT4、AgPAT9在芹菜根中表达量较低,在茎和叶中表达量相对较高;AgPAT6在叶中的表达量高于其在根、茎中的表达量,而AgPAT8在根、茎中的表达量则高于叶中的表达量;AgPAT1、AgPAT2、AgPAT7、AgPAT10、AgPAT11、AgPAT12、AgPAT13、AgPAT14、AgPAT15、AgPAT16在芹菜的根、茎、叶中呈低水平表达,AgPAT3、AgPAT5、AgPAT17、AgPAT19、AgPAT20、AgPAT23、AgPAT24、AgPAT25在芹菜根、茎、叶中呈较高水平表达(图5-B)。CsPAT6、CsPAT25、CsPAT26在香菜根、茎、叶、花中表达量均较低;CsPAT1、CsPAT5、CsPAT7、CsPAT14、CsPAT15、CsPAT18、CsPAT24、CsPAT27在香菜花中的表达量高于其他组织中的表达量;CsPAT2、CsPAT3、CsPAT4、CsPAT8、CsPAT9、CsPAT10、CsPAT11、CsPAT12、CsPAT13、CsPAT16、CsPAT17、CsPAT19、CsPAT20、CsPAT21、CsPAT22、CsPAT23在香菜根、茎、叶、花呈较高水平表达(图5-C)。
3 讨论
蛋白质的棕榈酰化修饰在细胞信号转导、代谢、免疫响应及宿主—病原体互作等生命活动中发挥着重要作用,含有DHHC保守基序的PAT是催化该修饰过程的关键酶[33,36]。PAT基因通常以多成员的家族形式广泛分布于维管、非维管植物及绿藻中,不同物种间PAT基因数目不同,如团藻(Volvoxcarteri)中仅鉴定到6个PAT基因,而柳枝稷(Panicumvirgatum)中数目则多达52个[6]。本研究利用生物信息学技术从胡萝卜、芹菜、香菜3种伞形科蔬菜作物基因组中分别鉴定到27、25、27个PAT基因家族成员,成员数目相近。PAT是一类膜整合蛋白,可以定位于高尔基体、内质网及质膜等膜系统中[4]。本研究对DcPAT、AgPAT、CsPAT的亚细胞定位情况及跨膜区进行了分析预测,结果表明,它们均主要定位于质膜上,且含有2~6个跨膜区。不过有研究指出,一个蛋白要有正确的亚细胞定位必须保持完整的全蛋白状态,而不能由预测的跨膜区或其他的独立结构域决定[37]。因此,DcPAT、AgPAT、CsPAT的确切定位情况还需在后续研究中通过试验手段进行验证。
构建系统发育进化树是分析不同基因间亲缘关系的常用方法。本研究构建了胡萝卜、芹菜、香菜及其他物种PAT蛋白的系统进化树,并根据进化关系,将92个PAT蛋白分为7个类群。尽管3种伞形科作物在植物分类学上亲缘关系较近,但PAT蛋白的分类情况却有不同的表现[38]。如Group1中既有伞形科作物PAT蛋白,又有来自十字花科植物拟南芥的PAT蛋白;Group4中除含有伞形科、十字花科PAT蛋白外,还含有单子叶植物水稻的PAT蛋白。庞宏光[33]系统研究了来自梨、拟南芥、水稻及苹果的123个PAT蛋白,也得出了类似的结果。Yuan等[6]构建了31个植物物种共804个PAT蛋白的系统进化树,并将它们分为8个类群。所有物种的PAT蛋白在类群Ⅰ、Ⅴ、Ⅶ中均有分布,而类群Ⅱ、Ⅲ、Ⅳ中均不含有绿藻植物PAT蛋白,表明类群Ⅱ、Ⅲ、Ⅳ中的PAT蛋白可能起源于蕨类与绿藻植物的物种分化之后。蛋白质结构是其功能发挥的基础。本研究在供试的92个PAT蛋白中共检测到10种保守基序,所有成员均含有DHHC-CRD保守结构域对应的保守基序motif1[33],这预示着获得的伞形科PAT蛋白具有潜在的棕榈酰基转移酶活性[39],进一步分析DHHC-CRD保守结构域的氨基酸序列,发现其在3种伞形科作物间已发生变异(芹菜中的保守残基最多,胡萝卜中的保守残基最少),这种现象在其他研究中也存在,可能对PAT蛋白的活性造成一定的影响[34],因此,需要对鉴定到的PAT蛋白开展活性及功能研究。
了解PAT基因的时空表达特性及其对逆境胁迫的响应情况,有助于阐释其在生命活动中的作用。胡萝卜PAT家族成员的表达分析结果显示,DcPAT10、DcPAT13、DcPAT17、DcPAT20、DcPAT25主要在叶中表达,且能够响应胁迫处理,暗示这些基因在胡萝卜根、叶发育及非生物胁迫响应过程中具有一定的作用[40]。基于CGDB网站中芹菜、香菜的转录组数据,我们发现AgPAT4、AgPAT6、AgPAT8、AgPAT9在不同的芹菜组织间表达有差异,而其余的AgPAT成员则在被测组织中呈现较为一致的高水平或低水平表达;CsPAT1、CsPAT5、CsPAT7、CsPAT14、CsPAT15、CsPAT18、CsPAT24、CsPAT27主要在香菜花中表达,其他的CsPAT成员亦在被测组织中呈现较为一致的高水平或低水平表达。这些在组织间表达有差异的PAT成员可能在芹菜、香菜的不同组织形态建成中有重要作用[41-42],而组织表达模式类似的PAT成员可能具有相似的功能。ZmPAT12在玉米被测组织中的表达量最低,ZmPAT32表达量最高,而多数ZmPAT基因在幼苗及花中的表达量高于其他组织的表达量。此外,ZmPAT基因的表达还受到胁迫处理(NaCl、聚乙二醇、甘露醇)的影响[6]。梨中多数的PAT基因在不同组织中为组成型表达,个别成员表现出一定的组织表达特性,且有部分成员在被测组织中均表现出较低的表达水平[33],这种表现较为一致的低水平表达在本研究的AgPAT、CsPAT表达结果中也存在。
本研究在胡萝卜、芹菜、香菜中各存在27、25、27个PAT蛋白,不均匀地分布于染色体上;根据进化关系,可分为7个类群,其序列中均含有DHHC-CRD结构域;DcPAT、AgPAT、CsPAT在不同组织间的表达存在差异,但又有类似之处,在3种作物的形态建成中具有一定的作用,此外DcPAT能够响应逆境胁迫。

