实时荧光定量PCR技术在湖南油菜根肿病菌检测中的应用
周游 谢芳玲 肖蓉等
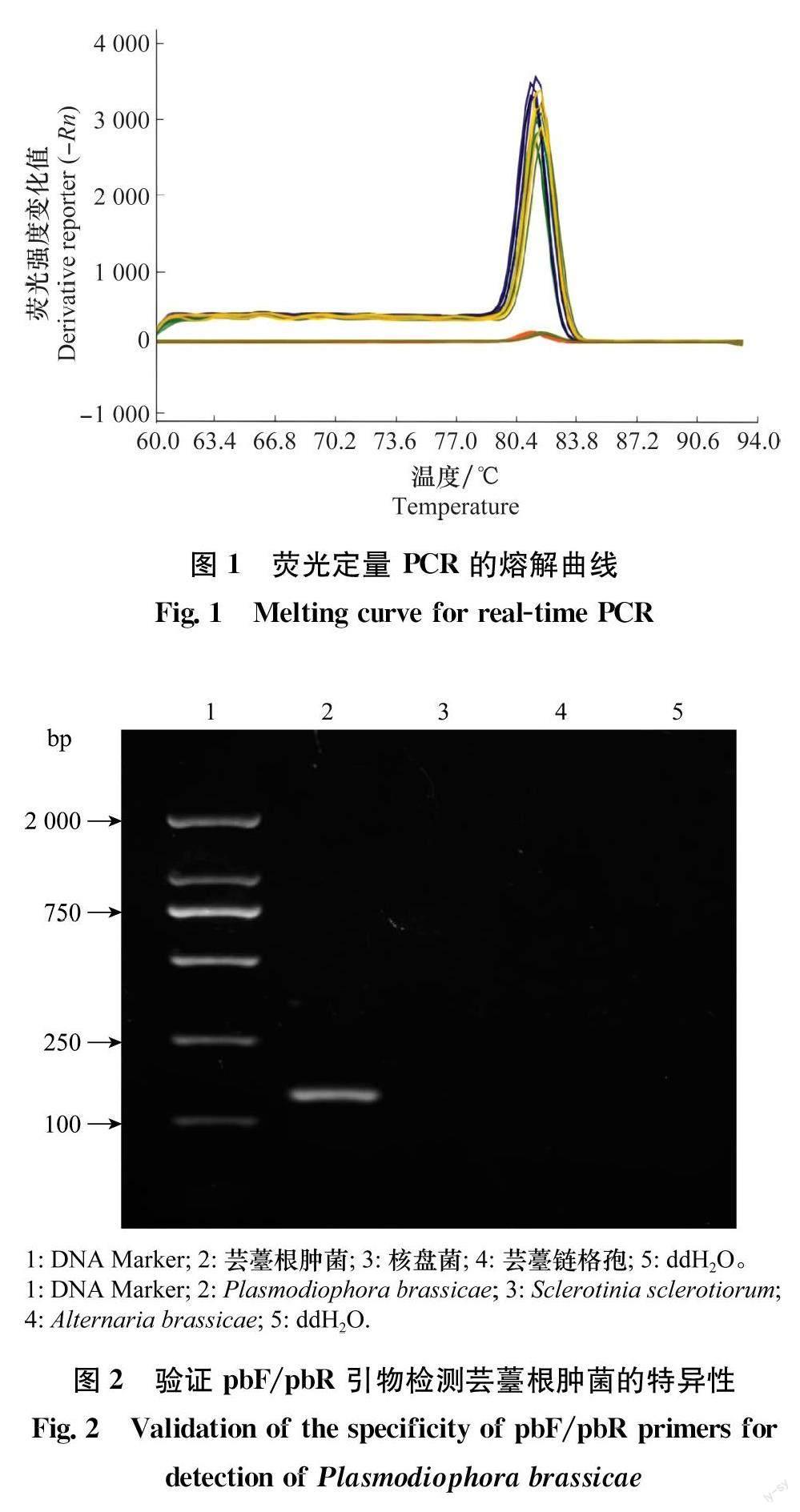
关键词 油菜根肿病;实时荧光定量PCR;休眠孢子;检测
中图分类号:S 432.44 文献标识码:A DOI: 10.16688/j.zwbh.2022282油菜作为湖南省的主要油料作物,其种植面积居全国首位[1]。近年来,由于油菜根肿病的发生和蔓延,严重影响油菜的产量和品质,对湖南油菜产业构成重大威胁。油菜根肿病是由芸薹根肿菌Plas-modiophora brassicae侵染并引起的一种破坏性土传病害[2]。该病害主要由带菌土壤中的休眠孢子传播,休眠孢子可在没有寄主植物的情况下在土壤中存活20年[3]。对休眠孢子的早期检测有助于及时采取相应措施防止该病害进一步传播,但芸薹根肿菌作为专性寄生菌,不能人工培养,且传统PCR检测技术不能对初始模板准确定量分析,也无法避免污染时出现的假阳性[4]。而具有定量准确、特异性强、灵敏度高、操作简便等优点的实时荧光定量PCR逐渐受到青睐和广泛应用[5]。Wallenhammar等采用DNA提取和纯化以及PCR分析,将探针和qPCR技术相结合建立了一种稳定而快速的用于检测和定量田间土壤样品中休眠孢子的方法[6]。Deo-ra等建立的多重TaqMan qPCR测定法提高了芸薹属植物土壤中休眠孢子的检测灵敏度。将竞争性内部阳性对照(competitive internal positive control,CIPC)用于该测定法可以更准确地估计土壤中的休眠孢子,也减少了假阴性的可能性[7]。Li等开发了SYBR Green Ⅰ实时荧光定量PCR方法检测出土壤样品中休眠孢子的检测限为1000个/g,同时验证了该方法具有高度特异性[8]。宋琼等采用SYBR GreenI实时荧光定量PCR检测体系对采集的42份土样所含根肿病菌休眠孢子进行定量检测,探索了土壤中根肿病菌数量与作物根肿病发病之间的关系[9]。
本文对2021年-2022年从湖南各地采集的64份油菜根肿病田块土样进行系统整理,并根据芸薹根肿菌ITS序列设计一对特异性引物,应用qPCR技术检测湖南各地土样的休眠孢子数量,总结出休眠孢子数量对油菜田发病程度的影响,此方法可以作为精准检测芸薹根肿菌的技术指导,有助于防止该病害进一步传播。
1材料与方法
1.1试验材料
1.1.1供试病样
含根肿病菌的样品采自湖南省油菜种植区各乡镇油菜根肿病植株。将病株肿根洗净后,编号并装入密封袋,置-20℃冰箱中保存。
1.1.2供试土样
分别采自湖南省怀化市、常德市、岳阳市、吉首市等各乡镇油菜种植区土样共64份。采集土样时,挖取距地表约5~10 cm的油菜病株根系及周围土壤,对整块油菜田采用随机五点取样法并将采集的土样混合均匀。
1.2试验方法
1.2.1土壤处理
将采集的土样放置于阴凉处,风干后用研钵研磨,将磨碎的土样过380μm孔径的筛网后,装入密封袋并编号,保存于-20℃冰箱。
1.2.2油菜肿根DNA提取
取少量洗净、切碎的油菜肿根采用CTAB法提取总DNA[10],通过1%琼脂糖凝胶电泳检测提取质量。
1.2.3特异性引物设计和PCR扩增
根据芸薹根肿菌的ITS序列应用PrimerPremier 5.0软件设计一对特异性引物pbF/pbR,由北京擎科生物技术有限公司合成。引物序列为pbF(5′-ACAACGATGAAGAACGCAGCGAACT-3′)和pbR(5′-CGCAAACAAACAGAAACCGA-CACTC-3′)。PCR反应体系(25μL)为:2×Mix12.5μL,PbF(10μmol/L)和PbR(10μmol/L)各1μL,DNA模板1μL,ddH2O 9.5μL。擴增程序为:94℃预变性30s;98℃变性10s,60℃退火10s,72℃延伸15s,34个循环;72℃延伸2min。以ddH20为对照。扩增后进行1%琼脂糖凝胶电泳检测。
1.2.4制备标准质粒
纯化PCR产物,将纯化产物与pMD18-T(TaKa-Ra)载体连接,转化大肠杆菌感受态细胞Trelie 5α(北京擎科生物技术有限公司),取100、200μL菌液涂布到含有氨苄(50μg/mL)的LB固体培养基上,置于37℃恒温培养箱倒置培养12~16 h。做菌落PCR,随机挑取被鉴定为阳性克隆的3个单菌落,在LB液体培养基中振荡培养4h,送北京擎科生物技术有限公司测序验证。提取经测序验证正确的菌株质粒作为标准质粒。
1.2.5提取土壤DNA
称取0.25g过筛细土,使用DNeasy PowerSoil Pro Kit(德国QIAGEN GmbH)提取土壤DNA,将提取的DNA于-20℃冰箱中保存。
1.2.6实时荧光定量PCR
总反应体系为20μL:Platinu SYBR GreenqPCR SuperMix-UDG with ROX(Invitrogen)10μL,pbF(10μmol/L)和pbR(10μmol/L)各0.5μL,DNA模板1μL,ddHO 8μL。反应条件为:50℃热激活2min,95℃预变性3 min;95℃变性15s,63℃退火30s,72℃延伸30 s,共40个循环;熔解段94℃30s,60℃90s,94℃10s。每个样品设3次重复,检测结果取平均值。
1.2.7检测方法灵敏度
将标准质粒DNA浓度按10倍梯度稀释为3×10,3X10,3×10,3×10,3×10μg/μL进行qPCR扩增,获取检测样品Ct值,并与常规PCR的最低检测限对比,分析qPCR检测体系的灵敏性。
1.2.8实地调查
对湖南各地主要油菜种植区采取实地调查的方式,调查方法为随机五点取样法,每点拔4株,共20株,洗净根部的泥土,根据病害分级标准记录当地发病程度。分析发病程度与休眠孢子数量的关系。
根肿病苗期病害分级标准:0级:根部无肿瘤;1级:侧根有小肿瘤;3级:主根肿大,其直径小于2倍茎基部;5级:主根肿大,其直径是茎基部的2~3倍;7级:主根肿大,其直径是茎基部的3~4倍;9级:主根肿大,其直径是茎基部的4倍以上或肿大的根部变黑。
成株期病害分级标准:0级:无病;1级:肿根只附着在侧根上,数量占根系全部的1%~25%;2级:主根上有肿根附着,侧根上肿根数量占25%以上;3级:肿根数量占50%~75%的根系,主根上有肿根附着;4级:肿根数量占75%以上的根系,主根上有肿根附着。
病情指数=∑(各级病株数×各级代表值)/(调查总株数×最高病级值)×100;
发病率=发病株数/调查总株数×100%。
2结果与分析
2.1引物pbF/pbR的特异性评价
利用针对芸薹根肿菌的特异性引物pbF和pbR进行PCR扩增,经1%琼脂糖凝胶电泳后得到目的片段为143 bp,无非特异扩增产物。荧光定量熔解曲线(图1)只有单个峰值说明该引物特异性良好,扩增产物经测序并与在NCBI数据库中比对发现,与芸薹根肿菌部分基因相似性超过99%,可用于检测根肿菌。
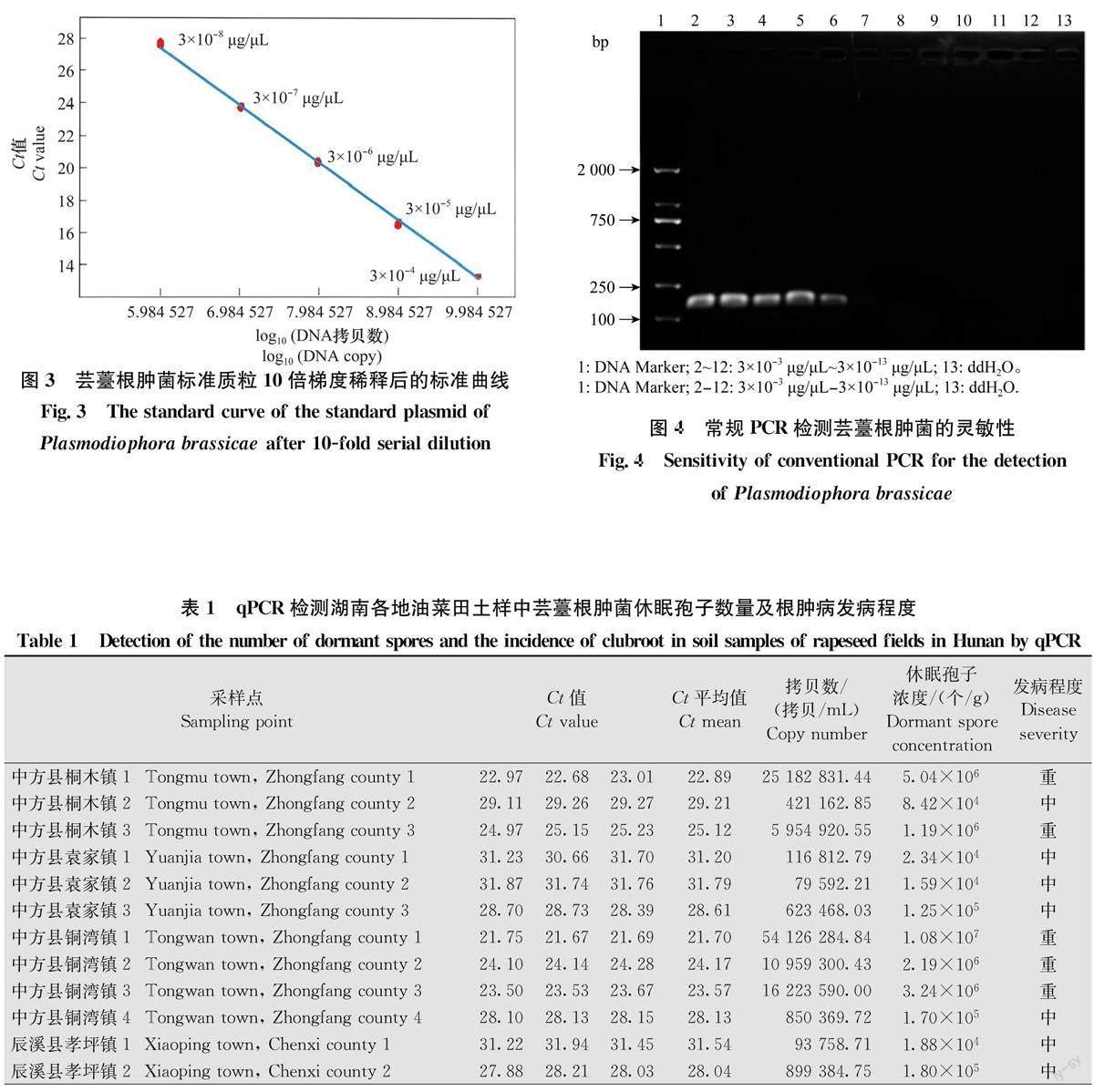
以油菜菌核病核盘菌Sclerotinia sclerotiorum(Lib.) de Bary和油菜黑斑病芸薹链格孢Alternar-ia brassicae (Berk.)Sacc.所提取的DNA模板进行PCR扩增,以ddHO作为空白对照,验证该引物的特异性。结果表明该引物只对芸薹根肿菌的基因组DNA进行有效扩增,而其他病害及阴性对照均未出现条带(图2),说明该引物对芸薹根肿菌具有很好的特异性。
2.2质粒标准曲线的建立
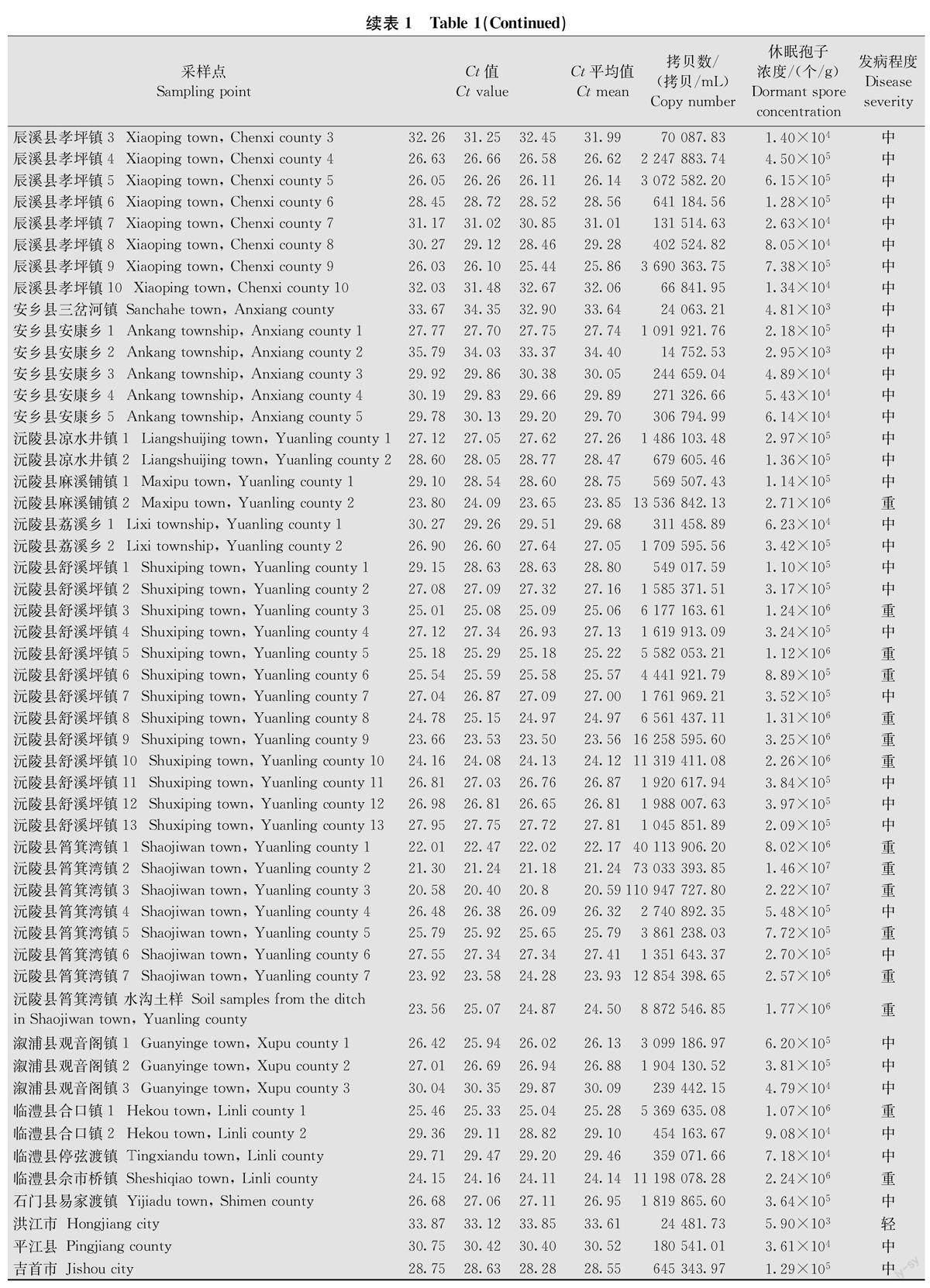
将标准质粒按10倍梯度稀释为5个浓度(3×10,3×10,3×10,3×10,3×10μg/μL)进行扩增,获得标准曲线(图3)并计算回归方程,根肿菌质粒DNA拷贝数(X)的对数和对应的Ct值之间的线性关系表达式为:Ct=-3.561×logX+49.242(R=0.999),扩增效率为90.903%,在浓度3×10~3×10μg/μL范围内Ct值与标准质粒浓度线性关系良好。质粒拷贝数根据公式进行计算:质粒拷贝数=N·6.02×10/MW·10,N為质粒浓度,单位ng/μL,MW为重组质粒分子量一线性质粒长度×660,660为一个碱基的相对分子质量。
2.3灵敏度检测
将标准质粒按10倍梯度稀释后,分别用常规PCR和qPCR进行扩增。结果表明,常规PCR检测到的最低浓度为3×10μg/μL,低于该浓度无扩增条带(图4)。当检测浓度为3×10-Uμg/μL时Ct值为35. 92,Ct值大于35判定为阴性,荧光定量PCR检测体系的最低检测限为3×10μg/μL(Ct=32.05),即qPCR检测灵敏度比常规PCR灵敏度高100倍。
2.4 qPCR检测湖南各地土样休眠孢子数量
对采自湖南怀化市、常德市、岳阳市、吉首市的64份油菜种植区土样应用qPCR体系检测可知休眠孢子数量为2.95×10~2.22×10个/g(表1),其中沅陵县、中方县和临澧县的各乡镇发病田块的休眠孢子含量较高,据实地调查,休眠孢子含量较高的田块其发病程度也较为严重,其中部分发病严重的田块发病率可达100%。沅陵县筲箕湾3号田块发病最重,检测出休眠孢子数目为2.22×10个/g。各地患病土壤中的休眠孢子基本大于10个/g,表明当土壤中休眠孢子数量≥10个/g时,油菜易发生根肿病且土壤中休眠孢子的数量直接影响油菜田的发病程度。
3结论与讨论
实时荧光定量PCR技术是在PCR反应体系中加入荧光基团,通过荧光信号实时监测整个PCR反应进程,最后通过标准曲线对起始模板的拷贝数进行定量分析[11]。其检测方法分为SYBR Green Ⅰ法[12]和TaqMan探针法[13]。本研究采用SYBRGreen I法对芸薹根肿菌进行定量检测,SYBR只结合双链DNA,可以通过熔解曲线保证PCR反应的特异性。相较于Taq Man探针法通用性好、价格低、应用广泛[14]。
如今,实时荧光定量PCR技术在公共卫生[15-16]、食品安全[17-18]、基因筛选[19-20]等领域有着广泛的应用。在植物病原检测方面的研究也在不断深入发展[21],陈清清等将实时荧光定量PCR技术应用于小麦根腐病菌索氏平脐蠕孢Bipolaris soro-kiniana的检测[22]。余鹏举等利用SYBR GreenⅠ法优化建立了检测核桃胶孢炭疽菌Colletotrichum gloeosporioides实时荧光定量PCR检测体系[23]。通过实时荧光定量PCR技术对病原菌进行定量检测可以在短时间内掌握病原菌的变化规律和发展趋势[24]。
芸薹根肿菌主要以休眠孢子的形式在土壤中越夏越冬。土壤中休眠孢子数量和发病的严重程度有着密切联系[25]。本研究对湖南各地采集的64份土样进行了实时荧光定量PCR检测,明确了湖南各地病田中根肿病菌休眠孢子的数量。当土壤中休眠孢子数量≥104个/g时,油菜易发生根肿病,应及时采取有效防控措施。
实时荧光定量PCR实现了快速、精准地定量检测田间芸薹根肿菌的数量,对湖南油菜根肿病的流行监测预警具有重要意义[26]。然而,qPCR依赖于使用合适的引物和合理的DNA模板,并且无法区分活菌和死菌的DNA[27]。因此该检测方法未来仍需要进一步研究。

