芒柄花黄素对小鼠肠道菌群结构和丰度的影响
杨翼飞,徐桂瑶,王 琴,赵倩云,罗浩铭,曾久平,吴 旭,2,李明星
1.西南医科大学药学院药理系细胞治疗与细胞药物泸州市重点实验室(泸州646000);2.川南医学转化研究院(泸州 646000)
人体肠道内定植着数万亿的微生物群(细菌、真菌与病毒),这类被称为肠道菌群的微生物能与宿主长期相互作用,形成“宿主—菌群”共生关系,通过参与和调控宿主一系列生命活动而影响机体的健康与疾病发展[1]。在肠道菌群中有150~170 种细菌占主导地位,并发挥着肠道结构屏障维持、免疫保护、代谢与神经调节等重要功能[2]。
异黄酮类化合物是一类广泛存在于天然植物中的酚类化合物,具有抗炎、抗氧化、抗菌、抗病毒、抗血栓与免疫调节等作用[3-5]。芒柄花黄素(formononetin,FMN)是一种富含于豆科植物如红车轴草等的异黄酮化合物,也是甘草、当归、黄芪、葛根和鸡血藤等中药的活性成分之一,已被证实具有抗炎、抗氧化、抗菌和抗凋亡等多种活性[6]。目前有诸多研究结果表明,FMN能够有效抑制生殖系统、呼吸系统和消化系统等多种恶性肿瘤细胞的增殖与生长,如乳腺癌[7]、肺癌[8]、胃癌[9]和膀胱癌[10]等。此外,已有研究指出,FMN 作为黄芪有效成分之一,是黄芪治疗炎症性肠病动物模型的主要药效物质之一[11],同时FMN 也在利用黄芪提取物改善小鼠肠道菌群结构进而抑制结肠癌进展的研究中发挥重要作用[12]。此外,FMN作为一种潜在益生元,可以有效调节宿主代谢和降低全身系统炎症,改善肠道菌群结构,并可通过提高乙酸和丁酸产生菌丰度缓解高脂饮食导致的肥胖[13]。然而,FMN 对宿主肠道菌群生长的直接影响研究却鲜见报道。本文拟采用16S rRNA高通量测序技术,研究FMN对小鼠肠道菌群结构与丰度的影响,揭示含有FMN 成分的中药对肠道菌群生长以及可能对机体健康状况产生的影响。
1 材料与方法
1.1 实验动物
12只无特定病原体(specific pathogen-free,SPF)级雄性C57BL/6J小鼠,6周龄,购于斯贝福(北京)生物技术有限公司,饲养于西南医科大学SPF 级实验动物中心。本实验对动物的处置完全遵守对动物的伦理要求,并经西南医科大学伦理委员会审核批准(编号:201703142)。
1.2 材料与试剂
芒柄花黄素(Solarbio,SF8070),E.Z.N.A.® soil DNA kit(Omega Bio-tek,Norcross,GA,USA),AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA),NEXTflex Rapid DNA-Seq Kit(Bioo Scientific,USA)。
1.3 主要仪器
超微量分析天秤(美国康州HZ 电子有限公司,HZK-FA210S);涡旋混匀器(德国IKA 公司,C-MAGHS7);GeneAmp PCR 仪(美国应用生物系统ABI 公司,9700);Quantus Fluorometer(美国普洛麦格Promega公司)。
1.4 实验方法
1.4.1 动物给药与样品采集 将12只C57BL/6J雄性小鼠饲养于SPF 动物房,适应7 d 后,随机分为对照组(CTRL)和给药组(FMN),每组各6 只。给药组小鼠每天灌服FMN,剂量为5 mg/kg(根据健康成年人每日推荐临床剂量与小鼠之间按体表面积折算的等效剂量比值计算确定),对照组小鼠每天灌胃与给药组相同体积的PBS。每天下午5:00~6:00 灌胃给药,持续10 d。所有小鼠在标准条件下饲养:12 h明暗周期交替,自由取食和饮水。实验动物中心条件保持在(23±2)℃的恒定温度。
实验第11 d,取各组小鼠新鲜粪便收集于无菌1.5 mL EP 管中,干冰速冻后,立即转移于-80 ℃冰箱保存备用。
1.4.2 DNA提取及测序 将小鼠新鲜粪便用干冰运送至测序公司,根据DNA 提取试剂盒说明书的具体步骤对小鼠粪便中微生物总基因组DNA 进行提取。后续的一系列PCR扩增、PCR产物纯化、检测与定量方法如本团队前期的研究所报道[14-15]。最后利用Illumina 公司的Miseq PE300 平台进行微生物群落多样性及交互式分析(上海美吉生物医药科技有限公司)。
1.4.3 序列处理和分析 使用Fastp 0.19.6 软件对样本原始测序序列进行质控,并使用Flash 1.2.11 软件进行拼接。使用Uparse 7.0.1090,把所得序列按照97%的相似度,进行操作分类单元(operational taxonomic units,OTU)聚类,并将嵌合体剔除。利用RDP 2.11软件对每条序列按照物种分类顺序进行注释,比对Silva 138 16S rRNA数据库,将比对阈值设置为70%。
用Mothur 1.30.2 绘制稀释曲线和Alpha 多样性进行分析。通过QIIME 1.9.1 采用主坐标分析(PCoA)进行Beta 多样性分析。利用上海美吉生信云平台的LEfSe程序实现线性判别分析(LDA)。
1.5 统计学分析
2 结果
2.1 Alpha多样性分析
Alpha多样性分析是衡量物种丰度的指标,用于反映微生物群落的丰富度和多样性。本研究主要分析Sobs、Chao、Ace 和Shannon 四个Alpha 多样性指标,其中Sobs、Chao 和Ace 这三个指数可反映群落的物种数量丰度,值越大,微生物群落数量越丰富。Shannon 指数可衡量微生物组成的多样性,值越大,微生物群落多样性越高。从图1A-1C可以看出,与对照组相比,FMN组 的Sobs、Chao 和Ace 指数值均有显著增加(P <0.05)。由图1D可知,FMN组较对照组Shannon指数值明显升高(P <0.05)。

图1 Alpha多样性指数及稀释曲线Figure 1 Alpha diversity indices and rarefaction curve
稀释曲线从样本中随机抽取测序数据量,观测物种数量(Sobs、Chao 和Ace 指数,图1E-1G)和多样性指数(Shannon 指数,图1H)值曲线图。由分析曲线结果可知,两组样本的稀释性曲线均趋向平坦,可判断本研究中测序数据量足够,测序深度合理,可以准确反映本研究小鼠粪便样本中绝大多数肠道微生物的多样性信息,数据可以进行后续分析。
2.2 Beta多样性分析
Beta多样性分析可比较不同样本间群落组成与结构的相似程度或差异关系。为进一步研究FMN 给药干预后,FMN 组与对照组小鼠肠道菌群结构的相似程度。本研究基于样本操作分类单元(OTU)水平对两组的菌群多样性数据进行主坐标分析(principal coordinates analysis,PCoA)。由图2 可以看出,两组菌群相对处于不同区域,且在PC2轴上有明显差异。
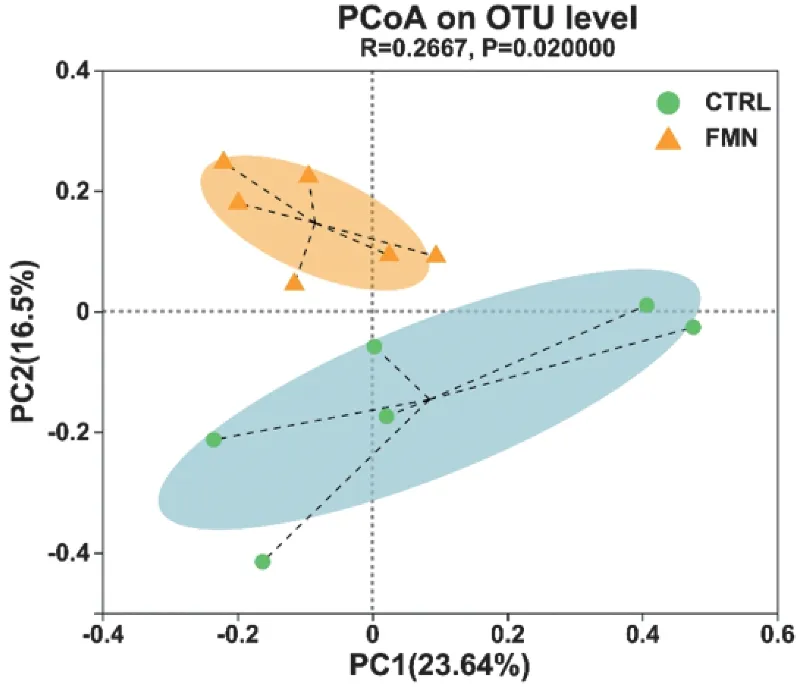
图2 基于OTU水平的PCoA分析Figure 2 PCoA analysis based on OTU level
2.3 物种分类学分析
2.3.1 菌群构成分析Venn 图可用于统计多样本中不同组间所共有和其中单个样本所独有的物种数目,有利于直观的展现不同样本中物种不同分类水平组成的相似性及重叠情况。如图3A所示,本研究根据97%的OTU序列相似度对CTRL和FMN两组的核心OTU进行物种组成分析,对照组平均OTU 数为571,FMN组平均OTU 数为576,其中两组共有545 个相同OTU,而有31个OTU为FMN组所特有,较对照组有所增加。
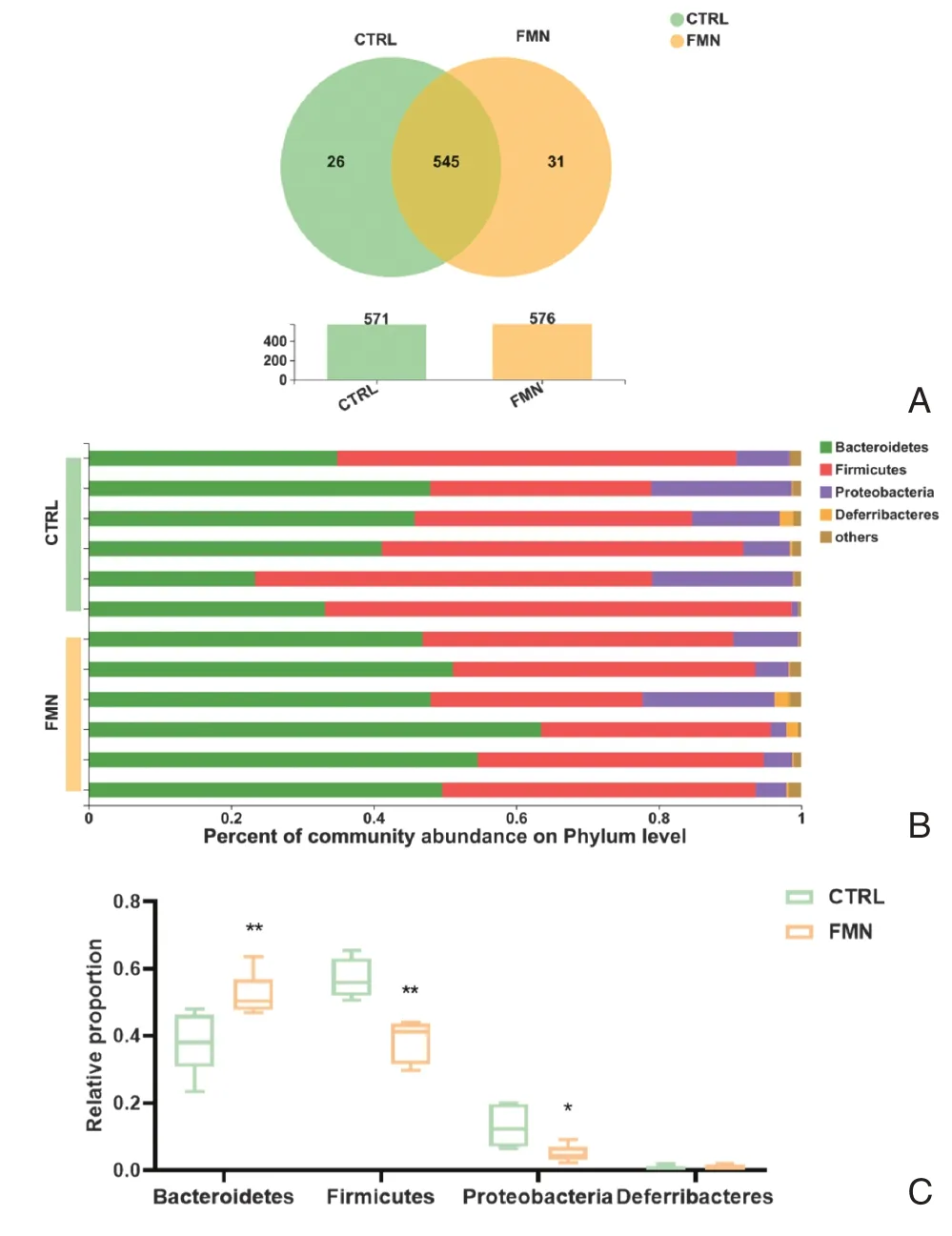
图3 菌群构成分析Figure 3 Analysis of microbial composition
由图3B可知,两组样品的菌群组成在门水平上分析主要分为4个门,分别为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和脱铁杆菌门(Deferribacteres),其中以拟杆菌门和厚壁菌门为主要菌门。对照组拟杆菌门和厚壁菌门比例分别为37.72%和56.92%,FMN 组对应比例分别为52.29%和38.65%。两组主要门水平上的菌群丰度差异(图3C)显示,与对照组相比,FMN 组拟杆菌门丰度显著增加(P <0.01),厚壁菌门丰度显著减少(P <0.01),变形菌门丰度显著减少(P <0.05),脱铁杆菌门有上升趋势,但无显著性差异(P>0.05)。
2.3.2 属水平菌群组成及物种差异性分析 在菌群属水平(图4A)上,FMN 组相较于对照组有7 个属明显增加,其中FMN 组中norank_o__Clostridiales显著增加(P <0.01),unclassified_o__Clostridiales、颤螺旋菌属(Oscillospira)、Odoribacter、瘤胃球菌属(Ruminococcus)、脱卤杆菌属(Dehalobacterium)和unclassified_f__Helicobacteraceae均增加,差异有统计学意义(P <0.05)。
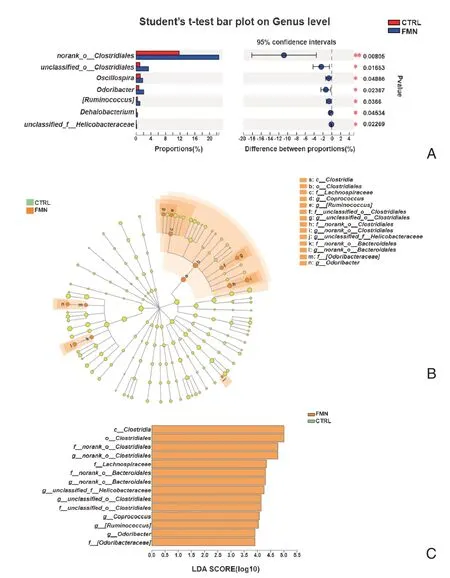
图4 属水平菌群组成及物种差异性分析Figure 4 Analysis of microbial composition and difference on genus level
为进一步探究芒柄花黄素对小鼠肠道菌群属水平菌群组成的影响,确定两组之间具有显著差异的微生物类群,在组间进行LEfSe 分析,得到分类进化分支图(图4B)和LDA 评分图(LDA >3.5,图4C)。结果显示,FMN 组中,梭菌目(Clostridiales,从纲到目)、毛螺菌科(Lachnospiraceae)、粪球菌属(Coprococcus)、瘤胃球菌属(Ruminococcus)、unclassified_o__Clostridiales(从科到属)、norank_o__Clostridiales(从科到属)unclassified_f__Helicobacteraceae、norank_o__Bacteroidales(从科到属)、臭气杆菌科(Odoribacteraceae)、Odoribacter为优势富集菌群。
如图5所示,与对照组相比较,FMN组中粪球菌属(Coprococcus)(P <0.01)、瘤胃球菌属(Ruminococcus)(P <0.05)、unclassified_o__Clostridiales(P <0.01)、norank_o__Clostridiales(P <0.01)、Odoribacter(P <0.05)和norank_o__Bacteroidales(P <0.05)丰度显著增加,而unclassified_f__Lachnospiraceae(P <0.05)较对照组丰度显著降低。
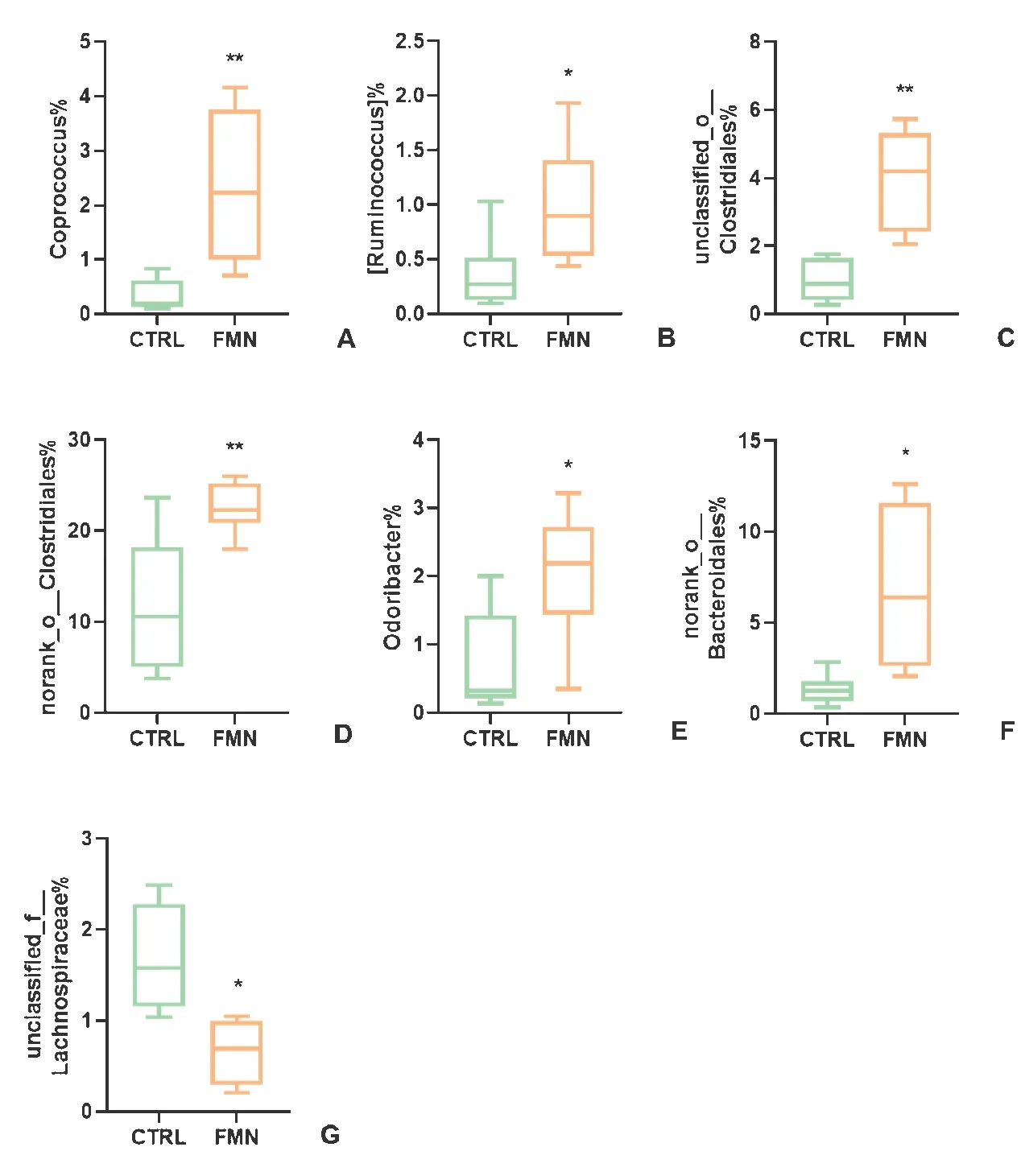
图5 各组间主要差异关键菌属Figure 5 The specific difference of key genus among the groups
3 讨论
定植在宿主肠道中的数万亿的微生物群与宿主之间存在互惠互利的共生关系。宿主为肠道微生物群提供了重要的栖息地和营养物质,而肠道微生物群又通过产生有益的营养物质,如维生素[16-17]和短链脂肪酸(short chain fatty acid,SCFAs)[18-19]的合成能有效维持机体正常代谢和肠道免疫系统的成熟。然而,肠道微生物群稳态发生改变即菌群失调,则将会增加一系列肠道疾病风险[20-22]。因此,维护正常的肠道菌群的稳态对机体健康极其重要。
本研究基于16S rRNA 高通量测序技术,探究了芒柄花黄素对小鼠肠道菌群的影响。通过Alpha 多样性和Beta 多样性分析可知,芒柄花黄素在一定程度上能够提高小鼠肠道菌群的群落多样性及丰富度,并调节菌群结构。此外,基于门属水平对小鼠肠道菌群结构及关键菌属变化分析表明:与对照组相比,在门水平上,FMN给药后拟杆菌门、变形菌门和脱铁杆菌门丰度升高,而厚壁菌门丰度降低;在属水平上,FMN组粪球菌属、瘤胃球菌属、unclassified_o__Clostridiales、norank_o__Clostridiales、Odoribacter和norank_o__Bacteroidales丰度增多,unclassified_f__Lachnospiraceae丰度减少。
早前研究表明,厚壁菌门的增加和拟杆菌门的减少与多种常见高发疾病的发生发展联系密切,如炎症性肠病[23]、肥胖与非酒精性脂肪肝[24]。粪球菌属、瘤胃球菌属、Odoribacter和属于拟杆菌门的norank_o__Bacteroidales,这些肠道菌群为常见的SCFAs 的产生菌,如瘤胃球菌属能够产生包括丁酸盐在内的SCFAs[25-27]。这些益生菌能够帮助宿主分解和利用多糖,且在体内酵解作用产生的SCFAs 能为宿主提供能量,并促进肠道健康,此外,相关SCFAs的增加可以有效降低肠道炎症风险[28-29]。Clostridiales菌属能够发挥抗肿瘤免疫效应从而降低结肠癌风险[30]。有文献报导unclassified_f__Lachnospiraceae的增加与2型糖尿病、直肠癌的发生相关[31-33]。从这些主要菌群在两组之间的变化可以看出,FMN 给药后可使小鼠肠道有益菌群增加而潜在致病菌群减少。
异黄酮作为一类与营养、医药和化妆品领域相关的植物雌激素,有广泛的药理作用[34]。研究表明,人体每日摄入高剂量异黄酮,例如韩国人和日本人平均每天摄入30 mg异黄酮可减少代谢性疾病的发病率,尤其是肥胖[35]。临床研究也显示,异黄酮可极大降低更年期女性的更年期综合症、偏头痛、糖尿病和高血压等症状风险[36-37]。早前的研究结果都提示异黄酮对于人体健康具有潜在的保护效应。而FMN 作为一种被广泛研究的异黄酮成分,经研究证明可促进有益菌的生长。肠道菌群作为人体肝脏以外的第二个代谢性“隐形器官”,对机体正常的新陈代谢和免疫调节至关重要[38-39]。
本研究以肠道菌群为主要切入点,探究FMN 对健康小鼠肠道菌群组成与结构的影响,揭示FMN 对肠道菌群的调节作用,结果显示FMN 可能作为一种潜在益生元,有效调节肠道菌群,从而促进肠道微生态健康。
4 结论
芒柄花黄素可提高小鼠肠道菌群丰富度与多样性,并改变菌群结构、增加有益菌优势。

