红细胞体积分布宽度/血小板比值变化对乙肝肝硬化失代偿期患者进展为肝癌的影响
郑晶冰,孙倩,赵小燕
(河南省驻马店市中心医院 检验科,河南 驻马店 463000 )
乙肝肝硬化(hepatitis B cirrhosis,HBC)是肝细胞癌的重要致病因素,长期炎症状态引起肝脏损伤,会进一步引起基因突变而导致肝癌的发生[1]。据2020 年中国癌症数据统计,肝癌发病率居恶性肿瘤第5 位,而病死率居第2 位[2]。甲胎蛋白(alpha fetoprotein,AFP)是目前肝癌早期诊断的主要指标,AFP 持续升高结合影像学检查,能早期筛查原发性肝癌[3]。然而AFP 对肝癌的灵敏度较低,本身会受活动性肝病的影响,不能有效预测HBC 失代偿期患者肝癌进展风险。因此寻找其他客观指标,早期识别HBC 失代偿期进展为肝癌的高风险人群,对延长患者生存时间、提高生存率具有重要意义。红细胞体积分布宽度(red blood cell distribution width,RDW)反映了红细胞形态大小差异,而肝脏参与了红细胞生成过程,RDW 水平与肝炎、肝硬化等慢性肝病进展有关[4]。血小板计数(platelet count,PLT)是反映凝血功能的重要指标,机体凝血功能与肝脏合成凝血酶原能力有关,有研究表明,肝癌患者常伴有PLT 减少[5]。本研究通过分析RDW/PLT 比值变化及其对HBC 失代偿期患者进展为肝癌的影响,旨在早期预测HBC 进展风险,现报道如下。
1 资料与方法
1.1 研究对象
回顾性纳入2018 年11 月至2020 年5 月驻马店市中心医院收治的48 例HBC 失代偿期进展为肝癌的患者作为进展组,另以1∶2 比例纳入同期96 例HBC 失代偿期未进展为肝癌的患者作为未进展组。
纳入标准:①慢性乙型肝炎符合《慢性乙型肝炎防治指南(2015 更新版)》[6]中相关诊断:HBsAg 为阳性,且超过6 个月;②HBC 符合《内科学(第9 版)》[7]中诊断标准:乙型肝炎引起的肝硬化,影像学检查存在肝硬化征象,经肝活检明确存在假小叶形成;③处于HBC 失代偿期,Child-Pugh 分级为B 级或C 级,即出现肝功能减退,或腹水、肝性脑病、脓毒症等门静脉高压并发症;④原发性肝癌符合《原发性肝癌诊疗规范(2017 年版)》[8]中诊断标准:AFP 逐渐升高不降,或>200 ng/mL 持续2 个月,经影像学检查提示肝脏占位性病变,肝穿刺活检确诊为肝癌。⑤临床资料、实验室检测指标结果完善。排除标准:①合并丙型、丁型等其他类型病毒性肝炎;②自身免疫性、有毒物质等其他因素引起的肝硬化;③合并结核、艾滋病、非典型性肺炎等其他传染性疾病;④存在肺癌、胃癌等其他原发性或继发性恶性肿瘤;⑤既往有腹部相关手术或既往接受过肝动脉介入术等治疗;⑥有大量饮酒史、药物依赖史;⑦体重指数≥28 kg/m2;⑧合并严重心血管疾病;⑨合并凝血功能障碍、贫血或其他血液系统疾病。
1.2 研究方法
1.2.1 治疗方法 所有患者均至少完成抗病毒治疗1 年,具体治疗方案:口服恩替卡韦(石药集团欧意药业,生产批号:20180824,规格:0.5 mg)0.5 mg,1 次/d;或服用替诺福韦(齐鲁制药,生产批号:20181015,规格300 mg)300 mg,1 次/d。
1.2.2 一般资料收集 查阅患者病历资料,记录患者年龄、性别(男性、女性)、吸烟史(每天吸烟1 支以上,且持续1 年以上)、肝癌家族史(直系亲属三代内患有肝癌)、肝功能Child-Pugh 分级(B 级:一般状况、腹水、血清胆红素、血清白蛋白、血清胆红素及凝血酶原时间,5 项评分为7~9 分;C 级:评分≥10 分)、并发症(肝性脑病符合《肝硬化肝性脑病诊疗指南》[9]中相关诊断,腹水:腹部超声提示腹腔积液≥200 mL)、抗病毒药物。
1.2.3 实验室指标检测方法 记录患者相关实验室检测指标,具体检测方法:①于治疗前清晨7 时,使用生化管采集患者空腹静脉血5 mL,使用全自动生化分析仪(深圳迈瑞生物医疗电子,型号 BS-600)测定谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBiL)、白蛋白(albumin,Alb);采用化学发光免疫法测定AFP。②于治疗前、治疗3 个月、6 个月、9 个月、12 个月使用乙二胺四乙酸抗凝管采集患者空腹静脉血5 mL,使用全自动血细胞分析仪(迪瑞医疗科技,型号:BCC-3600)测定RDW、PLT 水平。
1.3 统计学方法
用SPSS 25.0 统计学软件处理数据。用Shapiro-Wilk 正态分布检验计量资料正态性,符合正态分布计量资料以均数±标准差()表示,组间比较行独立样本t检验,多时点比较用重复测量单因素方差分析;偏态分布计量资料组间比较用Mann-WhitneyU检验;计数资料以百分率(%)表示,用χ2检验;用Kaplan-Meier 曲线分析HBC失代偿期患者肝癌进展情况;用Logistic 回归分析检验RDW/PLT 比值变化水平对HBC 失代偿期患者进展为肝癌的影响;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under curve,AUC),分析RDW/PLT 比值水平变化对HBC 失代偿期患者进展为肝癌的预测价值,AUC<0.5 无价值,0.5≤AUC<0.7 价值较低,0.7≤AUC<0.9 价值中等,≥0.9 价值高;P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料、实验室指标
进展组患者Child-Pugh 分级高于未进展组,治疗前AFP 水平高于未进展组,差异有统计学意义(P<0.05)。见表1。

表1 进展与未进展组一般资料、实验室指标比较
2.2 治疗期间RDW/PLT 水平
治疗3 个月、6 个月、9 个月、12 个月,两组患者RDW、RDW/PLT 比值较治疗前降低,PLT 较治疗前升高,组间、时点、组间时点交互比较差异有统计学意义(P<0.05)。见表2,图1~图3。
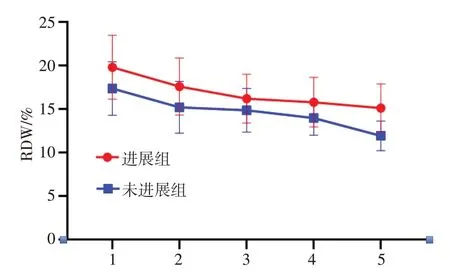
图1 两组患者治疗期间RDW 水平
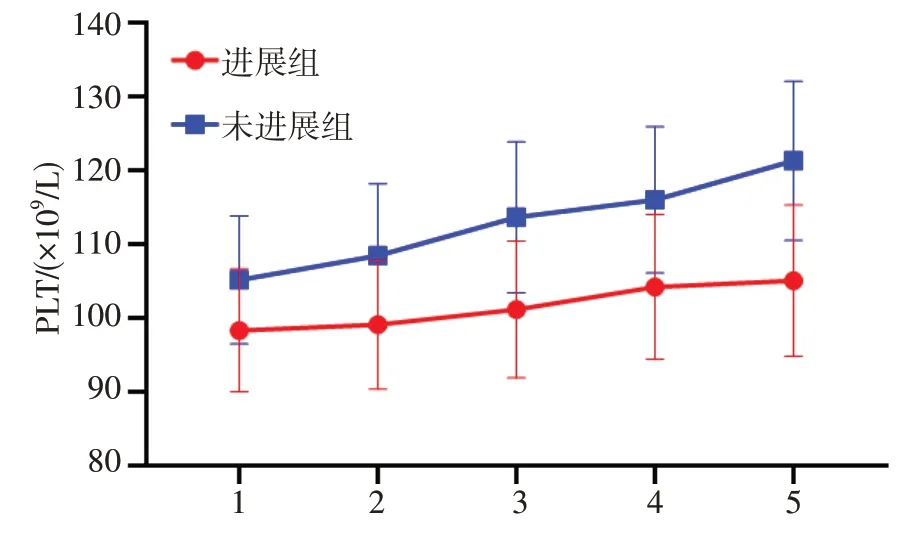
图2 两组患者治疗期间PLT 水平
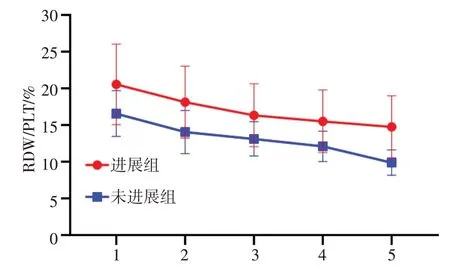
图3 两组患者治疗期间RDW/PLT 比值
表2 抗病毒治疗期间RDW/PLT 水平()
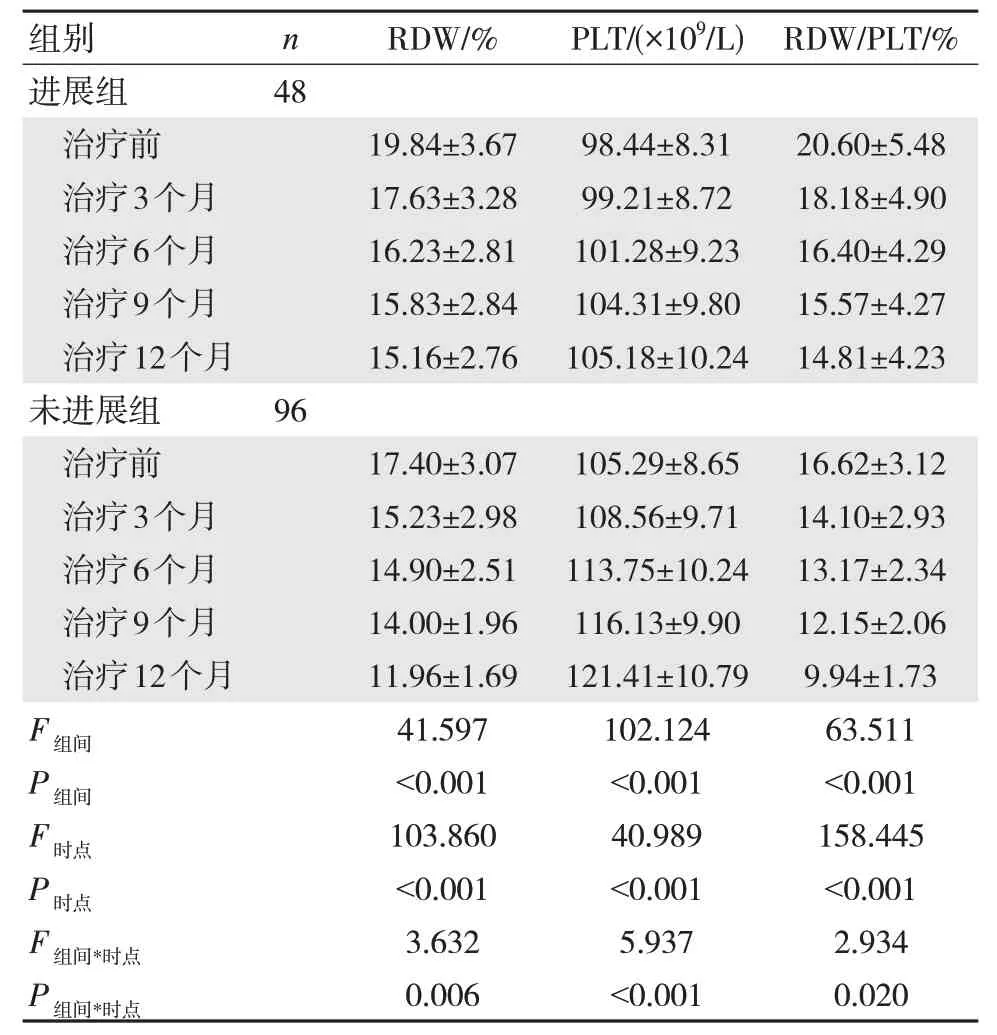
表2 抗病毒治疗期间RDW/PLT 水平()
2.3 治疗前RDW、PLT 及RDW/PLT 比值对HBC 失代偿期患者进展为肝癌的影响
将HBC 失代偿期患者肝癌进展情况作为因变量(1=进展,0=未进展),将治疗前RDW、PLT及RDW/PLT 比值作为自变量(连续变量),经Logistic 回归分析结果显示,高水平RDW、RDW/PLT 比值是HBC 失代偿期患者进展为肝癌的危险因素(>1,P<0.05),高水平PLT 是其保护因素(<1,P<0.05)。见表3。
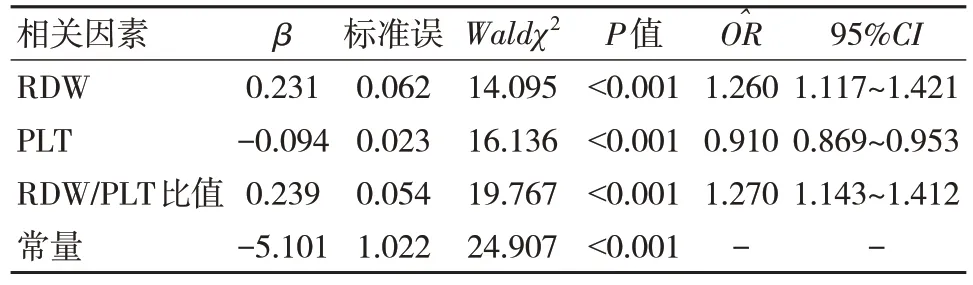
表3 RDW/PLT 比值变化对HBC 失代偿期患者进展为肝癌的影响
2.4 治疗前RDW、PLT 及RDW/PLT 比值对HBC 失代偿期患者进展为肝癌的预测价值
将治疗前RDW、PLT 及RDW/PLT 比值作为检验变量,将肝癌进展情况作为状态变量(1=进展,0=未进展),绘制ROC 曲线(见图4),结果显示,治疗前RDW、PLT、RDW/PLT 比值预测HBC 失代偿期患者进展为肝癌的AUC>0.70,具有一定预测价值。见表4。

图4 治疗前RDW、PLT 及RDW/PLT 比值预测HBC失代偿期患者进展为肝癌的ROC 曲线
3 讨论
肝癌是HBC 失代偿期晚期并发症之一,具有较强异质性,恶性程度高,虽然目前射频消融、肝移植等方案已广泛用于肝癌的治疗中,也取得了一定的成效[10-11]。但早期发病隐匿,无典型症状,多数患者确诊时已进展至晚期,尤其是乙肝病毒阳性的肝癌患者一般预后更差[12]。因此寻找能早期预测HBC 失代偿期患者肝癌发生风险的指标,与传统分子标志物形成互补,具有重要的现实意义。
本研究结果显示,进展组患者治疗后各时点RDW 水平高于未进展组,说明RDW 水平变化与HBC 失代偿期患者肝癌发生风险有关。红细胞主要作用是将肺组织中携氧血红蛋白传输至全身各组织、器官中,是血红蛋白保护屏障,在血液缓冲系统中发挥重要作用。正常情况下红细胞为凹槽圆盘状,在穿透毛细血管时会因挤压变形,其变形能力可以保护自身不会破裂[13]。肝脏虽然不是主要造血器官,但参与红细胞生成,且RDW 可作为肝硬化患者住院时间与生存率的预测指标[14]。HBC 失代偿期患者通常伴有门静脉高压,胃肠道黏膜水肿、充血,会影响机体对叶酸、铁等元素的吸收能力,进而出现血红蛋白体积异常,导致RDW 水平升高[15]。此外,HBC 失代偿期患者多合并脾脏体积增大、脾功能亢进,会抑制骨髓中幼稚红细胞增生、分化,导致红细胞体积改变、发育异常,未成熟红细胞会导致RDW 水平升高[16]。因此RDW 能客观反映HBC 失代偿期患者治疗期间肝脏功能,治疗期间RDW 水平降低越明显,说明患者肝脏功能有所改善,疾病得到有效控制,肝癌发病风险较低。
本研究结果显示,进展组患者治疗后各时点PLT 水平低于未进展组,说明PLT 水平变化与HBC 失代偿期患者肝癌发生风险有关。血小板是骨髓中巨核细胞裂解而成,具有促进血管内皮细胞生长、促进凝血、修复组织损伤等多种功能,是维持机体生理功能重要细胞成分。肝脏是合成血小板生成素是重要器官,正常情况下,肝脏会持续分泌血小板生成素,调节血小板合成,维持机体正常生理功能[17]。HBC 失代偿期患者由于肝功能损伤会导致血小板生成素减少,PLT 降低,加上脾功能亢进,会影响血小板抗体介导的反应,导致脾脏内血小板受单核巨噬细胞系统破坏而减少[18]。另外,乙肝病毒也会抑制骨髓细胞中巨核细胞系统作用,影响血小板生成,并且能通过影响机体免疫状态,通过血小板抗体介导免疫反应,导致血小板损伤,导致PLT 水平降低[19]。国外一项研究发现,病毒性肝炎患者PLT 水平显著降低,且预测肝硬化的敏感度、特异度较高[20]。本研究结果与其一致。因此随着抗病毒治疗疗程增加,机体内乙肝病毒复制得到控制,肝脏功能有所改善,PLT 水平升高幅度越大,说明治疗效果越好,HBC 进展为肝癌风险越低。
RDW/PLT 比值能从2 个方面评价治疗期间患者肝脏功能与疾病进展情况。本研究结果显示,治疗前高水平RDW/PLT 比值是HBC 失代偿期患者进展为肝癌的危险因素,且治疗前RDW/PLT 比值预测HBC 失代偿期患者进展为肝癌的AUC>0.70,具有一定预测价值,尤其当RDW/PLT比值>19.667%时,HBC 失代偿期进展为肝癌风险显著升高。本研究未比较HBC 失代偿期患者与健康人群、代偿期HBC 患者RDW/PLT 水平,由于HBC 病程中可能会出现肾功能损害、糖代谢异常等,不能完全排除以上因素对RDW/PLT 比值的影响,受限于样本量较小,仍需大样本量研究验证。
综上所述,RDW/PLT 比值在HBC 失代偿期患者治疗过程中逐渐降低,治疗前RDW/PLT 比值可能会影响疾病进展程度,并可作为预测肝癌的有效指标。

