基于生物信息学分析MicroRNA-199靶基因的预测及在肺发育中的作用
喻玢 黄栋
(1.贵州医科大学,贵州 贵阳 550004;2.贵州省人民医院,贵州 贵阳 550001)
目前利用干细胞移植来促使组织修复的治疗手段已成为前沿科学,羊水干细胞因其取材来源为分娩废弃物,伦理束缚较小,来源广泛,取材较为容易,故在前临床研究中越来越受到重视,羊水是胎儿生长的保护液,在胚胎发生期间提供机械支持和必要的营养。它主要由水、细胞和化学元素构成[1],人羊水干细胞(human amniotic fluid stem cells,hAFS)做为羊水中的提取物已被广泛研究。hAFS已被证明在体外和体内具有广泛的多能性[2],有助于激活内源性修复反应,同时还具有免疫调节功能等。目前已有研究表明人羊水干细胞(hAFS,human amniotic fluid stem cells)成梭形细胞形态[3],其细胞表达间充质干细胞(Mesenchymal stem cells,MSCs)的表面标志物如CD90,CD105,而不表达造血干细胞的表面标志物CD34、CD45及人类白细胞抗原基因HLA-dr[4],以上细胞学特点均提示人羊水干细胞为间充质干细胞。间充质干细胞的组织修复作用主要依赖于营养因子、抗炎蛋白和外泌体的旁分泌途径[5],外泌体含有多种细胞因子、生长因子、代谢产物以及间充质干细胞自身产生的microRNA(miRNAs),当外泌体与相应靶细胞膜融合后,外泌体内容物释放,以microRNA(miRNAs)对受体细胞进行信号调节。目前已有学者证明hAFS对各类肺发育不良模型中促进了胎儿肺再生[6],实验中证明在支气管肺发育不良模型中,气管内给予AFS后可促进肺泡发育,减弱了血管重塑和肺动脉高压,降低了肺促炎细胞因子表达,减少了巨噬细胞浸润。最新研究显示,microRNAs(miRNAs)在多种生物过程中扮演了重要角色,如细胞的增殖、凋亡、分化等[7],可以通过直接降解靶基因或者抑制其翻译来沉默靶基因,参与大多数细胞机制的调节功能,目前miRNAs在细胞分化和器官再生中的功能逐渐凸显,已经有多个miRNA被证明在肺发育中发挥了重要作用。发掘并研究新的miRNAs在肺发育中的作用对开拓治疗肺疾患、促进肺组织再生及修复有着重要意义。
1 资料与方法
1.1差异性miRNA分析 在对hAFS的研究,通过对围产期hAFS(perinatal human amniotic fluid stem cells,p-hAFS)和胎儿期hAFS(fetal human amniotic fluid stem cells,f-hAFS)miRNAs的差异性比较研究(常规妊娠Ⅱ期获得的羊水干细胞为胚胎期,从妊娠Ⅲ期分离出来的羊水干细胞为围产期),通过对p-hAFS和f-hAFS的差异miRNA进行生物信息学分析从数据集GSE168152获取p-hAFS(GSM5129985,GSM5129987,GSM5129991,GSM5129994,GSM5129983)和f-hAFS(GSM5129977,GSM5129979,GSM5129981,GSM5129989)的miRNA测序数据,使用DESeq包比较了5个p-hAFS样本和4个f-hAFS样本之间的差异miRNA(筛选条件为:P<0.05,logFC>1)。
1.2靶基因预测及功能富集分析 通过主流的miRNA-mRNA互作数据库对3个目标miRNA(hsa-miR-199b-5p,hsa-miR-199b-3p,hsa-miR-199a-3p)进行预测分析,这里我们主要选取了miRDB,miRWalk,Starbase进行预测分析;理想状况下我们取3个数据集的交集作为miRNA的靶基因。但经过这样的处理后hsa-miR-199b-5p 在KEGG富集中只能找到2条通路是显著的。因此我们对取交集的数据集进行了变更,经过观察发现,miRDB数据库预测得到的靶基因数目最少,因为我们决定只取miRWalk和Starbase数据库预测的结果。通过上述方式在miRWalk和 Starbase数据库中共预测得到291个hsa-miR-199a-3p的交集靶基因;同时预测得到363个hsa-miR-199b-5p的交集靶基因。为了说明差异表达基因参与的生物学功能和信号通路,利用R/Bioconductor package clusterProfiler、org.Mm.eg.db、enrichplot、ggplot2包对差异表达基因进行GO和KEGG富集分析。
2 结 果
2.1筛选差异表达的miRNA 通过对p-hAFS和f-hAFS的差异miRNA进行生物信息学分析出p-hAFS及f-hAFS中差异表达的16个基因,同时注意到在p-hAFS中高表达的6个miRNA即miRNAhsa-miR-3919,hsa-miR-199a-3p,hsa-miR-199b-3p,hsa-miR-199b-5p,hsa-miR-875-3p,hsa-miR-424-5p中有3个基因来自同一族系,即hsa-miR-199a-3p,hsa-miR-199b-3p,hsa-miR-199b-5p。使用heatmap绘制热图(图1)来展示差异表达情况。基于热图可以看到,在p-hAFS中hsa-miR-199a-3p,hsa-miR-199b-3p,hsa-miR-199b-5p均为hsa-miR-199族系miRNA,且在p-hAFS中的表达显著,在一篇胎儿和围产期人羊水干细胞的分泌组配方的全面概况[8]中亦检测到p-hAFS中的hsa-miR-199b-3p的序列。差异表达的micRNA可能在28周后胎肺加速发育中发挥重要作用,继而为肺发育的相关研究提供新的思路。在目前对miR-199基因的前临床研究中可以了解到miR-199可通过靶向SP1的表达负性调控成纤维细胞增殖和纤维化[9],miR-199a/b-3p通过下调PAK4/MEK/ERK通路可抑制胃癌细胞MGC-803的增殖[10],miR-199a-3p可抑制mTOR的表达引起细胞自噬从而促进细胞凋亡降低细胞增殖[11],但与肺发育的相关性尚不明确。通过生物信息学分析对其靶基因及靶基因功能进行富集分析,为深入研究hsa-miR-199a-3p,hsa-miR-199b-3p,hsa-miR-199b-5p在肺发育中的生物功能及调控机制提供理论指导。
2.2靶基因预测及miRNA靶基因功能富集分析 我们分别使用miRDB,miRWalk,Starbase等3个数据库进行对hsa-miR-199b-5p,hsa-miR-199b-3p,hsa-miR-199a-3p预测可能结合的靶基因。研究结果显示hsa-miR-199a-3p和hsa-miR-199b-3p在数据库中预测的结果一致,于是我们选取hsa-miR-199a-3p的预测靶基因结果。每个miRNA的靶基因取交集处理,在数据库中共预测得到291个交集靶基因。hsa-miR-199b-5p的miRDB数据库预测得到的靶基因数目较少,因此只选取miRWalk和Starbase数据库预测的结果,共预测到363个交集靶基因。基于上述结果,我们对靶基因进行功能富集分析,利用R包clusterprofile进行通路富集分析。在hsa-miR-199a-3p相关靶基因的KEGG富集分析中,我们共鉴定出37条富集通路,在GO中共鉴定出505通路被显著富集,其中包括371条BP,56条CC,78条MF。在KEGG富集结果中,显示前30个KEGG通路(图2)。对GO通路进行富集分析,如图为最显著差异的前30个GO通路(图3)。在hsa-miR-199b-5p相关靶基因的KEGG富集分析中,我们共鉴定出21条通路被显著富集,在GO中共鉴定出370通路被显著富集,其中包括268条BP,40条CC,62条MF。在KEGG富集结果中,我们展示了21条显著的KEGG通路。(图4)。hsa-miR-199b-5p相关靶基因的GO通路展示差异最显著的前30个富集分析结果(图5)。

注:富集得到最显著的前30个KEGG条目,横轴表示 KEGG通路的基因数目,纵轴表示KEGG通路的名称,颜色表示 Pvalue。

注:富集得到最显著的前30个GO条目,横轴表示 GO条目的基因数目,纵轴表示GO条目的名称,颜色表示 Pvalue。

注:富集得到最显著的前21个KEGG条目,横轴表示 KEGG通路的基因数目,纵轴表示KEGG通路的名称,颜色表示 Pvalue。
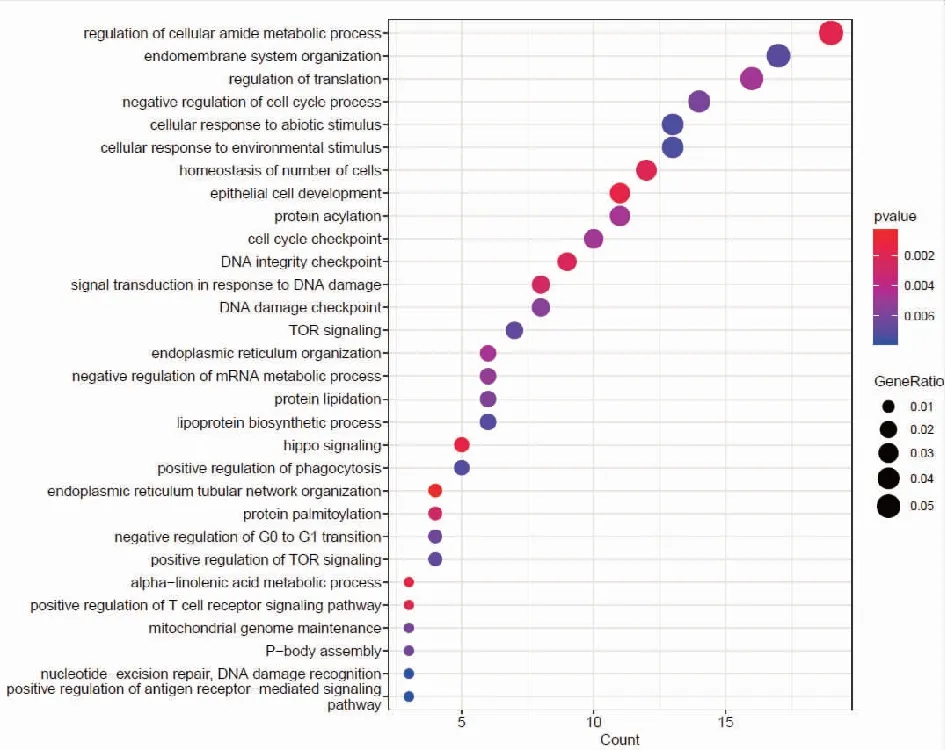
注:富集得到最显著的前30个GO条目,横轴表示 GO条目的基因数目,纵轴表示GO条目的名称,颜色表示 Pvalue。
3 讨 论
肺发育是一个复杂的过程,受信号分子网络的调控。特别是一些miRNAs,miRNA作为一类基因转录后调控其表达水平的非编码RNA,可以通过直接促进mRNA的降解或干扰mRNA翻译来沉默靶基因,发挥其生物学作用[12],在肺发育过程中miRNA可能通过控制分支形态发生和上皮和间质分化[13],纠正信号分子失调的网络来促进肺发育。目前研究发现hAFS能够释放出包含microRNA的囊泡,能够抑制炎症,提供心肌保护,减轻心肌毒性,刺激血管生成等作用[14-16]。使用miRDB,miRWalk,Starbas数据库对hsa-miR-199b-5p、hsa-miR-199b-3p、hsa-miR-199a-3p进行靶基因预测,因hsa-miR-199a-3p与hsa-miR-199b-3p预测的靶基因一致,故合并讨论。
细胞自噬是一种进化上的保守过程,细胞内物质被双膜自噬体隔离,然后在各种生理病理条件下被溶酶体降解和回收。自噬作用本身不能促进肺组织的发育,但当肺损伤发生时,自噬可以减轻肺纤维化的形成,W.Zheng等[17]实验发现自噬与损伤后的纤维变性呈负相关。实验结果提示hsa-miR-199a-3p及hsa-miR-199b-5p均富集到AMPK信号通路,且相关性较高,AMPK激活细胞自噬作用上调可诱导细胞死亡或启动调亡程序促进肺损伤病理进展。除此以外hsa-miR-199a-3p还富集到两条与自噬相关的信号通路,PI3K信号通路及RAS信号通路。PI3K通路可通过激活成熟的PI3K-AKT-mTOR (雷帕霉素的机械靶点)复合物1(MTORC1)通路抑制自噬[18],且Ⅰ类PI3K的PIK3CB催化亚基可作为自噬的正向调节因子。RAS信号通路可直接激活自噬[19]。hsa-miR-199a-3p及hsa-miR-199b-5p很可能通过细胞自噬在肺组织损伤发生时产生积极作用。
除AMPK信号通路外,在hsa-miR-199a-3p及hsa-miR-199b-5p上同时富集到的还有T细胞受体调节信号通路。而T细胞受体调节信号主要与细胞内的炎症反应调节相关,与自噬相同,炎症反应的调节本身不具有促进肺组织发育的功能,但对肺损伤尤其是支气管肺发育不良等疾病具有重要影响[19]。hsa-miR-199a-3p的富集结果中ErbB信号通路[20]及hsa-miR-199b-5p富集到的IL-7信号通路同样具有炎症调节的作用。炎症调节作用可在肺组织出现感染等损伤时,下调其炎性物质的表达从而减轻肺组织的损伤。
血管的发育在胎肺发展的过程中有着重要作用,而血管重塑在发生肺损伤时也是重要的病理过程。在hsa-miR-199a-3p的GO富集分析中,与hsa-miR-199a-3p最显著差异的前30个GO通路中共有两个与血管调节相关的通路,血管发育的正向调节、血管生成的正性调节),而此机制可能是hsa-miR-199a-3p影响肺发育的机制之一。
在现有的前临床实验中,已验证P53可通过调节miR-199a-3p来影响体细胞编程。而在我们对hsa-miR-199a-3p的富集结果中,我们富集到miR-199a-3p在动物器官再生、mRNA加工的调控、体内平衡等与组织发育、细胞编程相关的通路,而mRNA加工调控与树突棘发育通路间有共同基因参与。Hsa-miR-199a-3p与细胞的发育有着密切关系。而在hsa-miR-199b-5p的GO富集分析中,细胞酰胺代谢过程的调节、转化的调节、mRNA代谢过程的负调控、细胞对环境刺激的反应、细胞数量的稳态、蛋白质酰化、细胞周期检查点等生物活性通路;其富集到的可参与细胞编程的通路数量更多,且在这些通路中有多个基因重复出现,目前已有研究[21]表明miR-199b可抑制VEGF、JAG1、SET蛋白的表达,为其靶基因,可促进细胞的增殖,延长细胞周期,并抑制细胞凋亡,而靶基因的富集结果与之相符,由此推测hsa-miR-199b-5p可能直接参与到了细胞对环境的应激甚至mRNA的表达调节中,对于细胞活性及细胞反应有直接作用,上述通路可能对肺发育的进程产生作用。
综上所述,hsa-miR-199b-5p、hsa-miR-199b-3P、hsa-miR-199a-3p是围产期羊水干细胞中对肺发育起作用的因子,对肺发育的调控可能是多维度的。hsa-miR-199a-3p及hsa-miR-199b-5p的靶基因具有丰富的生物功能,对靶基因富集到的信号通路进行进一步分析得出以下结论:①hsa-miR-199a-3p及hsa-miR-199b-5p可能通过AMPK信号通路、动物自噬、P13k-Akt信号通路等通路上调细胞的自噬作用;②通过血管发育的正向调节、血管生成的正向调节促进肺发育中肺血管的生成或减轻肺损伤中肺血管重塑;③T细胞受体信号通路、ErbB信号通路及hIL-7信号通路通过对炎性介质的调节在肺损伤的过程中起到积极作用;④hsa-miR-199b-5p、hsa-miR-199b-3p、hsa-miR-199a-3p还具有mRNA加工的调控、DNA损伤检查点、DNA损伤的信号转导反应等具有调控作用,对肺发育可能是有益的。

