土壤呼吸及其13C同位素测定方法的对比研究①
聂棠棠王 娟姚槐应葛超荣*
土壤呼吸及其13C同位素测定方法的对比研究①
聂棠棠1,2,王 娟2,姚槐应1,2,葛超荣1*
(1 武汉工程大学环境生态与生物工程学院环境生态与工程研究中心,武汉 430073;2 中国科学院城市环境研究所城市环境与健康重点实验室,福建厦门 361021)
为比较不同方法在土壤呼吸及其13C同位素测定中的差异,应用气相色谱仪法(GC-TCD)、稳定同位素比值质谱仪气体进样法(Gasbench-IRMS)、甲酚红显色法(MicroResp)、碱液吸收法4种方法测定土壤呼吸速率,并采用Gasbench-IRMS法和碱液吸收法两种方式检测土壤呼吸的13C同位素丰度,以期准确评估土壤呼吸及碳排放,并为相关研究提供参考。结果表明:①两种仪器法(GC、IRMS)测定土壤呼吸速率的数值结果相近(基础呼吸)或趋势一致(诱导呼吸),且重复性好(标准偏差分别为0.011、0.010 mg/(kg·h)),准确度高;MicroResp法的测定结果与仪器测量值较为相近,但分辨率较低;碱液吸收法的测定结果较真实值偏高(当土壤有机质含量低时)或偏低(当土壤有机质含量高时)。②在测定CO2中的13C含量上,Gasbench-IRMS法直接测定的结果误差小(δ13C值的标准偏差为0.137‰),接近实际值,可以准确地反映出土壤微生物呼吸对底物的利用状况。综上,仪器法较化学分析法(MicroResp、碱液吸收)更能准确测定土壤呼吸及其13C同位素。
土壤呼吸测定;13C同位素丰度;方法比较
与工业革命前相比,大气中CO2浓度增幅已经超过了31%[1]。作为对全球气候变暖贡献最大的温室气体,自1850年以来,CO2浓度变化已经使全球气温上升了0.9 ~ 1.2 ℃,并且现在正以每10年0.2 ℃ 的速率继续增加[2]。由温室气体引起的全球气候变暖已经成为现今人类面临的主要环境问题之一。土壤作为陆地生态系统中最重要的碳储存库之一,其贮存量为1 300 ~ 2 000 Pg C,是大气碳库的2倍、植物碳库的3倍[3]。因此,由环境变化引起的土壤碳库的任何细微改变都有可能对生态系统碳平衡产生显著的影响。作为土壤碳库向大气输出碳的主要途径,土壤呼吸是继总初级生产力之后的陆地生态系统和大气之间的第二大碳通量[4],其在调节大气中CO2浓度、介导陆地–大气碳循环中具有一定的重要性。近些年来,土壤向大气释放CO2的速率正在增加,土壤碳汇功能开始逐渐削弱[5]。土壤呼吸能否准确测定,可能关系到土壤碳库在技术层面上起着碳源还是碳汇的角色,从而对计算大气CO2收支产生深远的影响。有关土壤呼吸的研究出现在20世纪之前,但是当时的研究文献数量很少,且并未系统化。此后,由于意识到土壤特性会影响农作物的产量,土壤呼吸才成为了评估农业土地生产力、量化土壤管理对土壤有机质矿化率影响的指标,研究人员也开始研究影响土壤呼吸的因素[6]。随着实验技术的发展,测定土壤呼吸的方法越来越多,然而,目前的测定方法到底适用性如何?还缺乏相关报道。
作为能够反映微生物生长和土壤有机质(SOM)动态含量的常见指标,土壤呼吸起着十分重要的作用。有作者通过基质诱导呼吸方法测量土壤CO2释放量来评估土壤微生物生物量的大小[7],也有研究通过测定土壤呼吸来估计微生物的碳维持需求[8]。土壤CO2排放速率的大小还可以作为判断土壤肥沃与否的条件之一[9]。因此,考虑到其作为土壤学科研究中最基础的指标之一,准确测定土壤呼吸量显得尤为重要。然而,由于生态系统的复杂性和多样性,众多土壤呼吸的测定方法各具优点与局限性。故本文就气相色谱仪法(GC-TCD)、稳定同位素比值质谱仪气体直接进样法(Gasbench-IRMS)、甲酚红显色法(MicroResp)、碱液吸收法等几种较为常见的测定土壤呼吸速率的方法进行了试验探究和总结,同时比较了两种测定土壤呼吸中δ13C值的方法,从而为大气CO2浓度升高环境下准确测定土壤呼吸速率及其13C同位素给予数据支持,并以期在今后的研究工作中,给科研人员评估与选择土壤呼吸测定方法提供参考。
1 材料与方法
1.1 供试土壤
本试验通过在全国范围内选取不同有机质含量水平(10 ~ 62 g/kg)的土壤,用于基础土壤呼吸速率测定试验。研究样本为原采自广东湛江、云南红河、云南普洱、四川达州、江西宜春、江苏宿迁、福建三明、湖南湘潭、福建龙岩、浙江嘉兴、黑龙江哈尔滨等共11个地区的水稻土壤,并依次记为S1、S2、S3、S4、S5、S6、S7、S8、S9、S10、S11。各土壤样本的基本理化性质和地理信息见表1。
1.2 试验方法
本试验用以测定土壤基础呼吸速率的方法主要为GC-TCD法、Gasbench-IRMS法、MicroResp法以及碱液吸收法4种测定方式。
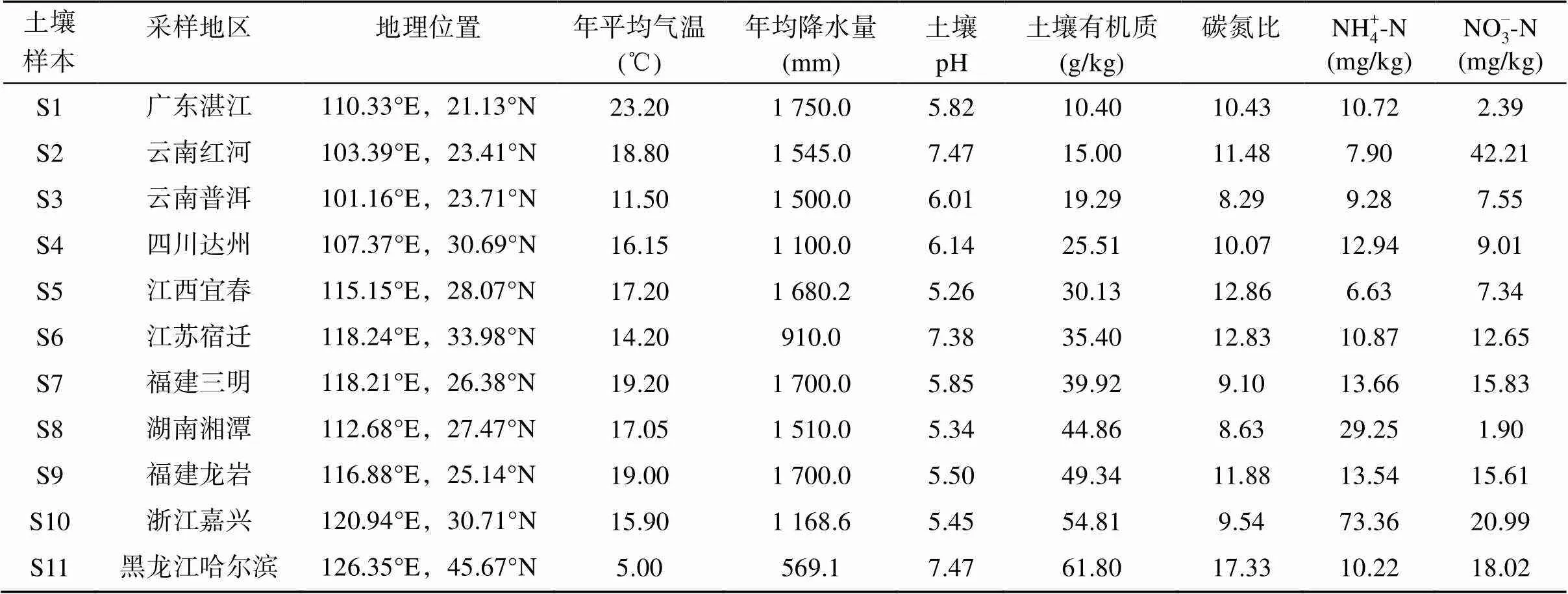
表1 供试土壤样本的基本理化性质和地理信息
1.2.1 气相色谱仪法(GC-TCD) 取相当于15 g干重的土壤样品(调节含水量至田间持水量的60%,并预培养7 d)于120 mL棕色血清瓶中,加盖橡胶塞和铝盖后在密闭黑暗环境下培养,24 h后以温室气相色谱仪(Agilent Technologies GC7890A,USA)检测土壤呼吸的CO2释放量。土壤呼吸速率(C,mg/(kg·h))通过公式计算:
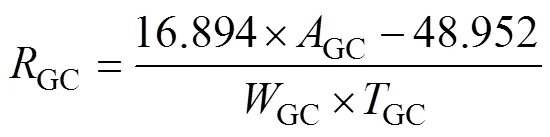
式中:分子为该方法下测定所得的标线方程,用以计算瓶内顶空CO2的含量(mg)。同理,后面涉及的所有公式,其分子部分均为相应方法下的标线方程。因此,即为每个方法中涉及的仪器所测定的CO2之峰面积,则代表各方法中用到的土壤重量(kg),即是土壤呼吸的培养时间与仪器取样测定过程中耗费的时间之和(h)。
1.2.2 稳定同位素比值质谱仪气体进样法(Gasbench-IRMS) 测定过程与GC-TCD类似:称取1.5 g土壤置于12 mL Labco采气管,黑暗密闭环境下培养24 h后上气体同位素质谱仪(ThermoFisher Scientific Delta V Advantage,Germany)测定。其土壤呼吸速率通过下列公式计算:
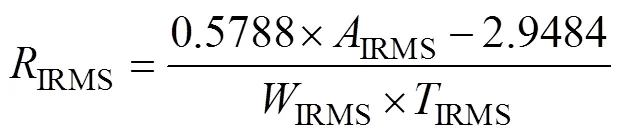
式中:各字母释义可见公式 (1)。
1.2.3 甲酚红显色法(MicroResp) 该方法的实验原理主要是以酸碱指示剂甲酚红的显色程度来判定CO2浓度。通过添加甲酚红显示剂于检测板孔内(每个样品3个重复),再分别将每块检测板(3个检测孔)放入到装有15 g土壤的棕色血清瓶中,经由24 h内土壤呼吸释放的CO2所“浸染”,最后通过多功能酶标仪(Tecan Infinite M200 Pro,Austria)来检测捕获CO2后的甲酚红指示剂的吸光度。该方法测定的土壤呼吸速率计算公式如下:
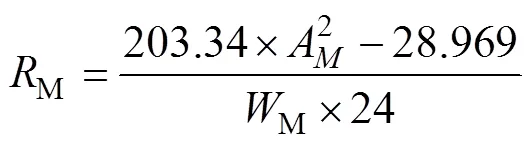
式中:M为酶标仪所测定的检测孔的吸光度。
1.2.4 碱液吸收法 用碱液(NaOH或者KOH溶液)吸收CO2生成盐,再用滴定法中和剩余的碱量,最后使用差减法计算出一定时间内土壤排放的CO2量的测定方法[10]。本试验为方便检测,对经典的碱液吸收法稍作改变,主要是利用稳定同位素比值质谱仪测定碱液吸收的CO2含量,具体细节可见图1。将盛有15 mL 0.1 mol/L NaOH溶液的西林瓶放置于事先称好15 g土壤的带密封垫的100 mL蓝盖瓶里,加塞加盖培养24 h后取出吸收了CO2的碱液,转移至15 mL离心管密封保存。测量时取0.5 mL于Labco管,氦气冲洗顶空后再加入0.5 mL 1 mol/L H3PO4溶液,以释放出吸收的CO2。最后经由Gasbench-IRMS检测碳总量,并通过下列公式计算出该方法下的土壤呼吸速率:
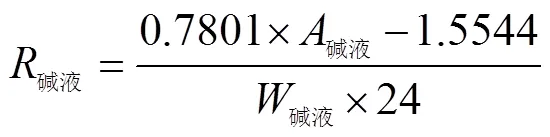
1.2.5 土壤呼吸的13CO2含量测定 关于土壤呼吸中低/高13C含量测定方式的比较,鉴于在野外试验中,碱液吸收法经常被用于农田、森林等生态系统的土壤呼吸原位动态监测[11-12],本试验就此对比Gasbench-IRMS直接测定和碱液吸收间接测定这两种方法。间接法也必须经由稳定同位素质谱仪来分析测定,本对比试验旨在探究碱液吸收后对碳同位素是否造成不可忽视的影响,从而为后续研究者在野外试验中以碱液捕获CO2并需检测13C含量时提供数据参考。低13C含量在基础土壤呼吸速率试验中一同测定,高13C含量通过在土壤中加入13C标记物诱导土壤呼吸来实现并测定。本试验采用13C丰度为2% 的葡萄糖溶液作为标记物,选用S1、S4、S5、S6、S8、S11这6个水稻土壤作为研究对象。两种方法的具体操作过程与测定土壤基础呼吸速率试验过程相似,区别在于土壤称样后需加入13C标记的葡萄糖溶液(质量分数为2.5%),添加比例为0.1%。最终,两种方法的碳同位素上机测定都通过IRMS完成。试验中原始土壤以及经诱导呼吸后的土壤的13C含量通过EA-IRMS方法测定。
两个试验分别于2021年8月和10月,在中国科学院宁波城市环境观测研究站进行。每种测定方法中每个土壤3组重复,同一试验的不同处理一同放置于恒温培养箱(设置温度25 ℃)中避光培养24 h后取出各自测定。
1.3 数据处理
所有数据经Excel 2016整理,并计算均值、标准差,采用SPSS19.0软件对部分数据(不同有机质含量下的基础土壤呼吸速率)进行单因素方差分析(ANOVA)和邓肯检验(Duncan’s test,<0.05),通过OriginPro 2018软件作图。
2 结果与分析
2.1 基础土壤呼吸速率的测定
由图2可见,前10个有机质含量(10 ~ 55 g/kg)不同的土壤,其CO2排放通量主要表现为:有机质含量较高的土壤,基础呼吸速率高;有机质含量较低的,基础呼吸速率较低。并且,根据线性回归分析图所示,有机质含量可以解释基础土壤呼吸速率75% 左右的差异性,两者具有显著的正相关性(图3A、3B、3C)。然而,碱液吸收法与前3种测定方法相差较大,其测定所得数据未能呈现出基础土壤呼吸速率随有机质含量升高而增大的梯度趋势(图2、图3D)。
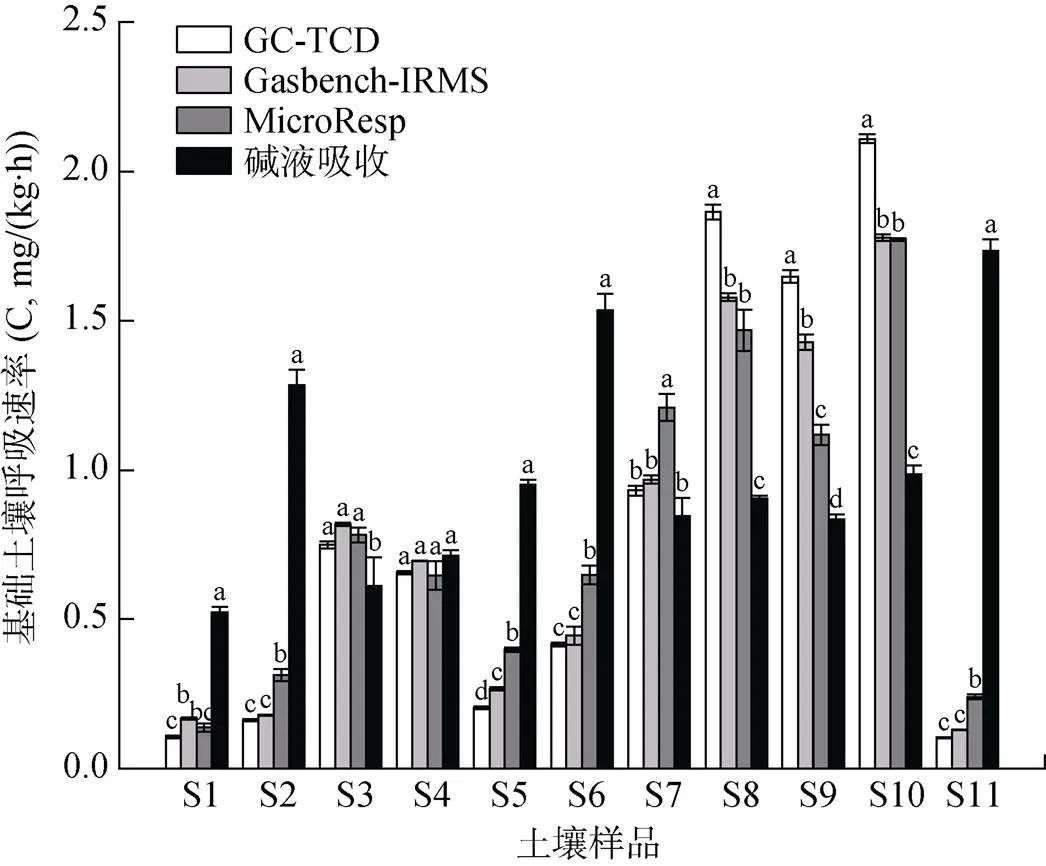
(图中小写字母不同表示同一土壤样品不同测定方法间差异显著(P<0.05))
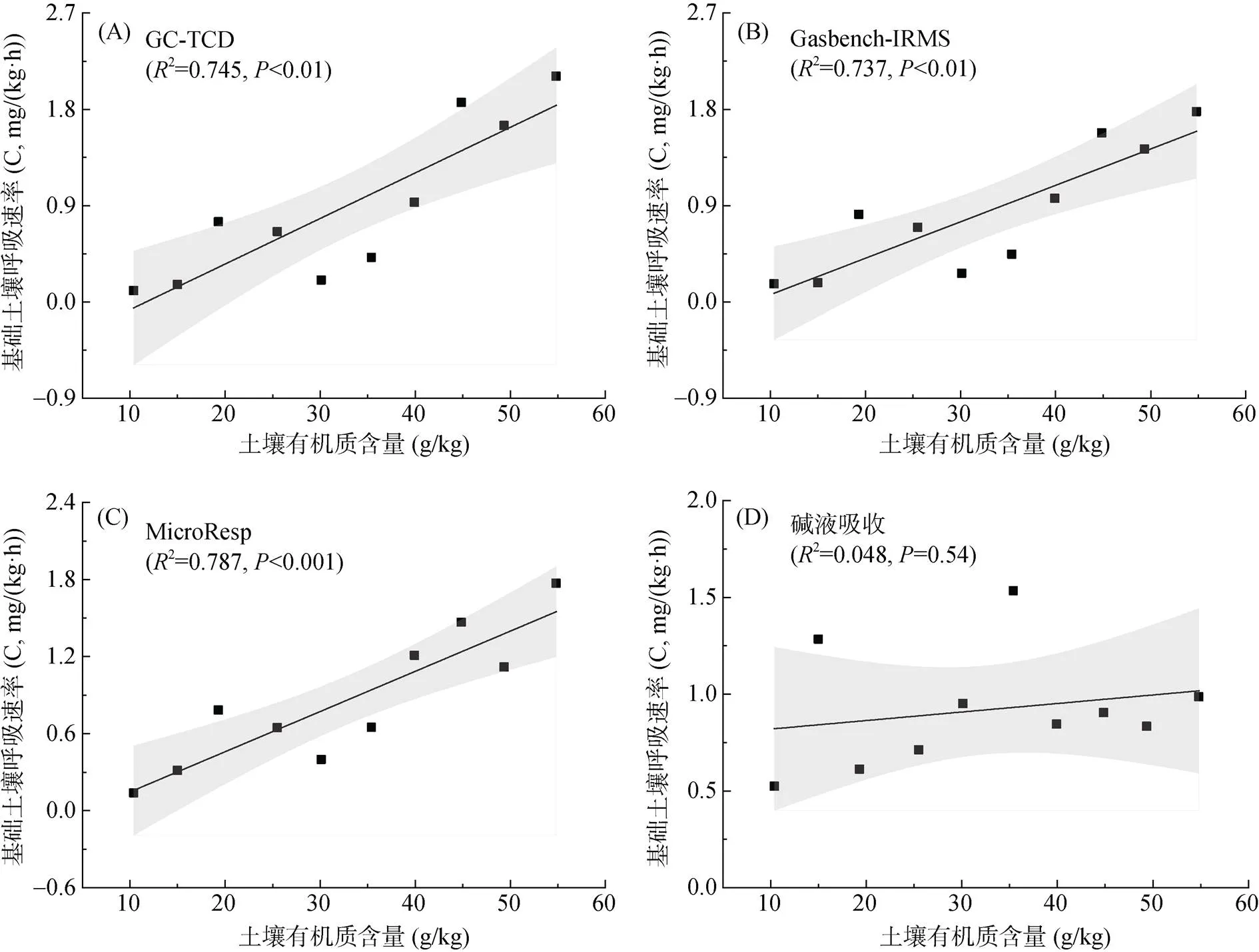
图3 基础土壤呼吸速率与土壤有机质含量的关系
在4种基础土壤呼吸速率的方法测定中,GC- TCD和Gasbench-IRMS的结果比较相似,重复性均较好,测量标准偏差分别为0.011、0.010 mg/(kg·h)。MicroResp所得结果与仪器测定值接近,但分辨率不如仪器,标准偏差偏大,为0.026 mg/(kg·h)。对于碱液吸收法,有机质含量较低时,测定结果高于真实值,反之则偏低;且测定的平行性不如前3种方法,测量标准偏差达0.035 mg/(kg·h)。
2.2 土壤呼吸中低/高13C含量的测定
土壤呼吸中13C同位素的测定以Gasbench-IRMS法为准(图4A)。测定结果表明,对于基础土壤呼吸,Gasbench-IRMS 法直接测定同位素的平行性好,测定δ13C值(13C丰度)的标准偏差为0.137‰ (碱液吸收法为0.929‰)。而碱液吸收法会受空气中CO2的影响,在存取碱液过程中易被污染,导致δ13C测定值比真值高(测定时空气δ13C值约为–13‰)。
在具体测量过程中,水准测量的测站数据长,前、后视距差和黑、红(基、辅面)面读数各项内容都要符合标准要求,并且不得因为读数问题,导致误差过度,对最终的测量结果造成不良影响,针对测量中涉及到的转点,要采用尺垫完成相应的操作[2]。通常来说,水准点到沉降测点间转点次数都是一次,最多不得超过两次。需要观测人员在实际作业过程中特别注意的是,针对路堤填筑期的观测,应当依据四等水准测量要求完成相应的观测。
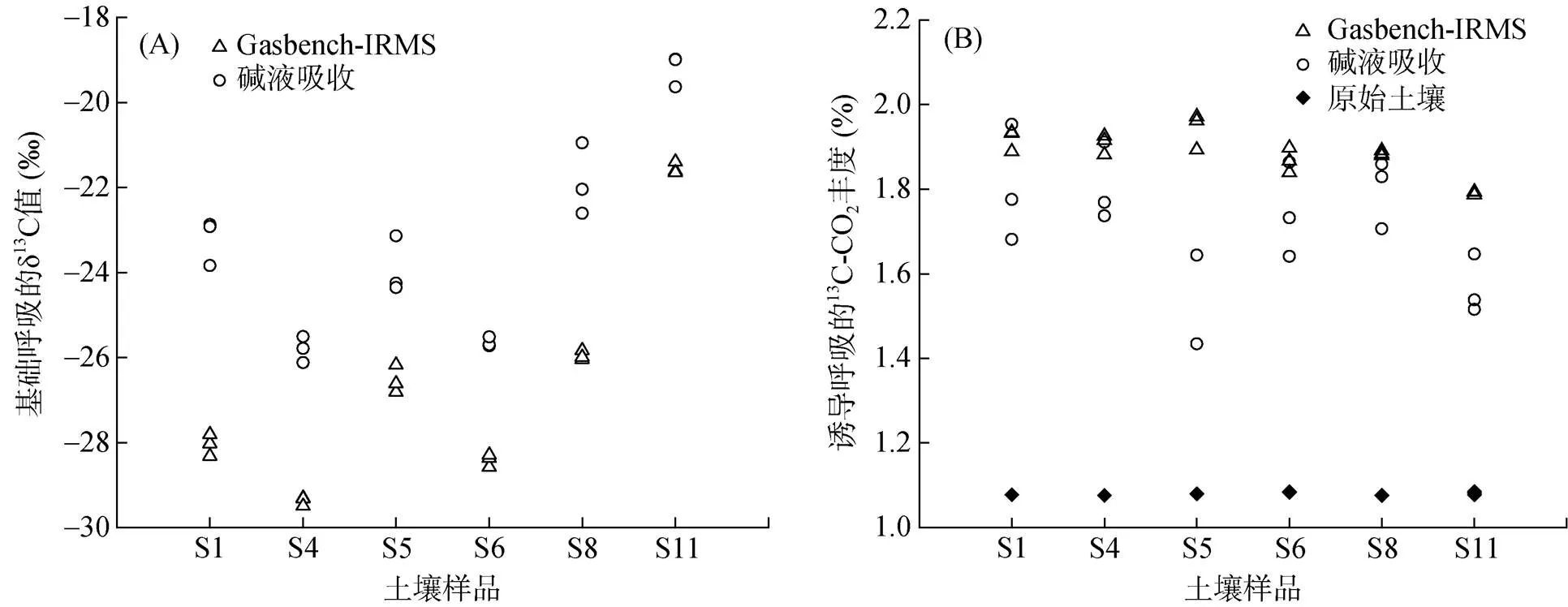
图4 水稻土基础呼吸产生的δ13C 值(A)及诱导呼吸释放的13C-CO2的丰度(B)
对于诱导土壤呼吸,碱液吸收法在13C同位素的测定上,结果偏低,重复性差。由于加入了13C标记物,土壤呼吸的13C丰度大大升高,因此操作过程中一旦接触空气,就会出现不同程度的污染。Gasbench-IRMS法在测定含量较高的13C-CO2时,平行性较基础呼吸有所降低,但依旧较为可信。该法更加真实地反映了土壤微生物对外源加入的标记物的利用状况(图4B),其AT%值(13C丰度)的平均测量值高达1.885%,宜春(S5)的13C含量测定值甚至达到了1.942%,十分接近诱导底物葡萄糖溶液的13C丰度(2%)。此外,除哈尔滨(S11)水稻土的13C含量为1.791% 外,其余地区的土壤,其被诱导呼吸产生的13C含量均在1.850% 以上。相比之下,碱液吸收法测定结果不甚理想。达州地区(S4)土壤呼吸释放的CO2中13C含量最高,但也仅为1.805%,远低于Gasbench-IRMS测定的平均值。6个样本土壤呼吸的AT%平均值为1.710%,即土壤纳入底物13C的程度为85.5%。
为探究整个试验体系中碱液的存在是否有激发土壤微生物呼吸的作用,最终导致土壤呼吸中13C的AT%值不高,我们对诱导土壤呼吸速率也进行了测定,并加入了气相色谱仪的检测以示准确性(图5)。对于Gasbench-IRMS法,无论是基础呼吸速率或是诱导呼吸速率,其测定结果趋势均与气相色谱仪法相一致,甚至基础呼吸速率的数值与GC的几乎吻合。然而,除湘潭(S8)外,碱液吸收法测定的其余5个地区的土壤诱导呼吸速率均高于仪器的测定结果,即表现为有机质含量低的土壤,其测定数值偏高(S11除外),正如图2结果所示。总的来说,图4、5体现了Gasbench-IRMS法在土壤呼吸速率及其13C丰度(基础/诱导)测定中的可靠性;而碱液吸收法可能由于其存在的诱导作用,使得土壤呼吸速率偏高(S1、S4、S5、S6、S11),更高的土壤CO2释放量也可能是导致该方法下测定的13C(诱导呼吸)丰度偏低的原因之一。
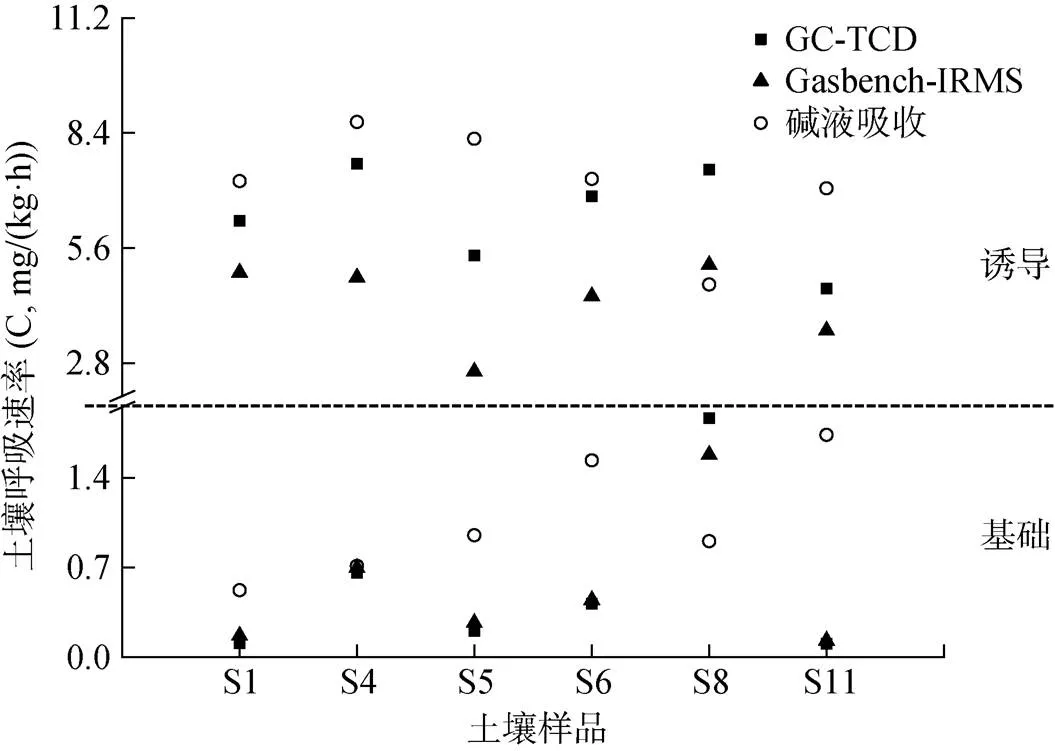
图5 水稻土的土壤呼吸(基础/诱导)速率
3 讨论
3.1 土壤有机质对基础土壤呼吸速率的影响
土壤有机质作为陆地生态系统中最大的碳库,是土壤微生物进行分解活动,从而为自身生长繁殖提供所需碳源等营养物质,并向外界释放CO2的物质基础[13]。有研究表明,约80% 的土壤异养呼吸作用是由于土壤活性有机组分被微生物分解而产生的,剩余20% 为中性有机组分贡献[14]。因此,土微微生物种群及其呼吸强度会受到土壤中易分解有机质的影响,当土壤活性有机碳输入增加时,微生物可利用碳源充足,基础土壤呼吸速率将随之增加[15-16]。闫靖华等[17]的研究表明,土壤呼吸速率与土壤有机质含量呈正相关,相关系数为0.82。结合本试验结果,基础土壤呼吸速率随土壤有机质含量升高而增大,符合两者之间的正相关关系。另外,在本试验条件下,一定范围内的(10 ~ 55 g/kg)土壤有机质含量与基础土壤呼吸速率的相关系数在0.85左右(图3)。然而,当有机质含量达到一定水平后,本试验情况下有机质含量达61.80 g/kg时,4种方法测得的基础土壤呼吸速率依次为0.104、0.130、0.240、1.734 mg/(kg·h);除碱液吸收法外,其余3种方法的测定结果都表现为土壤CO2释放量急剧降低。这与龚振平等[9]的研究结果一致,即低有机质下随有机质含量升高,土壤CO2排放总量升高,但有机质含量达到一定水平时(59.80 g/kg),基础土壤呼吸速率有降低趋势。
3.2 土壤呼吸速率测定方法的比较
本研究中4种实验室测定土壤呼吸的方法各有优点和局限性,土壤呼吸中13C同位素的测定则以Gasbench-IRMS直接测定为优,若非实际情况或现实条件不允许,间接测定13C-CO2含量时应尽可能避免通过碱液吸收的方式收集CO2气体。本试验结合其他文献研究,给出以下差异比较(表2)。
3.2.1 气相色谱法 有文献表明,测量土壤呼吸的标准方法并不存在。Anderson[18]认为,测量土壤呼吸涉及多种仪器和技术方法,其中几种技术的重复和有效使用形成了一种伪标准化的状态,并在某种程度上以指导方针的形式存在。气相色谱分析仪作为学者们普遍应用的技术仪器,为测定土壤、大气中CO2含量提供了一种简单、灵敏、准确的方法[19]。由于其探测器的灵敏度和速度,允许快速并准确地测量土壤CO2排放[20];与完全计算机化的采样系统相连接的配置又赋予了该仪器易于取样的优势[21]。因此,气相色谱(GC)经常被用来测量实验室条件下土壤的呼吸状态[22]。另外,在一些野外的田间试验中通常也会采用GC来进行实时监测[19,23]。本试验中,GC-TCD在4种实验室土壤呼吸测定方法中测定结果最佳,具有灵敏度和准确度均较高、测定范围宽(0.03%~ 5.0%)、测定时间快(约7 ~ 8 min/样品)等优点(图2和表2)。即便其存在需实验室配备相应仪器及设备的较高成本要求,仍得到了研究学者们的广泛应用,并在一定程度上可作为其他方法测定结果的参考标准。
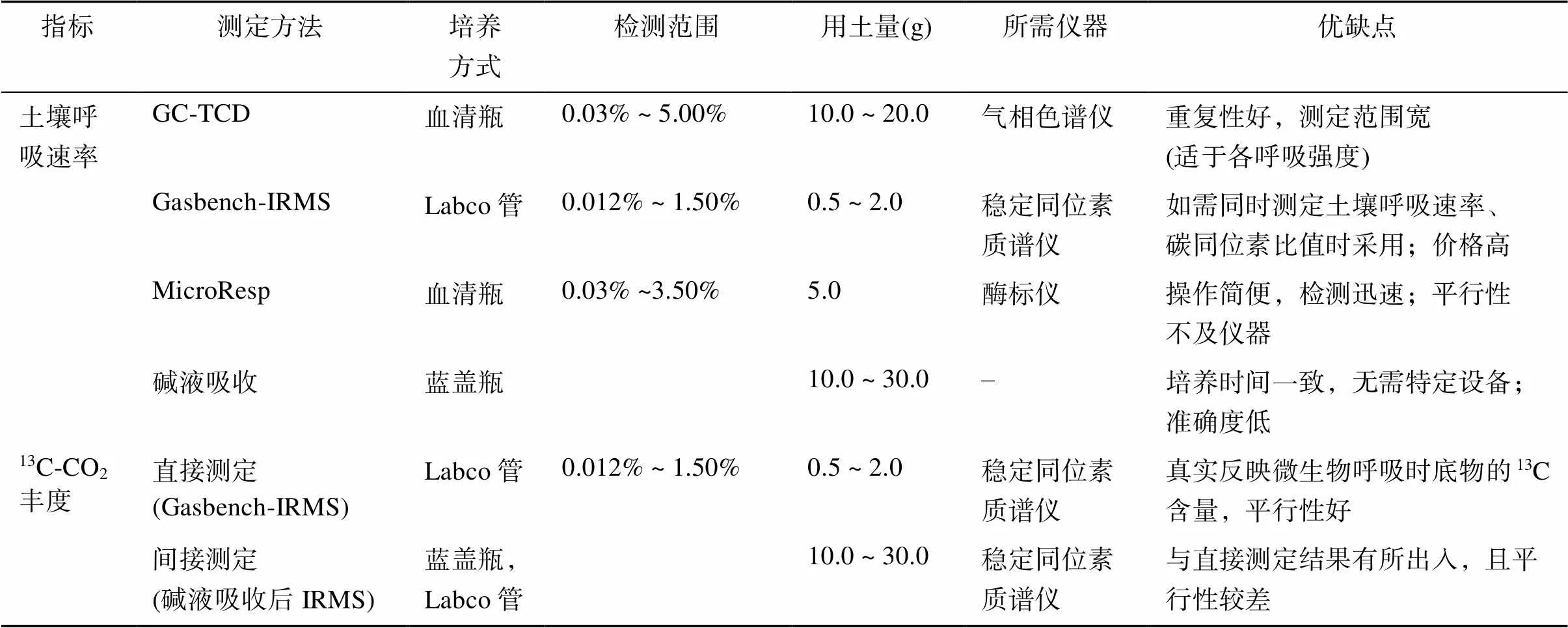
表2 四种测定土壤呼吸速率及两种测定13C-CO2丰度的方法比较
3.2.2 稳定同位素比值质谱仪气体直接进样法 1919年,阿斯顿研制了世界上第一台质谱仪。彼时质谱仪的主要功能是可以测定出不同元素中同位素的相对原子质量,从而肯定了同位素的普遍存在[24]。基于质谱仪建立起来的稳定同位素技术,最初是在20世纪30年代发展于物理学,后来逐步应用到了地质地球化学、植物学、水环境生态学、医学等领域中[25-26]。利用稳定碳同位素技术可以探究农业土壤、还田造林土地(绿化)及天然草地对土壤碳动态的影响,并最终可通过13C计算出绿化土壤中旧碳与新碳的比例[27]。稳定同位素比值质谱仪(IRMS)是同位素技术中测定分析的重要仪器,经常用于对有机碳或无机碳的同位素定量分析[28]。作为可以测定某物质的同位素质量及其在该物质中的相对含量的科学实验仪器,其在土壤有机碳来源、周转周期、土壤 CO2通量的变化和组分区分及同位素富集等研究领域中起着重要的作用[29]。
此外,IRMS还允许通过同位素比值色谱图对释放的CO2量进行量化[30]。其在稳定同位素分析中均是以气体形式进行质谱分析,因此常有气体质谱仪之称[25]。本身为气体的CO2无需经过转化,通过IRMS的气体直接进样系统(Gasbench)便可测定出其土壤CO2释放量及13C含量。在本试验中,利用该仪器能够精确测定土壤呼吸中低/高13C的含量变化(图4),真实地反映出微生物呼吸利用的土壤原有机物质及外源添加有机底物中的稳定碳同位素丰度。另外,在土壤CO2排放量测定方面,Gasbench-IRMS也能较为准确地计算出基础土壤呼吸速率,接近GC-TCD的测定结果(图2)。但由于该仪器设备价格高,在只需测定CO2释放量数据的情况下,不建议使用该方法。
3.2.3 甲酚红显色法 MicroRespTM法,一种通过显色法便能够监测到土壤中的CO2排放过程,从而测定碳源的利用率,并以此获悉土壤微生物群落的生理特征的方法[31]。这提供了一种可以快速衡量微生物生物量丰富程度的途径,即添加一系列碳源以诱导微生物呼吸,微生物群落的多样性越大,碳源利用的范围就越广[32]。Creamer等[33]利用MicroRespTM方法评估了欧洲81个不同理化参数地点的潜在微生物活性。Drage等[34]对这一专门用于研究土壤微生物群落的系统进行了轻微修改,以便于探索微生物在特定药物或其组合中的生长效率,从而研究它们对有毒含碳化合物(如天然产物、药物或外源性化合物)的敏感性。MicroResp一般用于多碳源诱导呼吸,培养过程由专用的96深孔板(培养板)和检测板组成,本方法利用其测定原理,仅以血清瓶进行培养以测定基础呼吸。在本试验的4种测定方法中,该方法操作简便、检测最快速,可迅速完成大批量样品的测定。但是,该法检测范围较窄,只能测量一定时间段内的土壤CO2释放量,并且重复性略差(表2)。
3.2.4 碱液吸收法 碱液吸收法作为测定土壤表层CO2排放通量的经典方法,最初于1927年由Lundegårdh[35]引入,后被广泛应用于多种生态系统土壤CO2的分析[36]。多年来,在实验室中测量土壤呼吸最普遍应用的方法就是碱液吸收法。但这种方法的测定精度不理想,普遍出现测定结果准确性低的现象,与实际土壤呼吸速率存在显著差异[10]。主要表现为:有机质含量或土壤呼吸速率低时,测定结果高于真实值;有机质含量或土壤呼吸速率高时,测定结果低于真实值[10,37]。本试验样品除S3、S4(有机质含量低,但所得结果未高于真实值),以及S11(有机质含量高,呼吸速率也高)外,总体上也体现出了这种规律。此外,碱液在反复接触空气后无法维持其最初吸收的CO2量,故不允许频繁测量[19]。因此为保证土壤呼吸测定的准确性,应尽量选择除碱液吸收外的其他方法。
除此之外,经碱液吸收后再通过Gasbench-IRMS检测稳定碳同位素的含量,结果也缺乏一定的准确性。由于碱液吸收法会有一定的(正/负)激发效应,故而在使用该方法测定诱导呼吸释放的碳同位素含量时尤其应当注意:一方面,碱液吸收会导致空气中的CO2污染待测样品(无论是培养还是测定过程中氦气冲洗都无法消除其影响,但测定过程中空气的污染可以通过计算法扣除);另一方面,碱液吸收引起的激发效应会低估或高估添加碳源的诱导呼吸速率(图5),进而影响到同位素的准确测定及溯源(图4),特别是对碳源激发效应的计算。另外,对于土壤基础呼吸,碱液在存取过程中也易被空气污染,导致待测样品的δ13C值比真值高。
综上,碱液吸收法在土壤呼吸速率测定中存在较大局限性,土壤有机质处于中等水平时,其基础呼吸速率测定数值才与仪器法的较为接近;在13C同位素丰度测定上,即便土壤呼吸速率与GC-TCD测定结果相近的情况下(图5中S4),碱液吸收法仍高估或低估了样品的13C含量(图4)。因此,在条件允许的情况下,应尽量避免碱液吸收法的使用。
4 结论
1) 11个有机质含量呈梯度水平的水稻土壤,在以4种方式测定其基础土壤呼吸速率试验中,土壤CO2释放速率具有明显变化趋势,具体表现为:有机质含量在10 ~ 55 g/kg水平范围内,基础土壤呼吸速率呈随有机质含量升高而增大的线性变化。GC- TCD法测定土壤呼吸的准确度最高,Gasbench- IRMS法次之;MicroResp法在灵敏度及重复性方面尚有欠缺;而碱液吸收法测定结果与真实值相差最大,准确度最低。
2) Gasbench-IRMS法直接测定土壤呼吸的13C含量误差小、接近真实值,较为精确;碱液吸收后再经同位素测定土壤呼吸的13C含量误差偏大,且易被空气污染,导致自然丰度的样品同位素比值偏高而标记样品同位素比值偏低。
3) 测定建议:①仪器测定法的结果更真实可靠。GC-TCD可测定低/高强度的土壤呼吸速率,测定范围大且不失准确性;Gasbench-IRMS测定基础(低)土壤呼吸速率同时可兼备同位素的测定。②MicroResp法不需要高成本设备,操作简便,速度快,但灵敏度有所欠缺。③碱液吸收法适合测定有机质处于中等水平的基础土壤呼吸速率;因空气的污染问题,如需测定呼吸释放的碳同位素丰度,则应尽量避免使用碱液吸收法。
[1] Houghton J T. Climate change 2001: The scientific basis: Contribution of Working Group I to the third assessment report of the Intergovernmental Panel on Climate Change[M]. Cambridge, UK: Cambridge University Press, 2001.
[2] Otto F E L, Frame D J, Otto A, et al. Embracing uncertainty in climate change policy[J]. Nature Climate Change, 2015, 5(10): 917–920.
[3] Scharlemann J P, Tanner E V, Hiederer R, et al. Global soil carbon: Understanding and managing the largest terrestrial carbon pool[J]. Carbon Management, 2014, 5(1): 81–91.
[4] Zheng Z M, Yu G R, Fu Y L, et al. Temperature sensitivity of soil respiration is affected by prevailing climatic conditions and soil organic carbon content: A trans-China based case study[J]. Soil Biology and Biochemistry, 2009, 41(7): 1531–1540.
[5] Ai M M, Sun Y Y, Yan B, et al. A summary of the impact of land degradation on soil carbon sequestration[J]. IOP Conference Series: Materials Science and Engineering, 2018, 394: 052028.
[6] Bond-Lamberty B, Thomson A. Temperature-associated increases in the global soil respiration record[J]. Nature, 2010, 464(7288): 579–582.
[7] Anderson J P E, Domsch K H. A physiological method for the quantitative measurement of microbial biomass in soils[J]. Soil Biology and Biochemistry, 1978, 10(3): 215–221.
[8] Anderson T H, Domsch K H. Maintenance carbon requirements of actively-metabolizing microbial populations underconditions[J]. Soil Biology and Biochemistry, 1985, 17(2): 197–203.
[9] 龚振平, 王雪松, 宋秋来, 等. 不同有机质含量土壤CO2排放季节变化规律及差异研究[J]. 东北农业大学学报, 2016, 47(3): 31-37.
[10] 苏永红, 冯起, 朱高峰, 等. 土壤呼吸与测定方法研究进展[J]. 中国沙漠, 2008, 28(1): 57–65.
[11] 张丁辰, 蔡典雄, 代快, 等. 旱地农田两种土壤呼吸测定方法的比较[J]. 中国土壤与肥料, 2011(4): 1–4, 29.
[12] 杨玉盛, 陈光水, 王小国, 等. 皆伐对杉木人工林土壤呼吸的影响[J]. 土壤学报, 2005, 42(4): 584–590.
[13] Zhang Z Y, Wang W F, Qi J X, et al. Priming effects of soil organic matter decomposition with addition of different carbon substrates[J]. Journal of Soils and Sediments, 2019, 19(3): 1171–1178.
[14] Schimel D S, Braswell B H, Holland E A, et al. Climatic, edaphic, and biotic controls over storage and turnover of carbon in soils[J]. Global Biogeochemical Cycles, 1994, 8(3): 279–293.
[15] Fang X, Zhao L, Zhou G Y, et al. Increased litter input increases litter decomposition and soil respiration but has minor effects on soil organic carbon in subtropical forests[J]. Plant and Soil, 2015, 392(1): 139–153.
[16] 包建平, 袁根生, 董方圆, 等. 生物质炭与秸秆施用对红壤有机碳组分和微生物活性的影响[J]. 土壤学报, 2020, 57(3): 721–729.
[17] 闫靖华, 张凤华, 李瑞玺, 等. 盐渍化弃耕地不同恢复模式下土壤有机碳及呼吸速率的变化[J]. 土壤, 2013, 45(4): 661–665.
[18] Anderson J P E. Soil respiration[J]. Methods of soil analysis: part 2 chemical and microbiological properties, 1983, 9: 831–871.
[19] Mondini C, Sinicco T, Cayuela M L, et al. A simple automated system for measuring soil respiration by gas chromatography[J]. Talanta, 2010, 81(3): 849–855.
[20] Ferraz-Almeida R, Spokas K A, De Oliveira R C. Columns and detectors recommended in gas chromatography to measure greenhouse emission and O2uptake in soil: A review[J]. Communications in Soil Science and Plant Analysis, 2020, 51(5): 582–594.
[21] Van Cleve K, Coyne P I, Goodwin E, et al. A comparison of four methods for measuring respiration in organic material[J]. Soil Biology and Biochemistry, 1979, 11(3): 237–246.
[22] Lei J S, Guo X, Zeng Y F, et al. Temporal changes in global soil respiration since 1987[J]. Nature Communications, 2021, 12: 403.
[23] 夏文斌, 张旭辉, 刘铭龙, 等. 麦秆还田方式对旱地土壤综合温室效应的影响[J]. 土壤, 2014, 46(6): 1010–1016.
[24] Aston F W. Mass spectra and isotopes[M]. New York: Longmans, Green & co., 1942.
[25] 张林, 孙向阳, 高程达, 等. 稳定同位素比例质谱仪在土壤碳循环研究中的应用[J]. 分析仪器, 2010(1): 18–23.
[26] 刘飞, 刘攀, 曹铭, 等. 稳定同位素技术在植物水分关系研究中的应用综述[J]. 生态科学, 2020, 39(6): 224–232.
[27] Del Galdo I, Six J, Peressotti A, et al. Assessing the impact of land-use change on soil C sequestration in agricultural soils by means of organic matter fractionation and stable C isotopes[J]. Global Change Biology, 2003, 9(8): 1204–1213.
[28] van Geldern R, Verma M P, Carvalho M C, et al. Stable carbon isotope analysis of dissolved inorganic carbon (DIC) and dissolved organic carbon (DOC) in natural waters - Results from a worldwide proficiency test[J]. Rapid Communications in Mass Spectrometry, 2013, 27(18): 2099–2107.
[29] 于贵瑞, 王绍强, 陈泮勤, 等. 碳同位素技术在土壤碳循环研究中的应用[J]. 地球科学进展, 2005, 20(5): 568–577.
[30] Assayag N, Rivé K, Ader M, et al. Improved method for isotopic and quantitative analysis of dissolved inorganic carbon in natural water samples[J]. Rapid Communications in Mass Spectrometry, 2006, 20(15): 2243–2251.
[31] Campbell C D, Chapman S J, Cameron C M, et al. A rapid microtiter plate method to measure carbon dioxide evolved from carbon substrate amendments so as to determine the physiological profiles of soil microbial communities by using whole soil[J]. Applied and Environmental Microbiology, 2003, 69(6): 3593–3599.
[32] Creamer R E, Bellamy P, Black H I J, et al. An inter- laboratory comparison of multi-enzyme and multiple substrate-induced respiration assays to assess method consistency in soil monitoring[J]. Biology and Fertility of Soils, 2009, 45(6): 623–633.
[33] Creamer R E, Stone D, Berry P, et al. Measuring respiration profiles of soil microbial communities across Europe using MicroResp™ method[J]. Applied Soil Ecology, 2016, 97: 36–43.
[34] Drage S, Engelmeier D, Bachmann G, et al. Combining microdilution with MicroResp™: Microbial substrate utilization, antimicrobial susceptibility and respiration[J]. Journal of Microbiological Methods, 2012, 88(3): 399–412.
[35] Lundegårdh H. Carbon dioxide evolution of soil and crop growth[J]. Soil Science, 1927, 23(6): 417–453.
[36] Schiedung H, Bauke S, Bornemann L, et al. A simple method forassessment of soil respiration using alkali absorption[J]. Applied Soil Ecology, 2016, 106: 33–36.
[37] 魏书精, 罗碧珍, 魏书威, 等. 森林生态系统土壤呼吸测定方法研究进展[J]. 生态环境学报, 2014, 23(3): 504–514.
Comparative Study on Determination Methods of Soil Respiration and Its13C Isotope
NIE Tangtang1, 2, WANG Juan2, YAO Huaiying1, 2, GE Chaorong1*
(1 Research Center for Environmental Ecology and Engineering, School of Environmental Ecology and Biological Engineering, Wuhan Institute of Technology, Wuhan 430073, China; 2 Key Laboratory of Urban Environment and Health, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen, Fujian 361021, China)
In order to compare the differences between various methods in determining soil respiration as well as its13C isotope, gas chromatograph (GC-TCD), stable isotope mass spectrometer (Gasbench-IRMS), cresol red coloration (MicroResp) and alkali absorption were applied to measure soil respiration rates, two methods that Gasbench-IRMS andalkali absorption were used to detect13C isotope abundance in soil respiration, so as to accurately assess soil respiration and carbon emissions, and provide reference for related research. The results show that: 1) Soil CO2emission rates measured by the two instrumental methods (GC and IRMS) are analogical (basal respiration) or trend-consistent (induced respiration), with good repeatability (standard deviation is 0.011, 0.010 mg /(kg·h), respectively) and high accuracy. The data from MicroResp is similar to that from apparatus, but the precision is relatively poor. Partial results determined through alkali absorption method are either higher (soils with low SOM content) or lower (soils with high SOM content) than the real values. 2) In the detection of13CO2abundance, the deviation determined by Gasbench-IRMS is small (standard deviation of the δ13C value is 0.137‰), and the results is closed to the expected values, can accurately reflect the utilization of surrounding substrate by soil microbes during respiration. In conclusion, the instrumental method can more accurately determine soil respiration and its13C isotope than chemical analysis methods (MicroResp and alkali absorption).
Soil respiration measurement;13C isotope abundance; Method comparison
S154.1
A
10.13758/j.cnki.tr.2023.03.015
聂棠棠, 王娟, 姚槐应, 等. 土壤呼吸及其13C同位素测定方法的对比研究. 土壤, 2023, 55(3): 578–586.
国家自然科学基金青年科学家基金项目(41701282)资助。
(chaorongge@wit.edu.cn)
聂棠棠(1997—),女,广西梧州人,硕士研究生,主要研究方向为土壤碳循环。E-mail: tt1542605054@163.com

