M2型巨噬细胞外泌体包裹miR-374a促进前列腺癌恶性进展的机制研究
关 翰,孙文衍,汪 盛,陈志军
前列腺癌(prostate cancer,PCa)是男性常见的恶性肿瘤,在导致男性癌症死亡的原因里名列前茅[1]。早期PCa的治疗方案为去雄激素治疗,随着病情的进展,多数会进展为去势抵抗型PCa(castration-resistant prostate cancer,CRPC),这一阶段的PCa已对雄激素不敏感,是目前的治疗难题[2]。同时,有50%~70%的CRPC病人最终发生远处转移,成为导致死亡的主要原因[3],探究促使PCa发生恶性进展的机制,使病人获得更好的预后显得尤为重要。近年来PCa的肿瘤微环境受到越来越多的关注,因其在调节肿瘤进展和转移扮演着重要角色[4]。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)是肿瘤微环境中最丰富的免疫细胞群,在肿瘤转移过程中具有广泛的促肿瘤作用。巨噬细胞在局部微环境中可能会对不同的刺激表现出不同的表型。一般说来,在各种外界因素刺激下,巨噬细胞可以分化为经典的促炎型M1巨噬细胞和抗炎型M2巨噬细胞,M2型巨噬细胞能促进肿瘤进展[5],因此,TAMs似乎更有可能被归类为M2巨噬细胞,尽管其具有同时表达M1和M2标志的混合表型。M2型巨噬细胞释放的细胞因子或蛋白与肿瘤细胞的耐药、侵袭和转移密切相关。外泌体是直径在20~200 nm之间的脂质双层膜囊泡。外泌体可以包裹微小RNA、长非编码RNA、蛋白质和其他生物活性物质,调控生理和病理条件下细胞的活动[6],可以由癌细胞或非癌细胞分泌,并可以被微环境中的其他细胞吸收,从而影响到其他细胞的生物学功能[7]。在前期研究[8]中,笔者发现在PCa组织中M2型巨噬细胞含量比前列腺增生组织高,并鉴定了一些在M2型巨噬细胞外泌体和THP-1外泌体中差异标的miRNA,其中miR-374a在M2型巨噬细胞外泌体内高表达。本研究进一步体外和体内实验表明,miR-374a可通过M2外泌体传递至PCa细胞内,并可靶向叉头盒转录因子1(FOXO1)增强PCa细胞的增殖、侵袭和上皮间质转化(epithelial-mesenchymal transition,EMT)的能力。现作报道。
1 材料与方法
1.1 细胞的获取 PC3、DU145和LNCaP三种前列腺癌细胞以及前列腺上皮细胞RWPE-1购自ATCC细胞库,细胞培养液为RPMI1640 (Gibco),含10%的胎牛血清以及双抗(Gibco)。细胞培养在37 ℃、5%CO2、95%饱和湿度的细胞培养箱中进行。人单核细胞系THP-1购自广州赛库,在含有10%胎牛血清(Gibco)、100 U/mL青霉素和100 μg/mL链霉素的RPMI1640中培养。为了诱导THP-1细胞向M2型巨噬细胞转化,在THP-1细胞中加入200 ng/mL PMA(南京春秋生物)24 h,然后再与20 ng/mL IL-4和20 ng/mL IL-13培养48 h。流式细胞仪检测M1、M2标志物的表达。
1.2 外泌体的抽提与鉴定 THP-1细胞和M2型巨噬细胞在RPMI1640中培养48 h后,将条件培养液350 g离心10 min,再2 000 g离心30 min,去除细胞和细胞碎片。将离心后的上清液以10 000 g离心30 min和100 000 g离心70 min。离心后的外泌体悬浮于50~100 μL磷酸盐缓冲液(PBS)中。超速离心机型号为Beckman Optima L-80XP。透视电镜观察外泌体形态,使用纳米粒子跟踪分析(Particle Metrix′s ZetaView)证明外泌体1.0×109~1.0×1010/mL,并且进一步使用Western blotting检测外泌体标志物。使用红色亲脂荧光染料Dil标志通过高速离心法抽提的外泌体。将Dil标记的外泌体分别与PC3和DU145细胞孵育24 h,使用荧光显微镜(Olympus FV1200,Japan)观察PC3和DU145细胞对Dil标记的外泌体的摄取情况。
1.3 细胞的共培养 cy3荧光标记的miR-374a购买自西安瑞禧生物科技有限公司,GW4869购买自MCE公司。将前列腺癌细胞PC3种入24孔板中,小室内种入转染过cy-3-miR-374a的M2型巨噬细胞,共培养24~48 h后使用荧光显微镜进行观察,对照组加入外泌体抑制剂GW4869。
1.4 荧光定量PCR实验 Trizol提取细胞中的RNA,使用外泌体RNA提取试剂盒(BIOG Exosome RNA Easy Kit)按照说明书进行操作获取外泌体中的RNA。逆转录试剂盒(Thermo Fisher)按照说明书进行操作。miRNA逆转录引物为RT-Primer,内参和mRNA的逆转录引物为Random Hexamer Primer。将RNA逆转录为cDNA。荧光试剂盒购买自罗氏公司。八连管中加入引物,cDNA模板、荧光染料,无菌去离子水补足体积至20 μL。上机检测仪器PCR条件设置为 95 ℃ 10 min,40个循环,循环条件95 ℃ 15 s,60 ℃ 1 min。循环结束后在60 ℃时收集数据,绘制扩增曲线。以U6作为内参,通过2-△△Ct法计算miR-183-5p的相对含量。
1.5 细胞的转染 基于 miRBase 数据库,从上海吉玛公司购买获得 miR-374a-5p mimic (UUA UAA UAC AAC CUG AUA AAG UG)、miR-374a-5p mimic control (UUU GUA CUA CAC AAA AGU ACU G)、miR-374a-5p inhibitor (CAC UUA UCA GGU UGU AUU AUA A) 和 miR-374a-5pinhibitor control (CAG UAC UUU UGU GUA GUA CAA A)以及 FOXO1 siRNA (si-FOXO1) 和具有非特异性序列的阴性对照siRNA (si-NC)。将DU145和PC3细胞接种在6孔板中,并按照制造商的方案使用Lipofectamine 2000(Thermo Fisher)进行转染。在转染后48 h,使用细胞进行功能测定。慢病毒颗粒的包装如下:3个慢病毒表达质粒由上海吉玛公司构建,含有针对miR-374a的siRNA,并用于在6 μg/mL Polybrene存在下感染PC3细胞。通过嘌呤霉素筛选细胞,并通过qRT-PCR确认miR-374a的敲低。miR-374a的stem-loop RT引物如下:5′-CTC AAC TGG TGT CGT GGA GTC GGC AAT TCA GTT GAG CAC TTA GC-3′;miR-374a-5p上下游引物序列:Forward,5′-3′ CCT GAT AAG TGG TCG TAT CCA GT;Reverse,5′-3′ GTA TCC AGT GCG TGT CGT GG。
1.6 CCK8实验 细胞转染48 h后,均匀接种于96孔板(1 000个细胞/孔)中。然后将细胞在37 ℃、5% CO2的潮湿环境中培养24、48、72和96 h。在每个时间点,将细胞与20 μL细胞计数试剂盒溶液(碧云天)孵育,然后在37 ℃、5% CO2中孵育4 h,以评估细胞的增殖能力。用分光光度计在495 nm波长处测定吸光度。每次实验重复3次。
1.7 EdU及Tunel实验 EdU和Tunel试剂盒均购买自罗氏公司,实验步骤简述如下。EdU实验:将处理完毕的细胞接种到24孔板中,加入EdU培养基后在细胞培养箱中培养2 h。用4%多聚甲醛固定,甘氨酸孵育,根据说明书加入试剂后使用荧光显微镜观察细胞图像;Tunel实验:每组转染细胞接种于密度为4×104/cm2的培养皿中24 h。弃去培养基,用PBS洗涤3次。然后用4%的多聚甲醛固定细胞,用0.5%的Triton X进行透膜,按照说明书操作完成剩余步骤后使用荧光显微镜观察。
1.8 Western blotting实验 收集细胞进行裂解,提取总蛋白。使用聚丙烯酰氨凝胶电泳SDS-PAGE分离蛋白,随后使用PVDF膜(Millipore)进行转膜。转膜完毕后使用5%的脱脂奶粉封闭1 h,使用一抗4 ℃孵育过夜。TBST洗涤后二抗(1∶2 000)孵育1~2 h,用TBST洗涤PVDF膜,随后用ECL发光检测试剂盒(碧云天)在化学发光检测系统进行显色。Western blotting定量分析采用Image-Pro Plus软件进行(Media Cybernetics)。抗体信息:anti-FOXO1 antibody (ab207204,Abcam),anti-E-cadherin antibody (ab1416,Abcam),anti-N-cadherin antibody (ab18203,Abcam),anti-Vimentin antibody (ab92547,Abcam)。
1.9 流式细胞凋亡检测 细胞铺6 孔板,待生长至70%分别转染,3 d后可进行实验。PBS洗涤细胞2次,采用不含EDTA的胰蛋白酶消化细胞,计数调整浓度,PI/AV 染色(吉凯生物),流式细胞仪检测细胞凋亡。
1.10 细胞迁移和侵袭检测 分别使用不带有Matrigel 和预铺Matrigel的Transwell小室进行细胞迁移和侵袭实验。小室上层为无血清培养基,下层为含10%血清的培养基。加入细胞培养7~12 h后固定,结晶紫染色,去除上层细胞,显微镜下计数穿过薄膜的细胞。
1.11 划痕实验 将细胞接种在6孔板中用丝裂霉素C(1 μg/mL)预处理1 h排除增殖的影响。使用无菌移液管尖端在孔中形成直伤口,并使用PBS去除漂浮细胞。倒置显微镜在0和36 h拍摄细胞迁移图像,并通过Image J分析软件测量细胞迁移距离,选择了3个距离并取平均值。
1.12 平板克隆实验 细胞以每孔500个细胞的密度接种于6孔板中,在培养箱中培养12 d。处理时细胞用PBS清洗3次,甲醇固定15 min,室温下用300 μL 0.1%结晶紫染色20 min。用ImageJ 2X软件计数含有50个以上细胞的集落。
1.13 裸鼠皮下成瘤实验 6周龄BALB/C裸鼠购自扬州大学比较医学中心。所有动物实验均经蚌埠医学院第一附属医院机构动物爱护使用委员会和伦理委员会批准。实验根据美国国家实验动物护理和使用研究所健康指南进行。将转染慢病毒的PC3细胞胰酶消化后悬浮在PBS中,将细胞(4×106个)注射到裸鼠侧腹皮下种植7周。7周后,通过颈椎脱位处死裸鼠。用游标卡尺测量肿瘤最长直径和最短直径,体积=1/2(长径×短径2)计算肿瘤体积。部分切除组织用于Western blotting检测。
1.14 免疫荧光实验 将细胞用 PBS 洗涤3次,用4%多聚甲醛固定,使用0.2% Triton X-100透膜。向细胞中加入抗体并在4 ℃下孵育过夜。 第2天将在室温下孵育15 min的细胞与二抗一起孵育。随后的实验在黑暗中进行。在37 ℃孵育90 min并用PBS清洗3次后,使用荧光共聚焦显微镜(Carl Zeiss LSM800型) 进行观察。
1.15 荧光素酶报告基因实验 由上海吉玛基因合成了 FOXO1 3′-非翻译区(3′-UTR)片段,其中包含可能的miR-374a结合序列。将野生型和突变型FOXO1 3′-UTR亚克隆到psiCHECK-2TM载体中,获得psi-check-FOXO1-wt和psi-check-FOXO1-mut。将DU145和PC3细胞接种于24孔板中,在37 ℃下用Lipofectamine2000试剂分别与miR-374a模拟物或NC、FOXO1-WT或FOXO1-mut质粒共转染,48 h后用双荧光素酶报告分析系统进行检测。采用化学发光法检测荧光素酶活性。重复测量3次,计算平均值。
1.16 统计学方法 采用t检验、方差分析及q检验。
2 结果
2.1 成功构建M2型巨噬细胞并抽提鉴定其外泌体 通过流式细胞仪检测CD68、CD86及CD206的表达量,结果可见M2型巨噬细胞标志物CD206表达量较M0和M1型巨噬细胞相比均明显升高(见图1A和表1)。同时抽提M2型巨噬细胞进行电镜观察,可见抽提的外泌体呈典型的茶托形状(见图1B)。纳米粒子跟踪分析显示外泌体粒径的集中趋势在110 nm左右。Western blotting检测外泌体膜标志物CD63及TSG101阳性,同时不表达GM130(见图1C),结合外泌体电镜照片、粒径分析及Western blotting检测外泌体膜标志物,确定抽提物质为M2型巨噬细胞外泌体。
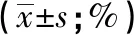
表1 M0、M1、M2型巨噬细胞标志物CD86和CD206阳性率比较
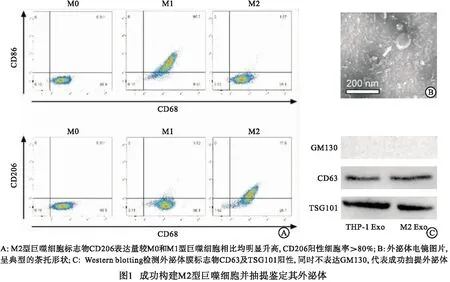
2.2 M2型巨噬细胞外泌体包裹miR-374a传递至PCa细胞内 荧光定量PCR结果显示,与人正常前列腺上皮细胞RWPE-1相比,miR-374a在前列腺癌细胞系DU145、PC3和LNCaP中均高表达(P<0.05),与THP-1细胞相比,miR-374a在M2型巨噬细胞中显著高表达(P<0.05和P<0.01)(见表2~3)。转染cy3荧光标志的miR-374a后的M2型巨噬细胞与PC3细胞在非接触共培养体系中共培养后PC3中miR-374a表达量显著升高(P<0.05),但在共培养体系中加入外泌体抑制剂GW4869,共培养后PC3中miR-374a表达无明显变化(P>0.05)(见表4)。使用红色DiL荧光标志外泌体,并与PC3细胞共培养,荧光显微镜可观察到外泌体被PC3细胞吸收,蓝色DAPI荧光为细胞核,红色为DiL荧光(见图2A~2C)。转染cy3荧光标志的miR-374a后的M2型巨噬细胞与PC3细胞非接触共培养,荧光显微镜观察到PC3中存在cy3的绿色荧光,在共培养体系中加入GW4869则荧光显微镜在PC3中无法观察到绿色荧光。抽提cy3荧光标志的miR-374a后的M2型巨噬细胞外泌体与PC3细胞共培养,亦可在细胞中观察到cy3的绿色荧光(见图2D~2H),代表miR-374a可通过M2型巨噬细胞外泌体传递至PC3细胞内。

表2 miR-374a在不同细胞中的相对表达量

表3 miR-374a在M2和THP-1中的相对表达量

表4 不同分组外泌体与PC3细胞共培养后miR-374a相对表达量的变化
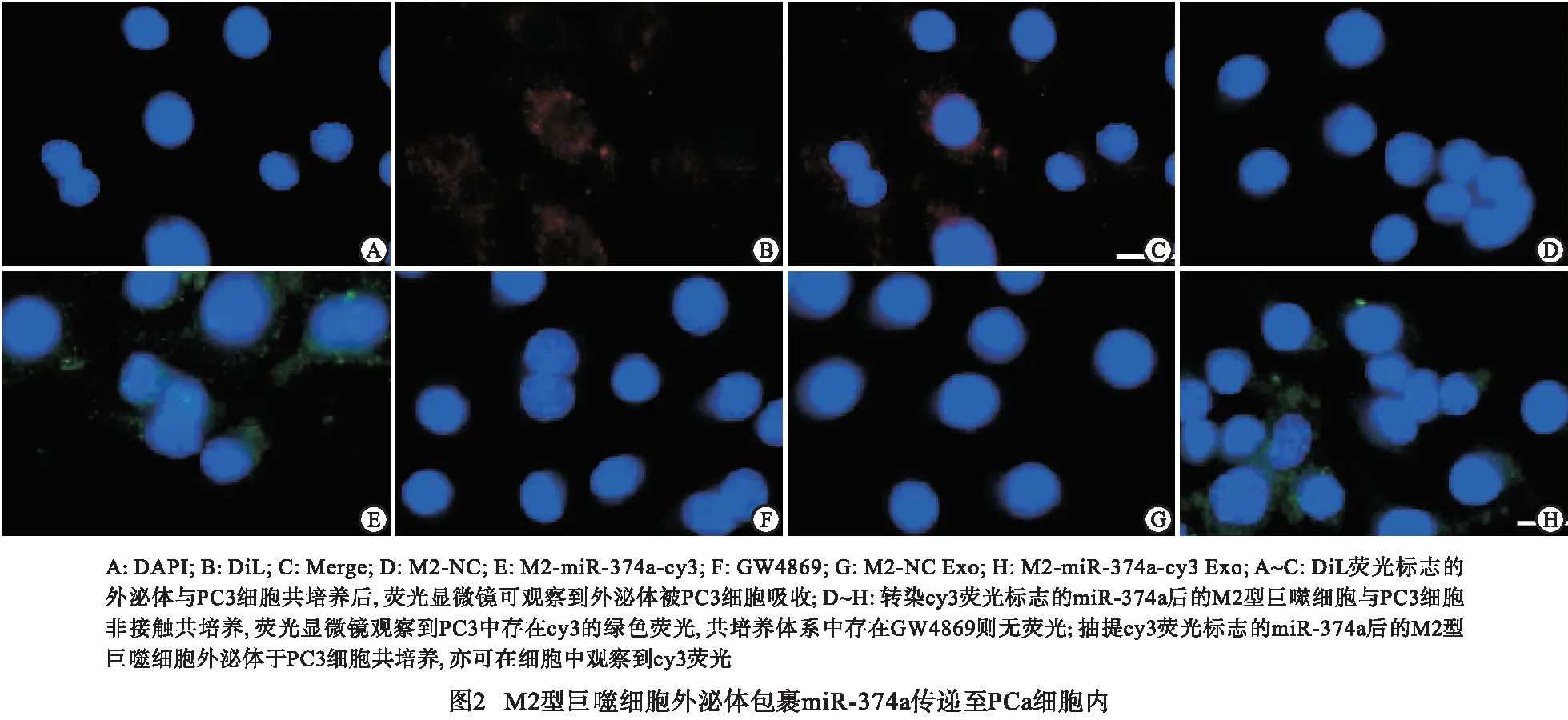
2.3 miR-374a可促进PC3和DU145细胞的增殖、侵袭迁移能力并抑制其凋亡 通过瞬时转染miR-374a进行细胞功能学实验,克隆形成实验、EdU实验结果验证抑制miR-374a后细胞增殖能力减弱(P<0.01)(见表5及图3A~3C);Tunel实验、凋亡实验证实抑制miR-374a后促进细胞凋亡(P<0.05~P<0.01)(见表5~6及图3C~3D);侵袭实验、细胞划痕实验证实抑制miR-374a后抑制细胞侵袭及迁移能力(P<0.01)(见表7及图3B~3E)。

表5 转染miR-374a inhibitor后细胞增殖能力的变化
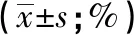
表6 流式细胞凋亡实验验证转染miR-374a inhibitor后细胞凋亡能力变化

表7 转染miR-374a inhibitor后细胞迁移及侵袭能力的变化
2.4 miR-374a inhibitor可抑制PC3细胞裸鼠皮下成瘤的瘤体生长 转染慢病毒稳定干扰PC3细胞内miR-374a的表达,进行裸鼠皮下成瘤实验,通过小动物成像仪观察瘤体Luc荧光(见图4A),处死裸鼠后测量瘤体体积,干扰miR-374a后可明显抑制瘤体生长(见图4B),Western blotting实验检测干扰miR-374a组瘤体组织中FOXO1对比对照组表达显著升高(P<0.05)(见图4C、表8)。
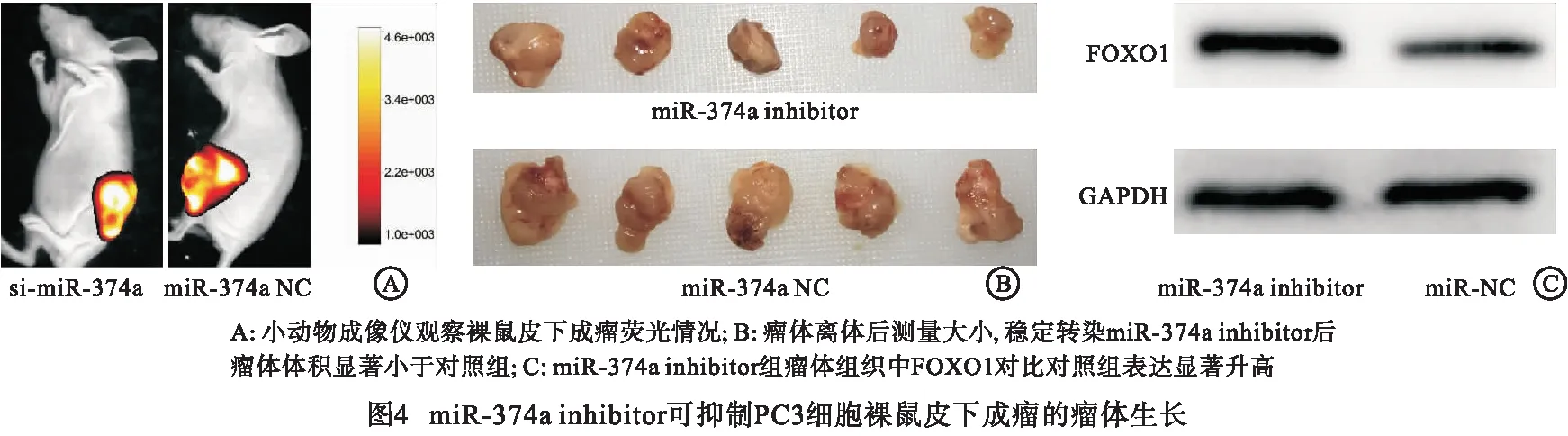

表8 转染miR-374a inhibitor后细胞成瘤能力变化
2.5 miR-374a靶向FOXO1促进β-catenin入核,促进前列腺细胞EMT 预测网站结合文献选取FOXO1作为miR-374a潜在下游靶基因进行验证,荧光素酶报告基因实验结果提示miR-374a序列能直接结合到FOXO1 3′UTR区(P<0.01)(见表9)。Western blotting实验结果显示转染miR-374a inhibitor后可抑制DU145及PC3细胞EMT进展,同时FOXO1表达量升高,核内β-catenin表达量减低(见图5A),为进一步直观验证,免疫荧光实验观察到转染miR-374a inhibitor后FOXO1荧光强度减低,同时β-catenin荧光向细胞核外转移(见图5B)。在前列腺增生及PCa组织中验证FOXO1表达量,提示增生组织中FOXO1表达量较高(P<0.05)(见表10)。

表9 荧光素酶报告基因实验各组荧光比值变化

表10 PCa及前列腺增生组织中FOXO1相对表达量
2.6 功能回复实验验证si-FOXO1可逆转miR-374a inhibitor对细胞侵袭能力及EMT造成的影响 为验证si-FOXO1效率,通过Western blotting实验检测干扰FOXO1后的表达,结果证明干扰后PCa细胞中的FOXO1表达量显著减低(见图6A),同时干扰FOXO1表达后PCa细胞侵袭能力下降(见图6B),为进一步探究miR-374a与FOXO1的关系,共转染后进行侵袭实验及Western blotting检测EMT相关指标,结果说明si-FOXO1可逆转miR-374a inhibitor对细胞侵袭能力及EMT造成的影响(P<0.05~P<0.01)(见图6C~6D及表11)。
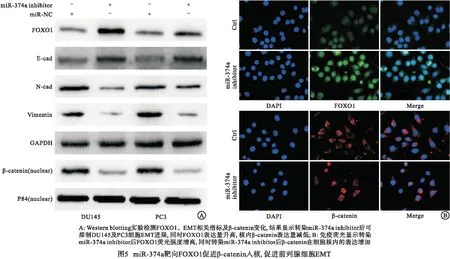
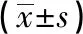
表11 功能回复实验各组细胞侵袭能力变化
3 讨论
近年来越来越多的学者将注意力集中在肿瘤微环境中的细胞相互作用上[8-9],其中肿瘤相关巨噬细胞是研究的重点和热点。肿瘤相关巨噬细胞衍生的趋化因子和细胞因子,如CCl-5、CCl-17和转化生长因子-β,显著影响癌症进展的各个方面,包括免疫逃逸、肿瘤扩散和治疗耐药等[10]。此外有研究[11]表明,浸润的巨噬细胞群与癌细胞的生物学行为呈正相关关系,并与病人预后不良密切相关。在本课题组前期研究[12]中发现,前列腺肿瘤组织中肿瘤相关巨噬细胞数量高于前列腺增生组织,提示肿瘤相关巨噬细胞可能在PCa恶性进展中发挥作用。
大多数研究都集中在巨噬细胞分泌的细胞因子、分子或其他蛋白质上,但考虑到miRNAs对癌细胞进展的调节作用,还需要更多地关注miRNAs。miRNAs是一种非编码的单链RNA分子,与靶基因的3′-UTR结合,在转录后调节mRNA的表达。以往的研究仅局限于细胞或组织的miRNA差异表达,而忽略细胞外泌体的作用,它们也可能通过包裹运输miRNA来介导细胞与细胞之间的相互作用。例如,外显子介导的载脂蛋白E(ApoE)的穿梭参与了PI3K-Akt信号通路的激活,从而促进了胃癌细胞的迁移[13]。此外,膀胱癌细胞分泌的转化生长因子-β可诱导成纤维细胞表型转化为与癌症相关的成纤维细胞[14]。有研究团队[15]发现TAM衍生的外切体中包含的miR-21和miR-155通过靶向BRG1表达促进结肠癌细胞的迁移和侵袭。有研究[16]报道,上皮性卵巢癌中Treg/Th17细胞的失衡主要归因于TAM外切体产生的miRNA水平异常,因此,笔者推测TAM外体释放的miRNAs影响PCa细胞的恶性行为。为了验证笔者的假设,笔者进行了微阵列分析,从THP-1和M2型巨噬细胞的外体中筛选出差异表达的miR-374a并进行进一步实验。
miR-374a在促进或抑制各种恶性肿瘤发展方面的不同作用使其难以达成共识[17-19]。通过搜索相关文献,尚未见明确证据表明 miR-374a 在PCa发生或进展中的调节作用研究,这使得笔者值得进行进一步的研究。随后的 qRT-PCR 结果也与基因芯片结果吻合。笔者验证了外泌体释放的miR-374a可以直接被受体PCa细胞吸收,并检测到PCa细胞中cy3标记的miR-374a的绿色荧光信号,而添加外泌体抑制剂时未检测到绿色荧光。
在进行细胞功能学实验后,笔者发现miR-374a在体外和体内可以显著促进 PCa 细胞的增殖并抑制细胞凋亡。为了寻找可能导致 miR-374a 的促肿瘤发生作用的下游靶点,笔者通过靶基因预测网站选取交集结合文献,预测FOXO1作为miR-374a的下游靶基因,通过荧光素酶报告基因测定和蛋白质印迹验证。FOXO1 是叉头盒转录因子家族(FOXO1、FOXO3、FOXO4 和 FOXO6)的重要成员,它已被证明为调节肿瘤的恶性过程的重要因子,包括细胞增殖、侵袭和转移[20]。FOXO1 在促进或抑制多种恶性肿瘤的EMT过程中发挥着与不同的作用。一方面,ERK2与FOXO1/DOCK10协同作用以促进细胞迁移和EMT[21],同时,FOXO1参与PIK3/AKT通路来参与IMPDH2介导的结直肠癌EMT进展[22]。然而另一方面,FOXO1被发现受到上游miRNA的抑制,例如miR-5188和miR-223,从而阻碍了乳腺癌和肺腺癌中的EMT[23-24]。在PCa 发育过程中,绝大多数研究似乎都承认FOXO1通过受其上游mRNA和miRNA 调节或调节下游转录因子(包括RUNX2)发挥抑制作用[25-27]。在此基础上笔者发现FOXO1的表达可能受到miR-374a的抑制,从而促进PCa细胞的增殖和侵袭。从理论上讲,FOXO1可以与细胞质中的β-catenin发生功能性相互作用,抑制β-catenin在细胞核中的积累并促进其降解,从而抑制已知EMT标志物和癌症转移关键调节剂的激活[28-29]。本研究发现miR-374a通过抑制FOXO1表达发挥其对PCa恶性进展的促进作用,并进一步证明干扰FOXO1导致 β-catenin在PCa细胞中的易位并显增加EMT标志物的表达。
本研究仍有一定的局限性,EMT是肿瘤转移的关键步骤,还可以进行体内肺或骨转移测定以确定miR-374a是否会影响PCa细胞转移。此外,笔者的数据不支持涉及Wnt/β-catenin途径或调节miR-374a表达的上游介质的进一步分子探索。除了考虑miR-374a和其他潜在靶mRNA之间的共同结合位点之外,识别和验证其他靶标及其效果对于提供额外的治疗方案是必不可少的。总之,本研究发现在M2型巨噬细胞中分离出的外泌体的驱动下,PCa 细胞在肿瘤微环境恶性行为进一步发展,此外,笔者说明了miR-374a/FOXO1/β-catenin轴在诱导EMT和加速PCa恶化中的作用,提示笔者可以通过研究针对 miR-374a/FOXO1/β-catenin 轴的治疗方法来治疗PCa病人。

