Th17/Treg相关细胞因子失衡参与子痫前期的发病机制
谢丝雨,张 英,陈 繁
子痫前期是一种常见的妊娠特有的多系统疾病,它影响全世界1.5%~16.7%的孕妇[1]。正常成功妊娠依赖于母体的免疫耐受机制,抑制对胎儿和胎盘的不良免疫反应,并为胎儿生长发育提供营养支持[2]。正常妊娠的维持是由多种免疫细胞共同参与,传统研究[3]认为,T细胞1/T细胞2(T helper 1/T helper 2,Th1/Th2)在维持正常妊娠起主要作用。而另一对辅助性T细胞,T细胞17/调节性细胞(T helper 17/tegulatory cells,Th17/Treg)在维持母婴免疫耐受中发挥重要作用,研究[4]表明Th17/Treg失衡参与子痫前期的发病机制。白介素-23(interleukin-23,IL-23)作为促炎性细胞因子决定Th17细胞的致病性,而白介素-10(interleukin-10,IL-10)作为抑炎性细胞因子,可由Treg细胞分泌并反过来调节Treg细胞的数量,白介素-2受体(interleukin-2 recepter,IL-2R)作为白介素-2(interleukin-2,IL-2)的受体,在子痫前期患者体内表现出差异表达[5]。该研究通过测定子痫前期患者血清及胎盘蜕膜组织中Th17/Treg相关细胞因子的表达,进一步探究其在子痫前期的发病机制中的作用,并通过分析细胞因子的差异表达,以期寻找子痫前期生物标志物,对子痫前期早期发现、早期诊断具有指导意义。
1 材料与方法
1.1 研究对象收集在安徽医科大学第一附属医院2020年10月—2022年3月住院分娩孕妇80例,其中50例子痫前期孕妇,30例正常孕妇,所有参与患者均为剖宫产方式终止妊娠并均签署知情同意书。子痫前期组纳入标准:选取标准参照《妇产科学》第 9 版教材对子痫前期的诊断,即妊娠 20 周后出现收缩压≥18.67 kPa和(或)舒张压≥12 kPa,伴尿蛋白≥0.3 g/24 h,或随机尿蛋白阳性。或虽无蛋白尿但合并下列任何一项者:血小板减少(血小板<100×109/L);肝功能损害(转氨酶水平为正常值2倍以上);肾功能损害(血肌酐水平大于)0.11 mg/L或为正常值2倍以上;肺水肿;新发的中枢神经系统障碍或视觉障碍。排除标准:妊娠血小板减少、妊娠糖尿病(血糖控制不佳)、妊娠肝内胆汁淤积症以及慢性肾功能损害等疾病,以及近期存在感染性疾病或服用免疫相关药物。本课题经安徽医科大学第一附属医院伦理委员会审查通过(批号: P2020-12-22)。
1.2标本收集与处理① 血清标本的采集与处理:采集孕妇空腹肘静脉血3 ml,室温离心(3 000 r/min,15 min),收取上清液,分装后置于-80 ℃冰箱中保存待检。② 用于免疫组化检测的胎盘及蜕膜组织的标本采集与处理:术中从胎盘母体面正中取1 cm×1 cm×1 cm大小新鲜组织,用PBS缓冲液漂洗去除血污后用10%甲醛溶液固定24 h后石蜡包埋保存备用;另外,取胎盘娩出后宫腔擦拭取出的蜕膜组织,同法保存备用。③ 用于实时荧光PCR(QPCR)检测的胎盘及蜕膜组织的标本采集与处理:术中收集胎盘及蜕膜组织用PBS缓冲液漂洗去除血污后浸泡5倍体积的RNAlater液中,4 ℃过夜,转移至-80 ℃冰箱保存备用。
1.3 试剂酶联免疫吸附法(ELISA)试剂盒购自 R&D system 公司;细胞微球芯片技术(CBA) Th1/Th2/Th17细胞因子试剂盒购于美国BD公司;抗体购自美国GeneTex公司,货号如下:IL-23(GTX85496),IL-2R(GTX60792),IL-10(GTX632359);RNA快速提取试剂盒购自TIANGEN公司;组织RNAFixer储存液购自北京普鲁顿生物科技有限公司;引物由上海生工生物工程有限公司设计,并购自该公司。
1.4 ELISA法在进行ELISA 实验前,将血清样本置入冰上解冻,涡旋混匀;IL-2R:在每孔中添加100 μl的RD1-1稀释液,标准孔中加入50 μl的标准品,实验孔加入50 μl的血清样本,向每孔加入 200 μl的IL-2R结合物,混匀后室温孵育3 h。每孔加入350 μl的洗涤液,洗涤4次,最后一次洗涤完成后完全倾倒洗涤液,并用吸水纸擦干。再分别添加200 μl提前配好的显色液,室温避光孵化20 min,每孔中添加50 μl的终止液。混合均匀。IL-23:在每孔中添加100 μl的RD1-22稀释液,标准孔加入 100 μl标准品,实验孔加入100 μl的血清样本,室温震动器上孵化2 h。每孔中加入350 μl的洗涤液,洗涤4次,最后一次洗涤完成后完全倾倒洗涤液,并用吸水纸擦干。每孔中加入200 μl提前配好的显色剂,室温振动器上孵化2 h。重复第三步洗涤后,每孔加入200 μl的IL-23结合物,在室温下避光孵化30 min。每孔加入50 μl的终止液,混合均匀。酶标仪上立刻测定吸光度,根据标准孔计算标准曲线,根据标准曲线计算每个孔对应的浓度值。
1.5 细胞微球芯片技术(cell microsphere array,CBA)制备Th1/Th2/Th17细胞因子标准品,浓度按照说明书等比例配制,制备Th1/Th2/Th17细胞因子捕获微球混悬液,将微球混匀后,每管加入 50 μl捕获微球混悬液,再依次加入50 μl的 Th1/Th2/Th17 PE信号标记荧光抗体并混匀。每管加入50 μl相应的Th1/Th2/Th17细胞因子标准品稀释液,及50 μl待检测血清。在室温避光孵育3 h后各管加入1 ml洗液,3 000 r/min离心5 min。弃上清液后各管加入300 μl洗液,重新悬浮微球,使用流式细胞仪分析样本,根据检测获取的数据,用CBA专用软件自动绘制标准曲线,根据标准曲线自动计算出样本中各细胞因子含量。
1.6 QPCR取保存于RNAlater液中的胎盘及蜕膜组织,严格按照动物组织RNA快速提取试剂盒说明书,提取组织中RNA并测定 RNA 浓度和纯度;按照试剂盒说明书严格操作,将 RNA 逆转录合成 cDNA,引物序列见表1。PCR 反应体系为 20 μl,反应条件 95 ℃,30 s,95℃,5 s,60 ℃,34 s,40 个循环;同时每个样本设置复孔,采用2-ΔΔCt法计算IL-10、IL-23、IL-2R的表达水平,其中Ct值为循环阈值。

表1 细胞因子及内参引物序列
1.7 免疫组化将石蜡切片放置于60 ℃烤箱烤片30~60 min,而后依次将其放入二甲苯Ⅰ、Ⅱ、Ⅲ各10 min,乙醇溶液(浓度梯度高至低:100%、95%、80%、70%)浸泡各2 min,水洗5 min,PBS洗3次,5 min/次进行脱蜡及水化。用预热的封闭通透液浸润切片30 min,PBS洗3次;将切片浸入pH 6.0的柠檬酸钠缓冲液,在微波炉里高火4 min至沸腾后,取出自然冷却至室温,重复2次,PBS洗3次。山羊血清 37 ℃封闭 1 h,轻轻甩去血清,一抗按照抗体说明书进行稀释(IL-10按1 ∶500稀释,IL-2R按照1 ∶500稀释,IL-23按照5 μg/ml进行稀释),阴性对照采用 PBS 代替一抗,4 ℃过夜。对圈内的组织滴加稀释好的二抗,37 ℃孵育30 min,PBS洗3次,5 min/次。用DAB-H2O2显色10 min;结果判定由本院病理科医师阅片后判定。以细胞膜出现黄色棕褐色颗粒者为阳性细胞,根据每份标本中的阳性细胞染色强度所占百分比进行评定;采用 Image J 进行平均吸光度值分析。

2 结果
2.1 两组孕妇一般临床资料的比较对纳入研究的两组孕妇进行年龄、体质量指数(body mass index, BMI)、孕期体质量增长量、终止孕周、收缩压、舒张压、新生儿出生体质量、Apagar评分、随机尿尿蛋白等临床信息进行统计,见表2。
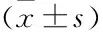
表2 两组孕妇临床参数比较
2.2 两组血清IL-23、IL-10、IL-6、IL-2R表达水平比较IL-23、IL-6、IL-10 结果的数据资料显示为非正态分布,其子痫前期患者血清中IL-23、IL-6、IL-10的浓度高于正常孕妇组,运用非参数检验曼-惠特尼U检验,两组差异有统计学意义,结果见表3。IL-2R结果的数据资料显示其为正态分布,子痫前期组为(700.37±212.85)pg/ml,正常孕妇组为(360.58±127.03)pg/ml,子痫前期患者血清中IL-2R的浓度高于正常孕妇组,差异有统计学意义(t=6.250,P=0.001)。

表3 两组血清IL-23、IL-10、IL-6表达水平比较[pg/ml,P50(P25~P75)]
2.3 两组胎盘组织中IL-10、IL-23、IL-2R mRNA的表达在子痫前期组胎盘组织中,IL-10表达较正常孕妇组明显降低,差异有统计学意义(P<0.05);而IL-2R在子痫前期组胎盘组织中表达升高,差异有统计学意义(P<0.05);IL-23在子痫前期组胎盘组织中表达降低,差异无统计学意义(P>0.05)。见图1A-1C。
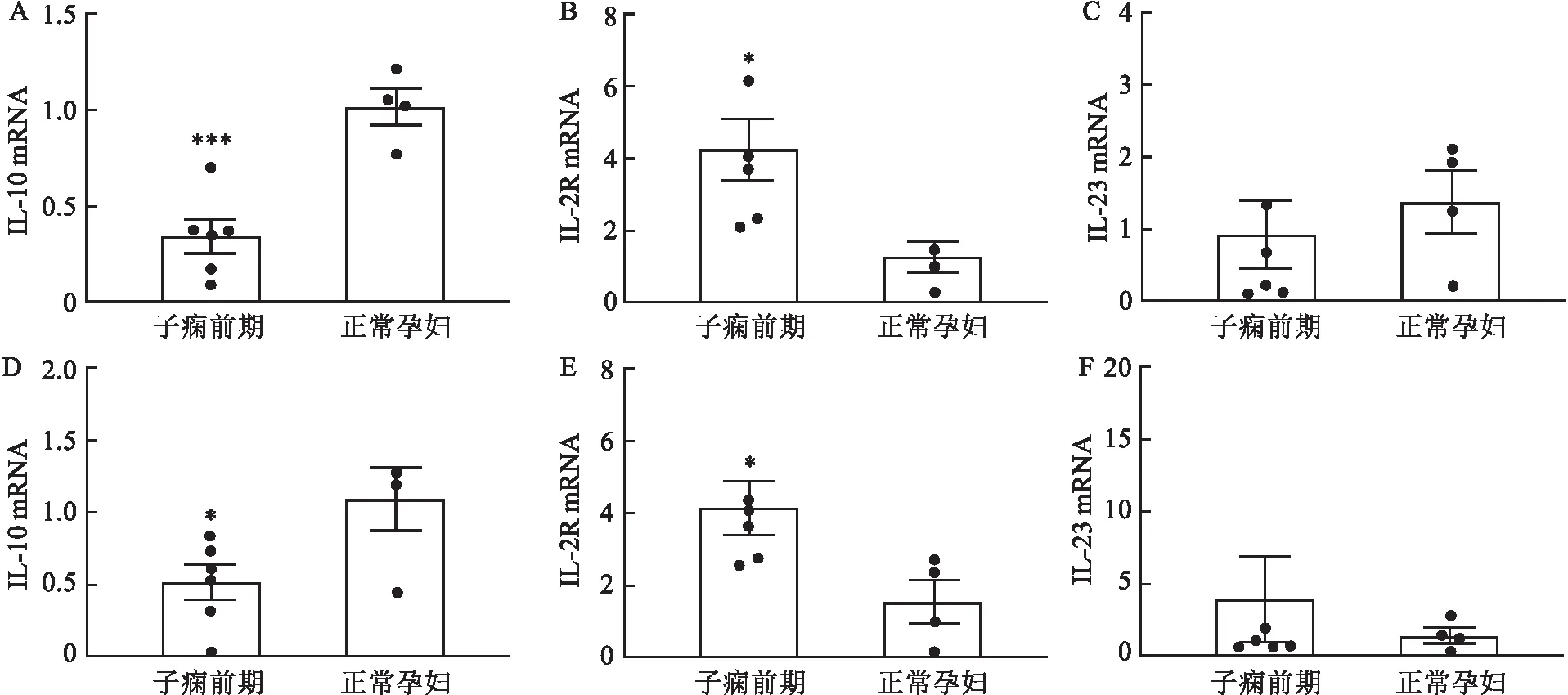
图1 IL-10、IL-23、IL-2R mRNA在子痫前期和正常孕妇胎盘蜕膜中的表达A、B、C:胎盘;D、E、F:蜕膜;与正常孕妇组比较:*P<0.05,***P<0.001
2.4 两组蜕膜组织中IL-10、IL-23、IL-2R mRNA的表达在子痫前期组胎盘组织中,IL-10表达较正常孕妇组明显降低,差异有统计学意义(P<0.05);而IL-2R在子痫前期组胎盘组织中表达升高,差异有统计学意义(P<0.05);IL-23在子痫前期组胎盘组织中表达降低,差异无统计学意义(P>0.05)。见图1D-1F。
2.5 IL-10、IL-23、IL-2R在胎盘中的表达IL-10在正常孕妇胎盘中表达高于子痫前期组孕妇,通过测量平均吸光度值进行比较,差异有统计学意义(t=-3.134,P=0.014)。IL-23在子痫前期患者胎盘中表达高于正常孕妇组,差异有统计学意义(t=3.217,P=0.008);IL-2R在子痫前期患者胎盘中表达高于正常孕妇组,差异有统计学意义(t=3.421,P=0.003)。见图2。
图2 免疫组化检测子痫前期和正常孕妇中IL-10、IL-23、IL-2R的表达 ×40
2.6 IL-10、IL-23、IL-2R在蜕膜中的表达IL-10在正常孕妇蜕膜中表达高于子痫前期组孕妇,通过测量平均吸光度进行比较,差异有统计学意义(t=-3.062,P=0.012);IL-23及IL-2R在子痫前期患者与正常孕妇蜕膜中表达差异无统计学意义。见图2。
3 讨论
免疫系统通过自我调节来维持正常妊娠过程,传统研究认为Th1/Th2在整个妊娠期发挥主要作用,Th17/Treg轴弥补了单一Th1/Th2轴的不足。在正常妊娠期间,为了调节孕妇对胎儿免疫耐受反应,母体胎盘蜕膜及外周血中Treg细胞数量显著增加。然而Th17细胞过度激活高表达促炎因子则会进一步招募免疫效应细胞,从而导致一系列炎症性疾病,如子痫前期等[6]。
子痫前期的发病机制目前尚不明确,而辅助性T细胞在子痫前期患者的免疫调节中起到核心作用[7]。子痫前期患者外周血中Th17细胞百分率及Th17/Treg比值明显高于正常孕妇[8],外周血中促进Th17细胞生成的细胞因子也呈升高趋势,而与Treg生成的相关细胞因子呈下降趋势,Treg细胞下降并向Th17细胞偏移会导致子痫前期[9]。在子痫前期患者表现出临床症状之前,已存在辅助性T细胞以Treg向Th17分化增多,并伴随相关细胞因子的变化,细胞因子通常分为促炎因子和抗炎因子,并与表达他们的Th细胞亚群相关联,Th17及Treg都有其特定的细胞因子谱,由这些辅助性T细胞亚群产生的细胞因子在免疫细胞分化和效应细胞反应中起重要作用。
IL-6、IL-23是诱导T细胞分化为Th17细胞必须的,IL-23对Th17起到稳定活化及扩增的作用,IL-23能将CD4(+)T细胞诱导为高致病性Th17,阻断IL-23能够有效抑制如子痫前期等疾病的发生及进展[10]。IL-10具有强大的抗炎效应,不仅可以影响Th17细胞的分化,IL-10同样是Treg细胞发挥抗炎作用并维持动态平衡所必须的[11]。
IL-2R即白细胞介素2受体,介导了IL-2的作用,它与血清中的IL-2结合抵消了细胞因子与细胞表面受体的结合,影响了白介素特异性的细胞反应。在子痫前期以及多种妊娠期疾病中均有较高的表达[12]。
本研究通过测定子痫前期和正常孕妇血清及胎盘蜕膜组织中Th17/Treg相关性细胞因子的浓度,进一步分析Th17/Treg细胞轴在子痫前期发病机制中所起的作用。本研究中子痫前期组外周血中IL-10、IL-6、IL-23、IL-2R浓度明显高于正常孕妇组,IL-23、IL-6作为炎性细胞因子,是促进Th17分化及诱导其致病性的关键细胞因子,其浓度升高提示子痫前期组患者外周血中Th17细胞占主导地位,以炎症反应为主。IL-10作为一种抗炎性细胞因子,其在子痫前期组表达上升,与传统观点不符,由于子痫前期患者往往终止孕周较小,而IL-10在外周血中的含量受到孕周影响[13],因此孕周差异可能是导致结果与其他学者结论不一致的原因,需要扩大样本量来验证。子痫前期患者往往在表现出临床症状之前,已出现特殊标志物改变,研究[14]表明IL-2R可在子痫前期患者体内表现出差异表达。本研究中子痫前期患者血清中IL-2R水平明显高于正常孕妇组,作为免疫细胞激活标志物,其含量明显上升,可通过进一步研究子痫前期严重程度与IL-2R表达水平是否存在相关性,来检验其能否作为子痫前期诊断以及分类的重要指标。
QPCR结果提示IL-10 mRNA在子痫前期组胎盘及蜕膜中明显低于正常孕妇组,进一步免疫组化验证结果与QPCR一致。这与传统研究认为IL-10作为Treg相关细胞因子,与Treg细胞数量下降相符。作为一种抗炎性细胞因子,其表达含量在子痫前期中下降,提示Treg细胞被抑制,体内存在抗炎与抑炎反应失衡,可能是导致胎盘功能受损的原因之一。子痫前期患者胎盘及蜕膜组织中IL-23表达差异与血清中不同。IL-23在子痫前期患者胎盘及蜕膜组织中表达情况尚不明确[15],IL-23作为Th17致病性的关键性细胞因子在子痫前期患者胎盘及蜕膜组织中表达升高。而本研究胎盘及蜕膜组织中IL-23 mRNA的表达水平差异无统计学意义,进一步通过免疫组化法检测Th17相关细胞因子IL-23的表达,结果显示与正常孕妇相比,子痫前期组胎盘中IL-23表达含量增多,提示Th17细胞数量增多可能导致IL-23表达升高,而本研究QPCR结果在两组中表达无差异,提示胎盘及蜕膜组织中可能存在其他细胞因子影响IL-23的表达。IL-2R作为T淋巴细胞激活的标志物,其表达含量在胎盘蜕膜中均呈现上升趋势。这种差异表达可以进一步为评估子痫前期发病机制及进展提供思路。而免疫组化结果提示胎盘中子痫前期组表达增多,与QPCR结果一致,而蜕膜中两组差异无统计学意义,可能与蜕膜组织难以处理有关。
综上所述,在子痫前期与正常孕妇的体内,Th17/Treg相关细胞因子存在差异表达,促炎因子IL-23表达含量的改变与子痫前期中Th17细胞活化、炎症过度激活有关。IL-10作为抑炎性细胞因子,与Treg数量下降有直接关系,进而参与子痫前期的发病机制。本研究中IL-2R在子痫前期中表达水平存在明显差异,证明其表达增多参与子痫前期的发病机制,而这种差异表达可将其作为预测并诊断子痫前期重要标志物,为早诊断、早期发现子痫前期提供新思路。

