miR-381-3p在急性髓系白血病中的表达及对白血病细胞增殖和凋亡的影响
张红霞,王 奎,吴广胜
急性髓系白血病(acute myeloid leukemia, AML)是一种累积遗传突变所导致的常见血液系统恶性肿瘤[1],发病率和病死率在所有恶性肿瘤中居第13位和第9位[2]。AML常导致出血、致命感染或器官侵犯[3]。临床上对AML的治疗通过多药联合化疗及造血干细胞移植,但5年总生存率仍低于30%[4]。因此,有必要寻找新的生物标志物用于肿瘤的早期诊断、预后判断和治疗指导。
微小RNA (microRNAs,miRNAs)是一种含有约22个核苷酸的内源性非编码小RNA分子,通过与靶mRNA的3′-非翻译区(3′untranslated region,3′-UTR)结合,调节转录后水平靶基因的表达,翻译抑制或mRNA降解参与基因沉默[5]。在AML的发生发展中,miRNA通过多种方式最终失调miRNA导致疾病的发生[6]。因其高度的保守性、稳定性以及广泛存在于组织和血液中[7],miRNAs作为多种疾病的临床诊断和预后的生物标志物已被广泛研究[8]。该研究旨在探讨血清miR-381在AML中的表达、临床价值及其对细胞生物学行为的调节作用,旨在为治疗AML的临床诊断和预后提供新的靶点。
1 材料与方法
1.1 AML患者的纳入收集2014年6月—2016年10月石河子大学医学院第一附属医院门诊及新住院确诊但未经系统治疗的AML患者90例作为实验组(AML组),男62例,女28例,16~85岁,中位年龄49岁,其中<60岁39例,≥60岁51例;骨髓原始细胞<60%的16例,≥60%的17例;染色体异常57例。所有患者均符合FAB国际分型诊断标准,按照FAB分类:M0型3例,M1型6例,M2型30例,M3型5例,M4型2例,M5型41例,M6型3例。同时,选取健康骨髓捐赠者30例作为对照组(正常组),其中男17例,女13例。本研究通过石河子大学医学院第一附属医院伦理委员会批准(伦理号:A2021-074-01),入组患者均知情同意,临床资料均从门诊和住院病历资料中获取。骨髓穿刺术在无菌条件下进行,留取3~5 ml骨髓液,EDTA抗凝管保存备用。
1.2 miRNA和总RNA的提取按照miRNA和总RNA提取试剂盒的方法提取单个核细胞中miRNA和总RNA,利用Taqman MicroRNA 反转录试剂盒和普通反转录试剂盒反转录得到cDNA,以U6内参按照Taqman miRNA试剂盒和SYBR Green PCR Master Mix试剂盒进行qRT-PCR反应,得到数据用2-ΔΔCt法进行处理,计算miR-381-3p的表达量。
1.3 miR-381的表达与临床指标之间的关系收集纳入研究对象的年龄、性别、白细胞计数、淋巴细胞、FAB分型等,对患者进行长期随访了解无病生存期(disease-free survival,DFS)、总生存期(overall survival,OS),分析miR-381表达的高低与患者预后的关系。
1.4 细胞的培养液氮罐中取出冻存管中AML细胞于水浴锅中融化,后移至离心机中以800 r/min进行离心,沉淀细胞使用10%胎牛血清DMEM培养基重悬后再次离心,后得到沉淀细胞,再次用DMEM培养基重悬细胞后培养。当细胞到达80%以上时进行传代,使用1 ml胰蛋白酶消化细胞,再用DMEM培养基终止消化过程,后离心得到沉淀培养基重悬后按照1 ∶3比例接种至新的培养瓶中;取对数期生长的细胞离心后取沉淀细胞,使用细胞冻存液重悬细胞,放置入细胞冻存盒中置于-80 ℃冰箱中,次日移至液氮罐中进行冻存。
1.5 细胞转染及分组使用Lipofectamine 3000转染miR-381-3p后,分为过表达组miR-381-3p mimics、敲低组miR-381-3p inhibitor以及各自对应的阴性对照。待转染入24 h进行换液处理,48 h后收集细胞用于后续实验,具体序列见表1。

表1 质粒序列
1.6 qRT-PCR按照miRNA提取试剂盒和总RNA提取试剂盒说明书提取RNA后,使用qRT-PCR的方法测定各组中miR-381-3p的表达量。使用Nanodrop测定RNA含量,根据体积与浓度调至一致后逆转录成cDNA,反应条件:37 ℃ 2 min,42 ℃ 60 min,70 ℃ 5 min,4 ℃ 保存。将所得cDNA按照Taqman miRNA kit试剂盒和SYBR Green PCR Master Mix试剂盒进行实时荧光定量PCR,所用PCR引物序列详见表2。扩增条件为:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 30 s,循环次数40次。使用2-ΔΔCt计算公式得出miRNA、mRNA的表达量。

表2 引物序列
1.7 流式细胞术按5×105/ml密度将AML细胞种植在6孔板中,按照1.5项处理后的AML细胞使用预冷的PBS冲洗干净后,加入胰酶消化后收集细胞,以800 r/min离心5 min获得沉淀,使用PBS重悬细胞后分装,分别加入PI和Annexin V-FITC抗体后,设置对照组,避光情况下上机检测。
1.8 CCK-8检测细胞增殖能力取对数期生长的AML细胞按5×105/ml密度种植在24孔板中并设置空白组,培养12 h后,每组设置3个对照组,按照1.5项处理细胞,每孔加入25 μl CCK-8试剂,避光,37 ℃条件中孵育1.5 h,测定酶标仪在450 nm吸光度时的吸光度(absorbance, A)值,计算细胞的增殖率。计算方法:增殖率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
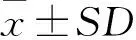
2 结果
2.1 生物信息学分析正常组与AML组中差异性表达的microRNAs通过在GEO数据库中下载关于AML的microRNA表达矩阵,确定数据库为GSE142700,在众多差异性表达的microRNA中寻找到miR-381-3p,可以观察到与正常组比较,AML组中miR-381-3p呈现低表达,见图1A、1B。

图1 生物信息学分析正常组与AML组中差异性表达的microRNAsA:差异性表达microRNAs的热图;B:差异性表达microRNAs的火山图
2.2 患者血清及FAB分期中miR-381-3p的表达与正常组比较,AML组中miR-381表达较低,差异有统计学意义(P<0.01),见图2A。又通过对AML组进行FAB分期,分为4组,与正常组比较,各分期中miR-381的表达均较低,其中M2型的AML患者表达最低,与正常组相比,差异均有统计学意义(P<0.01),见图2B。
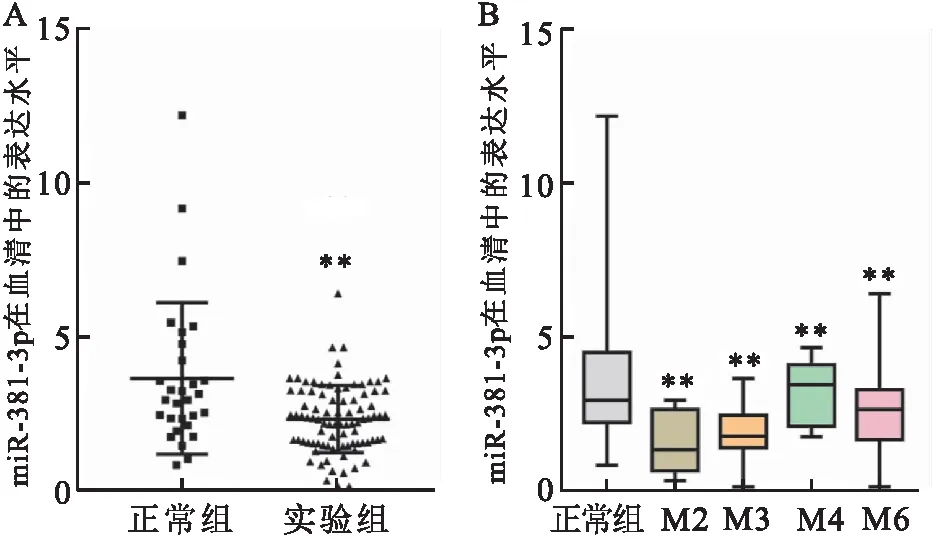
图2 纳入人群血清中在AML患者及FAB分期中miR-381的表达情况
2.3 miR-381-3p的表达与AML患者临床资料之间的关系为了分析 miR-381表达与 AML 临床资料之间的相关性,将整个纳入患者按照对照组中定义为“平均值+2×标准差”的区间值分为两组。miR-381的表达在AML患者中与年龄、性别未见明显差异(P>0.05)。 两组外周白细胞、淋巴细胞、FAB分型比较差异均无统计学意义(P>0.05),见表3。
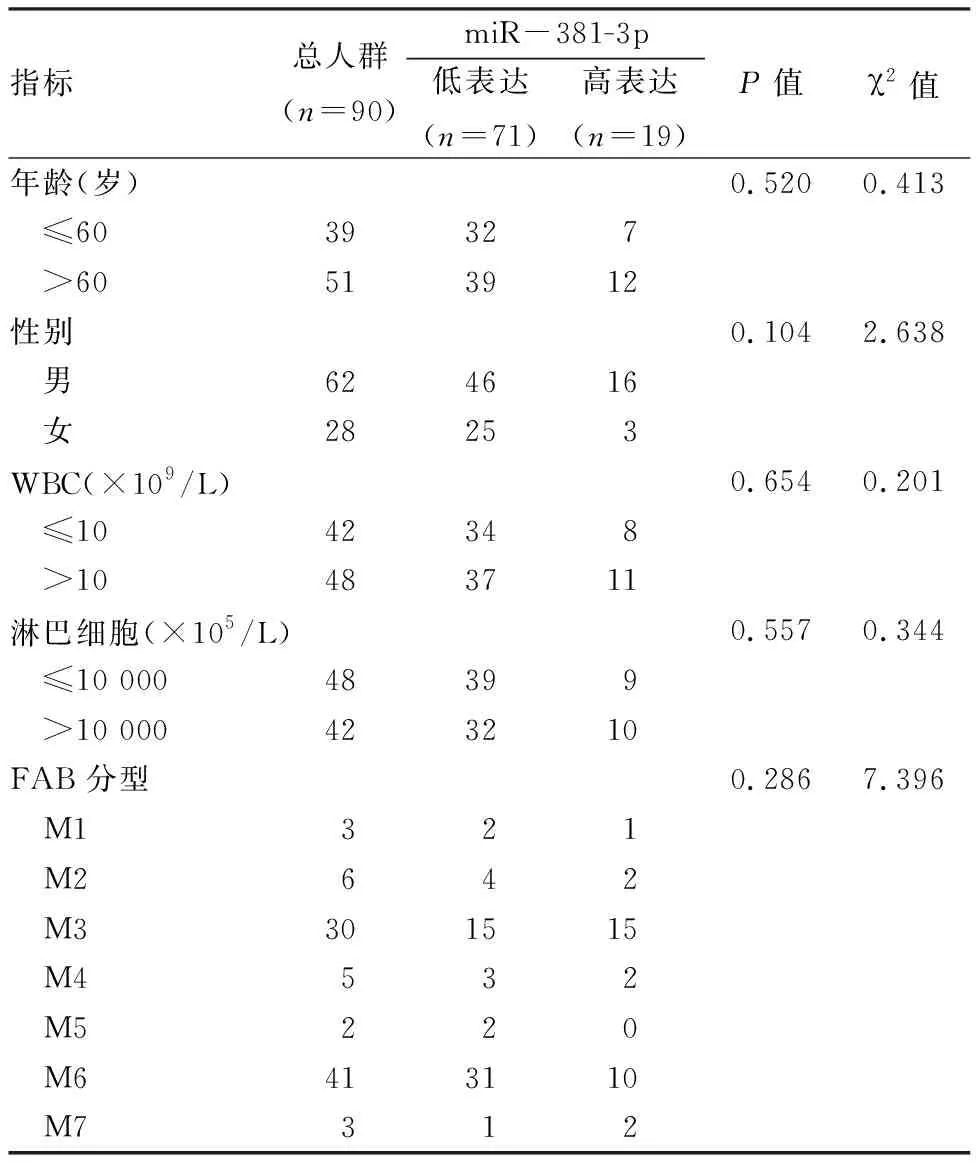
表3 miR-381的表达与患者临床资料之间的关系
2.4 miR-381表达与AML临床结果的相关性在90例患者中获得了OS、DFS的生存数据。 在AML患者中,与低表达miR-381的患者相比,miR-381高表达的患者具有较长的OS且两组差异有统计学意义(P<0.05),见图3A。 此外,按照此分类计算PFS时间内与miR-381的表达存在的关系,结果显示与低表达miR-381的患者相比,miR-381高表达的患者具有较长的DFS且两组差异有统计学意义(P<0.05),见图3B。
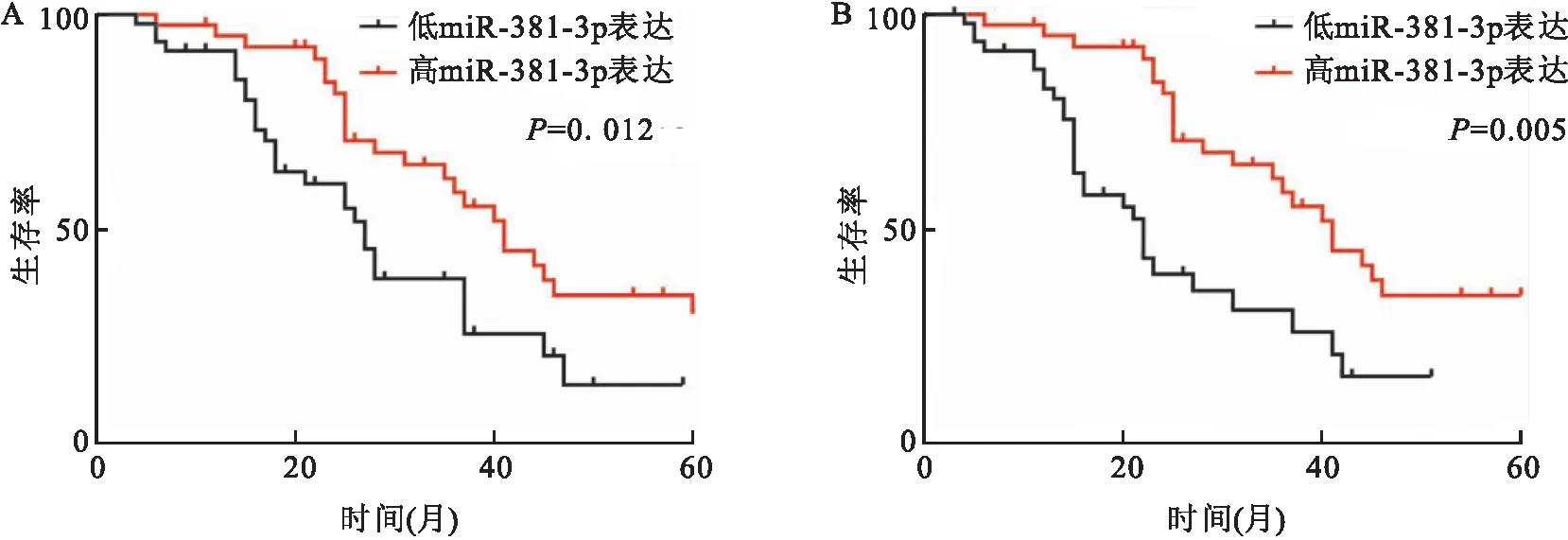
图3 AML患者长期OS与PFSA:AML患者60个月的OS;B:AML患者60个月的PFS
2.5 AML细胞和转染后miR-381的表达与HS5组相比较,AML细胞系HL-60和KG-1a中miR-381均低表达,差异有统计学意义(P<0.05)(图4A)。在HL-60细胞系中转染48 h后检测胞内miR-381的表达量,发现与control组比较,miR-381 mimics组表达升高,miR-381 inhibitor组表达下降(P<0.05)(图4B)。而mimics NC组与inhibitor NC组比较,差异无统计学意义(P>0.05)。在KG-1a细胞系中检测miR-381的表达,结果与上述细胞系结果一致,差异有统计学意义(P<0.05)(图4C)。
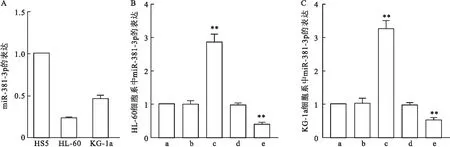
图4 不同细胞系及不同处理组中miR-381表达情况
2.6 过表达miR-381后促进K562细胞凋亡如图5所示,AML细胞系HL-60通过质粒转染的方法将miR-381过表达后,与control组比较,miR-381mimics组凋亡增加,差异有统计学意义(P<0.05),miR-381 inhibitor组的凋亡比例降低,差异有统计学意义(P<0.01)。在KG-1a细胞系中发现高表达miR-381会促进AML细胞的凋亡,而使miR-381表达降低,会抑制AML细胞的凋亡。
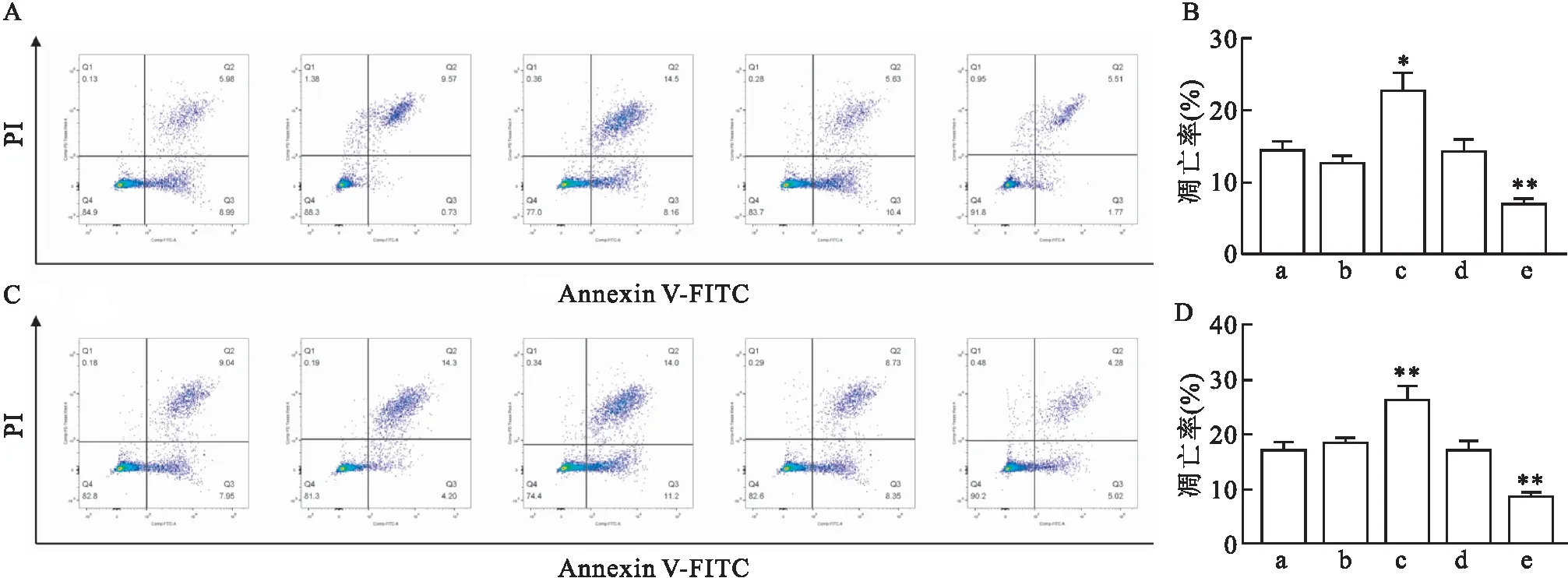
图5 不同处理组AML细胞凋亡情况
2.7 过表达miR-381后抑制K562细胞增殖图6显示,在AML细胞系HL-60中转染质粒48 h,与miR-381 mimics组比较,miR-381 inhibitor组、mimics NC组、inhibitor NC组、control组均可促进HL-60细胞增殖(P<0.05);而通过过表达或敲低miR-381后,与control组相比较,miR-381 mimics组增殖减弱,miR-381 inhibitor组细胞增殖明显,差异有统计学意义(P<0.01)。
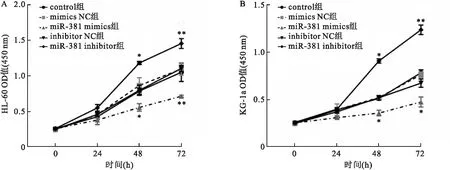
图6 不同处理组K562细胞增殖情况A:HL-60细胞系不同处理组增殖情况;B:KG-1a细胞系不同处理组凋亡情况;与control组比较:*P<0.05,**P<0.01
3 讨论
在大数据的背景下,microRNA的研究作用逐渐被挖掘,microRNA在肿瘤中的研究也逐渐增多[9-10],因此本研究通过生信分析寻找差异性表达的miRNAs,在此基础上得到miR-381-3p在AML中低表达,与临床资料分析相结合,得出miR-381的表达影响AML患者的预后,并通过细胞学实验发现miR-381可以抑制AML细胞的增殖并促进其凋亡。表明miR-381可以控制AML细胞的活性和增殖,为治疗白血病提供新依据。
miR-381-3p在许多肿瘤中都呈现出低表达,大量研究显示miRNA-381在各种类型的癌症中具有肿瘤抑制作用,包括胰腺癌[11]、结直肠癌[12]、肝细胞癌[13]、肺癌[14]、前列腺癌[15]和乳腺癌[16]。但在上皮内肉瘤中发现miR-381-3p呈高表达[17],与本研究在AML中结论相反,其原因可能是不同类型的肿瘤,组织来源不同,作用机制各异。为了进一步验证miR-381-3p在AML中的表达,本研究显示AML患者miR-381-3p的表达显著低于正常对照组人群,且通过对AML分类也得到了相同的结果,无论哪一分类的AML患者miR-381-3p的表达均低于正常对照组。该结果符合前期生物信息学分析的结果,均证明miR-381-3p在AML患者中低表达,提示miR-381-3p在临床中具有较高的诊断价值。为了进一步探讨miR-381-3p的表达在AML患者中表达的意义,本研究发现miR-381-3p的表达与患者的年龄、性别以及外周血白细胞、淋巴细胞之间均无关,这与Li et al[18]在胃癌中的研究结果相一致。与本研究结果相一致,出现这些阴性结果的原因可能是以上因素影响效果很低,较小的影响因素结果并不会引起miR-381-3p的变化,因此可以更好地消除这些混杂因素来测定miR-381-3p对AML的影响。为进一步验证miR-381-3p与AML患者预后的关系,本研究随访患者60个月发现miR-381-3p的表达与患者的OS、PFS呈现正相关,miR-381-3p的高表达与AML患者OS和DFS延长有关,进一步证明miR-381-3p的低表达与AML的不良预后具有相关性。 这与Huang et al[19]发现在甲状腺癌中低表达miR-381患者具有较差的预后结果相一致。以上研究结果表明miR-381-3p的表达与患者的预后密切相关,但具体机制需进一步阐明。
为了进一步验证miR-381-3p对AML的影响,通过体外培养AML细胞测定过表达或敲低miR-381-3p对细胞增殖和凋亡的影响。发现与control组比较,敲低miR-381-3p后可抑制AML细胞凋亡,促进增殖,而过表达miR-381-3p可以促进AML细胞的凋亡,抑制增殖。以上结果与Qiao et al[11]在胰腺癌中发现miR-381可通过调节PI3K/AKT通路抑制细胞的增殖、迁移和侵袭的结果相一致,前期研究Fang et al[20]也发现miR-381靶向CUL4B从而抑制胃癌细胞的增殖和侵袭, Kong et al[21]也发现miR-381靶向LRP6抑制甲状腺乳头状癌细胞的增殖、迁移和侵袭,本研究结果均与之相一致。对于miR-381在AML过程中的确切作用及机制需进一步阐明。
综上所述,miR-381-3p在多种肿瘤中发挥了重要作用,本研究主要观察其在AML中的表达、预后及对AML细胞增殖和凋亡的影响,这为后期研究miRNA 在AML的作用机制提供思路,为靶向治疗AML提供新方向。

