紫草酸甲酯抑制海马Nox4介导的铁死亡改善小鼠术后学习记忆障碍
刘铁龙,亓文强,江洪洋,王瑞雪,代志刚,殷姜文
学习记忆障碍是麻醉和手术后常发生的并发症,严重影响患者生活质量并增加医疗费用及社会负担[1-3]。研究[4-5]表明,学习记忆障碍潜在的发生机制是麻醉和手术引起的神经炎症和氧化应激。紫草酸甲酯(paederosidic acid methyl ester,PAME)是从鸡矢藤中提取的环烯醚萜类单体,具有抗炎、抗氧化应激和镇痛等作用[6-7]。因此,PAME可能具有改善学习记忆障碍的潜在药理作用。研究表明,NADPH氧化酶4(NADPH oxidase 4,Nox4)介导的氧化应激水平增加引起铁死亡[8],且海马区铁死亡会导致患有脓毒症相关性脑病的大鼠发生学习记忆障碍[9]。PAME具有抗氧化应激作用,其对Nox4介导的氧化应激水平增加引起的铁死亡及其导致的学习记忆障碍是否产生抑制作用尚无报道。因此,该研究建立剖腹探查术小鼠动物模型,使用PAME进行干预治疗,观察其对术后小鼠学习记忆的作用及其与Nox4介导的铁死亡途径的关系。
1 材料与方法
1.1 主要试剂和仪器PAME(货号:HY-N2433,美国Merck公司);异氟烷(货号:R510-22,深圳市瑞沃德生命科技有限公司);Nox4过表达AAV病毒(上海汉恒生物科技有限公司);Nox4抗体(货号:ab133303)、山羊抗兔TRITC荧光二抗(货号:ab8135)(英国Abcam公司);长链脂酰辅酶A合成酶4(long chain acyl CoA synthetase 4,ACSL4)抗体(货号:A04372-2)、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)抗体(货号:BM5231)(武汉博士德生物工程有限公司);GAPDH(货号:TA-08)、山羊抗兔IgG二抗(货号:ZB-2301)、山羊抗小鼠 IgG二抗(货号:ZB-2305)(北京中杉金桥生物技术有限公司);组织铁检测试剂盒(货号:A039-2-1)、活性氧(reactive oxygen species,ROS)检测试剂盒(货号:E004-1-1)(南京建成生物工程研究所)。
小动物麻醉机(型号:R500,深圳市瑞沃德生命科技有限公司);低温高速离心机(型号:1-14k,德国Sigma公司);激光共聚焦扫描显微镜(型号:LSM710,德国Carl Zeiss公司);Labmaze动物行为学分析系统(型号:V3.0)、小鼠脑立体定位仪(型号:ZS-FD,北京众实迪创科技发展有限责任公司);电泳槽(型号:DYCZ-21,北京六一生物科技有限公司);精密微量注射泵(型号:QSI,美国Stoelting公司);化学发光成像仪(型号:Tanon-2500,上海天能生命科学有限公司)。
1.2 实验动物选择12~14月龄C57BL/6J雄性小鼠108只,体质量30 ~35 g,购于济南朋悦实验动物有限公司。实验小鼠饲养在恒温动物房,温度(25±2)℃,湿度(55±10)%,12 h光照/黑暗周期,小鼠自由进食和饮水。本研究经石河子大学医学院第一附属医院伦理审查委员会批准(批准号:A2021-074-01)。
1.3 实验分组采用随机数字法将C57BL/6J雄性小鼠随机分为6组(n=18):① Sham组:小鼠麻醉后自然苏醒,未做特殊处理。② 手术组:将小鼠用2%异氟烷吸入麻醉,常规消毒后在腹中线上剪开约1 cm的垂直切口,然后依次探查肠、肝、脾、肾等器官,探查完毕并确认腹腔无出血,用4-0无菌缝线逐层缝合伤口,术毕置于保温箱中苏醒。③ 手术+PAME组(PAME组):在术后第1天开始行20 mg/kg PAME灌胃,连续7 d。④ 手术+Nox4腺相关病毒过表达组(Nox4过表达组):Nox4过表达腺相关病毒于术前28 d通过脑立体定位仪注射到小鼠海马脑区,28 d后常规进行手术。⑤ 手术+Nox4腺相关病毒空载组(AAV空载组):术前28 d通过脑立体定位仪将AAV空载病毒注射到小鼠海马脑区,28 d后常规进行手术。⑥ 手术+PAME+Nox4过表达组(PN组):手术前28 d将Nox4过表达腺相关病毒通过脑立体定位仪注射到小鼠海马脑区,手术后给予20 mg/kg PAME灌胃处理,连续7 d。PAME剂量及灌胃时间根据本课题组预实验和Chen et al[10]研究方案确定。
1.4 小鼠海马AAVs立体定位注射小鼠面罩吸入异氟烷麻醉,通过耳杆和齿栓将小鼠头部固定于脑立体定位仪上,用颅骨钻在小鼠颅骨表面钻孔,穿破颅骨后,按小鼠海马坐标(前囟向后2.5 mm,向左/右旁开2.0 mm,深度1.8 mm),将尖端带有玻璃微电极的微量注射针以0.02 μl/min的速度注入AAVs病毒,注射时间25 min,总体积0.5 μl,注射完毕针尖停留10 min,缓慢移除针尖,缝合头皮,麻醉苏醒后放入笼中单独饲养。
1.5 Morris水迷宫实验调节动物行为学分析系统将圆形水池分为4个象限。池内加入适量的水并保持水温在23~25 ℃,将一个圆柱状平台放置于第二象限正中。实验分为定位航行实验和空间探索实验。定位航行实验:从术前第6天起至术前第2天,共测量5次,每天在固定时间按顺时针方向从4个不同象限作为入水点,记录小鼠寻找平台的时间即逃逸潜伏期,如果在90 s内未找到平台,则将小鼠引上平台并保持15 s,此时逃逸潜伏期记录为90 s;空间探索实验:术前1 d撤除平台,将小鼠在第四象限面向池壁放入水中,行为学轨迹分析仪记录小鼠在90 s内穿越平台位置的次数以及在第二象限探索的时间。用同样的方法在术后第1、3、7天内重复空间探索实验[11]。
1.6 条件性恐惧实验按照已报道的实验流程[12],在术前第2天,将各组小鼠放入条件性恐惧刺激箱内,适应2 min,同时给予声音刺激(70 dB)及足底电刺激(0.7 A),间隔1 min后重复以上刺激,连续20次。结束后小鼠在刺激箱内停留2 min后再放回鼠笼。在术前1 d、术后第1、3、7天将各组小鼠再次放入条件性恐惧刺激箱内,适应2 min,仅给予10 s声音刺激(70 dB),观察并记录小鼠僵直时间百分比,重复上述步骤5次,评价小鼠认知功能。
1.7 ROS、海马组织铁含量检测在术后第7天,每组取6只小鼠海马组织匀浆,按照相应试剂盒说明书采用分光光度法检测海马组织ROS水平和铁含量。
1.8 免疫荧光染色术后第7天,每组各6只小鼠经心脏灌注后取脑,脱水后制备冰冻脑切片,经5% BSA 封闭1 h后滴加Nox4一抗(1 ∶200),4 ℃孵育过夜,PBS洗涤后滴加TRITC标记的荧光二抗(1 ∶500),室温避光孵育2 h,DAPI液染细胞核 3 min,封片后激光共聚焦显微镜观察,每张切片在200倍镜下随机选3个不同视野进行采图。用Image J软件进行荧光强度测定。
1.9 Western blot术后第7天,每组取6只小鼠快速断头取脑,剥离海马组织,组织匀浆、RIPA裂解提取蛋白,并用BCA法测定蛋白浓度。经上样、电泳、转膜、封闭后,选择GAPDH(1 ∶1 000)、目标蛋白Nox4(1 ∶1 500)以及铁死亡标志性蛋白ACSL4(1 ∶1 000)和 GPX4(1 ∶1 000)一抗 4 ℃孵育过夜,二抗山羊抗兔(1 ∶2 000)和山羊抗小鼠(1 ∶2 000)室温孵育 2 h后滴加化学发光试剂曝光,Image J软件测定条带灰度值,并以 GAPDH为参照,统计Nox4、ACSL4和 GPX4相对表达量。
2 结果
2.1 PAME对小鼠术后学习记忆的影响
2.1.1各组术前行为学差异无统计学意义 各组术前定位航行实验结果差异无统计学意义(F=0.348,P>0.05),但随着训练天数的增加,各组找到平台所需平均时间缩短;术前空间探索实验各组小鼠在90 s内穿越平台位置的次数以及在第二象限探索的时间差异均无统计学意义(F=0.228,P>0.05;F=0.397,P>0.05)。术前条件性恐惧实验各组小鼠僵直时间百分比差异也无统计学意义(F=0.365,P>0.05)。见图 1。
2.1.2PAME增加小鼠术后穿越平台次数、延长空间探索时间 空间探索实验中记录的各组小鼠的游泳轨迹如图 2所示。与Sham组相比,手术组小鼠在术后第1、3、7天穿越平台次数减少(P<0.001),在第二象限探索时间更短(P<0.001)。但在给予PAME治疗(即PAME组)的小鼠穿越平台次数和第二象限探索时间比手术组增加(P<0.001,P<0.05)。与手术组相比,Nox4过表达组的小鼠穿越平台次数更少、第二象限探索时间更短(P<0.05),但在给予PAME治疗后可被逆转(P<0.001)。AAV空载组与手术组相比差异无统计学意义(P>0.05),见表1、2。
表1 PAME对小鼠术后穿越平台次数的影响(次,
图1 术前各组行为学比较
图2 水迷宫实验小鼠活动轨迹A:Sham组;B:手术组;C:PAME组;D:Nox4过表达组;E:AAV空载组;F:PN组
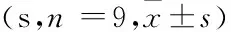
表2 PAME对小鼠术后目标象限停留时间的影响
2.1.3PAME增加小鼠术后条件性恐惧实验僵直时间百分比 与Sham组相比,手术组在术后第1、3、7天小鼠僵直时间百分比减少(P<0.001),在给予PAME治疗后,PAME组的小鼠僵直时间百分比增加(P<0.05)。与手术组相比,Nox4过表达组的小鼠僵直时间百分比减少(P<0.05),但在给予PAME治疗后小鼠僵直时间百分比增加(P<0.001)。AAV空载组与手术组相比差异无统计学意义(P>0.05),见表3。
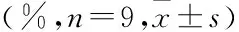
表3 PAME对小鼠术后僵直时间百分比的影响
2.2 PAME抑制小鼠术后海马组织Nox4介导的铁死亡
2.2.1PAME降低小鼠术后海马组织ROS、铁的含量 小鼠海马组织ROS和铁含量检测结果显示,手术组小鼠海马组织ROS和铁含量高于Sham组(F=40.94,P<0.001;F=36.15,P<0.001),PAME灌胃治疗后小鼠海马组织ROS和铁含量出现降低(P<0.001)。给予Nox4过表达病毒注射的小鼠海马组织ROS和铁含量比单纯手术组高(P<0.05),在给予PAME治疗后,Nox4过表达组的ROS和铁含量下降(P<0.001)。AAV空载组与手术组相比,小鼠海马区ROS和铁含量差异无统计学意义(P>0.05),见图3。
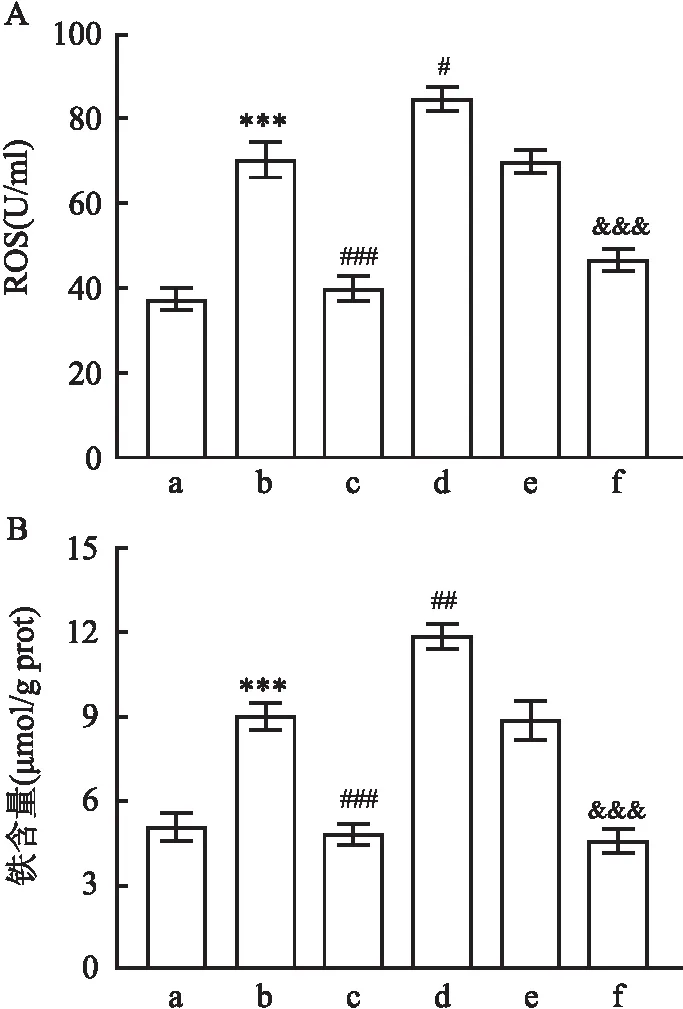
图3 各组ROS和铁含量变化
2.2.2PAME降低小鼠术后海马CA1区Nox4的表达 免疫荧光实验结果显示,Nox4在小鼠海马CA1区锥体神经元胞质表达,与Sham组相比,手术组小鼠海马CA1区Nox4的荧光强度增强(F=175.3,P<0.001),在给予PAME治疗后荧光强度降低(P<0.001)。Nox4过表达组比手术组Nox4的荧光强度增加(P<0.01),在给予PAME后出现逆转(P<0.001)。AAV空载组与手术组相比小鼠海马CA1区Nox4的荧光强度差异无统计学意义(P>0.05),见图4。
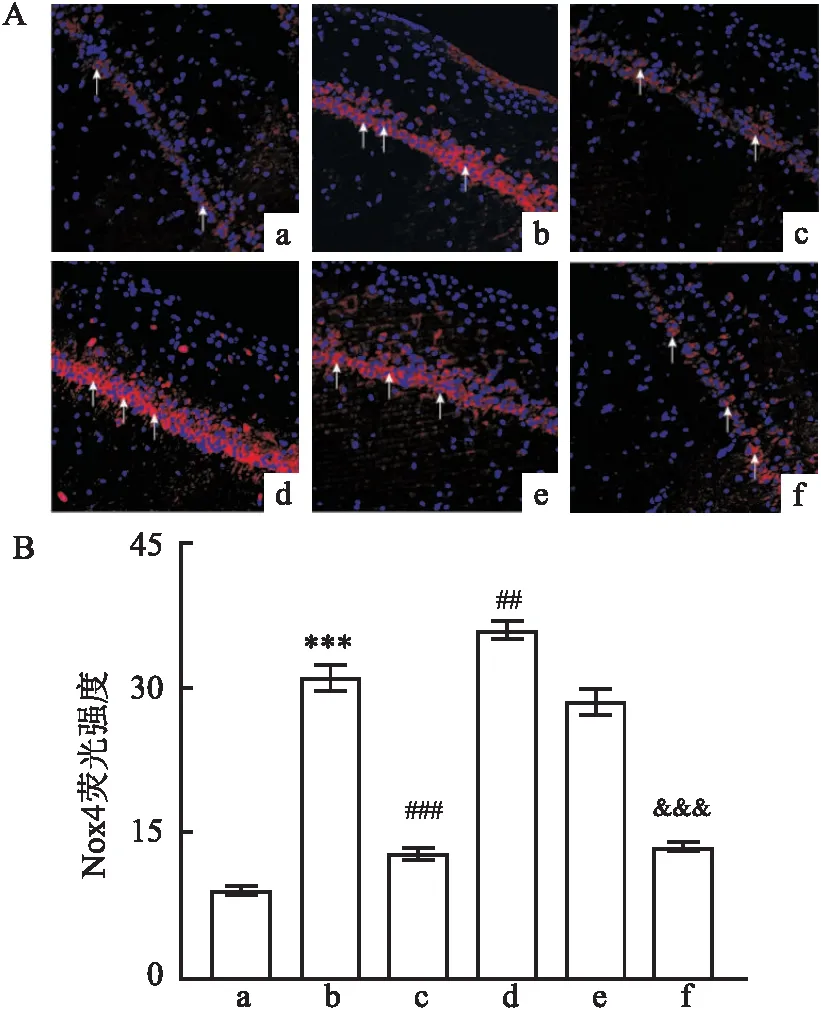
图4 免疫荧光实验检测各组Nox4的表达变化
2.2.3PAME对小鼠术后海马组织Nox4及铁死亡标志性蛋白(ACSL4和GPX4)表达的影响 Western blot实验结果显示,与Sham组相比,手术组小鼠海马组织Nox4表达增加(F=103,P<0.001),铁死亡标志性蛋白ACSL4的表达增加(F=94.44,P<0.001),GPX4表达水平降低(F=73.9,P<0.001)。在给予PAME治疗后,手术组小鼠海马Nox4蛋白、ACSL4的表达均降低(P<0.001),GPX4表达水平增加(P<0.001)。同时,与手术组相比,Nox4过表达组小鼠海马Nox4、ACSL4的表达均显著增加(P<0.001),GPX4表达降低(P<0.001),给予PAME治疗后结果出现逆转(P<0.001)。AAV空载组与手术组相比,小鼠海马组织Nox4、ACSL4和GPX4的表达差异无统计学意义(P>0.05),见图5。
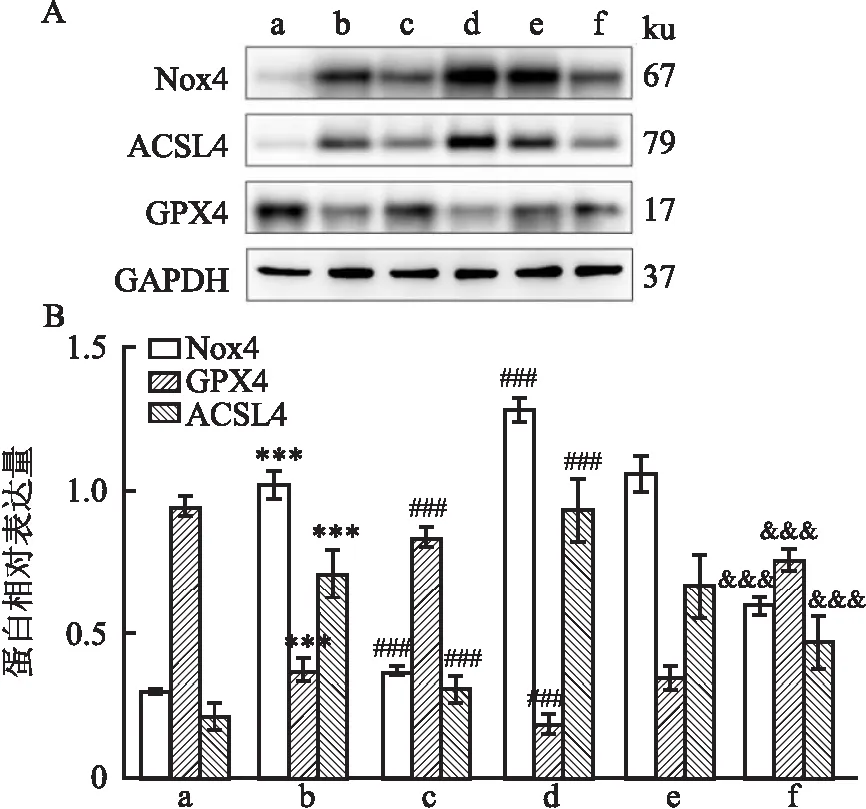
图5 Western blot实验检测Nox4、ACSL4、GPX4的表达变化
3 讨论
学习记忆障碍作为围术期常见的并发症,常导致术后恢复延迟,在“加速康复外科(enhanced recovery after surgery,ERAS)”理念指导下,探讨学习记忆功能障碍的产生机制和改善围术期学习记忆功能受损值得关注并研究。研究[4-7]证实学习记忆能力障碍与神经炎症和氧化应激有关,而我国传统中药鸡矢藤具有抗炎和抗氧化应激作用,因此其可能具有改善学习记忆障碍的作用。本研究选用鸡矢藤的主要活性物质PAME治疗术后学习记忆能力降低的小鼠,发现术后小鼠的认知行为学(Morris水迷宫实验和条件性恐惧实验)得到了明显改善,这一现象证实了PAME能够改善小鼠术后学习记忆功能。
本研究继续探讨PAME改善术后小鼠学习记忆功能的机制。研究[8-9]表明,铁死亡可引起学习记忆功能障碍,Nox4介导的氧化应激是导致铁死亡的主要原因。PAME具有抗氧化应激作用,其可能会通过抑制Nox4介导的氧化应激减轻铁死亡,改善小鼠术后学习记忆功能障碍。本研究结果显示,手术组小鼠术后海马组织ROS、铁含量明显增加,Nox4表达上调,铁死亡标志性蛋白ACSL4表达上调,GPX4表达下调[13]。这些结果与相关研究[14]中铁死亡的结果一致,表明术后小鼠学习记忆能力降低的发生与海马组织Nox4介导的氧化应激和铁死亡相关。给予PAME治疗后,发现术后小鼠海马组织ROS和铁含量减少,且海马Nox4表达明显受到抑制,同时ACSL4生成减少而GPX4表达增多。这一现象初步证实了PAME可能通过Nox4抑制了铁死亡途径,改善了小鼠术后学习记忆功能。
为了进一步证实PAME的作用靶点是Nox4,本研究选用了Nox4过表达腺相关病毒这一工具,实现了小鼠海马区Nox4的过表达。而Nox4过表达会加重氧化应激和铁死亡,与铁死亡相关的ROS、铁含量及ACSL4会明显增加,GPX4明显降低[15]。实验结果表明海马Nox4过表达后小鼠术后学习记忆损害加重,ROS、铁含量、ACSL4进一步增加,GPX4显著降低,提示海马Nox4介导的铁死亡可能是小鼠术后发生学习记忆障碍的重要机制。此外,海马Nox4过表达后的小鼠给予PAME治疗,学习记忆功能改善作用、ROS及铁含量的抑制作用均受到限制,且Nox4、ACSL4表达再次出现增加,GPX4下调,这一现象证明PAME是通过抑制海马Nox4从而改变下游铁死亡相关蛋白,抑制了海马氧化应激和铁死亡,进而改善了术后学习记忆功能。

