暖巢煲调控线粒体功能改善早发性卵巢功能不全的实验研究
周虹 李兰 刘文娥 陈镇 邓桂明 何阳 肖小芹


〔摘要〕 目的 探討暖巢煲调控卵巢线粒体功能治疗化疗性早发性卵巢功能不全(premature ovarian insufficiency, POI)损伤小鼠,为其临床应用提供科学依据。方法 从40只8周龄雌性C57BL/6小鼠中抽取8只为空白组,其余构建POI模型。将成功建模的32只小鼠随机分为模型组、暖巢煲低剂量组、暖巢煲中剂量组、暖巢煲高剂量组,每组8只。模型组、空白组予0.01 mL/g生理盐水灌胃。观察小鼠的一般状况、体质量和动情周期变化,给药3周后,称取各组小鼠卵巢湿质量,计算卵巢指数。ELISA法检测各组小鼠血清抗米勒管激素(anti-Müllerian hormone, AMH)水平,HE染色观察卵巢组织形态学变化,透射电镜观察线粒体的形态和结构,Western blot检测视神经萎缩蛋白1(optic atrophy 1, OPA1)和PTEN诱导假定激酶1(PTEN-induced putative kinase 1, PINK1)的表达水平。结果 与空白组比较,模型组进食量减少、毛色枯燥;体质量增长率下降(P<0.05);卵巢指数明显下降(P<0.01);动情周期紊乱;血清AMH下降(P<0.05);各级生长卵泡减少、闭锁卵泡明显增加;线粒体结构破坏严重、空洞化明显;OPA1及PINK1蛋白表达水平明显下调(P<0.01)。与模型组比较,暖巢煲高、中、低剂量组体质量增长率上升(P<0.05);暖巢煲中、低剂量组卵巢指数增加;动情周期逐渐规律;暖巢煲中、高剂量组血清AMH上升(P<0.05),小鼠的卵母细胞线粒体结构明显改善,OPA1及PINK1蛋白表达明显上调(P<0.01)。结论 线粒体功能障碍可能是小鼠卵巢功能不全的机制之一,而暖巢煲能够调节卵巢线粒体功能,改善早发性卵巢不全,可能与其通过促进线粒体自我更新的动力过程有关。
〔关键词〕 早发性卵巢功能不全;暖巢煲;线粒体;视神经萎缩蛋白1;PTEN诱导假定激酶1;抗米勒管激素
〔中图分类号〕R271.9 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.06.008
〔Abstract〕 Objective To discuss the clinical efficacy of Ovary-Warming Pot (OWP) on premature ovarian insufficiency (POI) mice by regulating ovarian mitochondrial function and to provide a scientific basis for its clinical application. Methods Eight of 40 8-week-old female C57BL/6 were selected as blank group, and the rest were used to establish the POI models. Then 32 successfully modeled mice were randomly divided into model group, low-, medium- and high-dose OWP groups, with 8 mice in each group. The model group and blank group were given 0.01mL/g normal saline by gastric lavage. The general condition, body weight, and estrous cycle of mice were observed. After 3 weeks of administration, the wet ovarian weight of mice in each group was weighed to calculate the ovarian index. The serum anti-Müllerian hormone (AMH) level was determined by enzyme-linked immunosorbent assay (ELISA), the morphological changes of ovarian tissue were observed by hematoxylin-eosin (HE) staining, and the morphology and structure of mitochondria were observed by transmission electron microscopy. Western blot was used to determine the expression levels of optic atrophy 1 (OPA1) and PTEN-induced protein kinase 1 (PINK1). Results Compared with blank group, the mice in model group had less food intake and dull hair color; their growth rate of body mass was lower (P<0.05); the ovarian index was significantly lower (P<0.01); the estrous cycle was disordered; the serum AMH was lower (P<0.05); the growth follicles at all levels decreased, while atresia follicles increased significantly; the mitochondrial structure was seriously damaged, with obvious cavitation; the expression levels of OPA1 and PINK1 were significantly down-regulated (P<0.01). Compared with model group, the growth rates of body mass in high-, medium- and low-dose OWP groups were higher (P<0.05); the ovarian indexes in medium- and low- dose OWP groups were higher, and the estrus cycle became regular gradually; the serum AMH in medium- and high- dose OWP groups was significantly higher (P<0.05), the mitochondrial structure of mice oocytes was significantly improved, and the OPA1 and PINK1 protein expressions were significantly up-regulated (P<0.01). Conclusion Mitochondrial dysfunction may be one of the mechanisms leading to ovarian insufficiency in mice. However, OWP can regulate mitochondrial function and improve premature ovarian insufficiency, which may be related to the dynamic process of promoting mitochondrial self-renewal.
〔Keywords〕 premature ovarian insufficiency; Ovary-Warming Pot; mitochondria; optic atrophy 1; PTEN-induced putative kinase 1; anti-Müllerian hormone
早发性卵巢功能不全(premature ovarian insufficiency, POI)的定义是40岁之前与闭经相关的卵巢卵泡丢失或功能障碍,其主要的症状是继发性的月经紊乱、闭经及生育能力下降[1],伴有潮热、睡眠障碍。卵巢衰老的特征是卵巢卵泡储备的定量和定性改变[2]。线粒体是母系遗传的双膜细胞器,作为细胞的能量工厂,在卵母细胞中大量存在[3],线粒体为卵泡成熟,受精和胚胎发育期间的转录和翻译提供能量[4],线粒体功能异常与卵巢衰老密切相关[5],线粒体动力学紊乱(如线粒体融合、线粒体自噬)也会影响卵泡细胞衰老[6]。
尤昭玲教授(以下尊称尤老师)是国家第四批名老中医药学术经验继承指导老师,从事中医、中西医结合妇科教学、科研、临床工作40余年。在卵巢功能异常、月经不调、不孕等疾病的诊治上推陈出新,创见独特,有丰富的临证经验。POI可归属于中医学“闭经”“血枯”“不孕”等范畴。结合多年的临床经验,尤老师认为卵巢低反应病因应从脾-肾考虑,脾肾亏虚是导致POI的主要病机,临证尤其重视调理脾肾,滋肾之阴阳,益脾之精血,以养泡育泡。独创“暖巢煲”以暖巢助卵、调泡养泡。本研究采用环磷酰胺构建POI小鼠模型,观察暖巢煲对模型小鼠卵巢线粒体功能的影响,为其治疗机制提供科学依据。
1 材料
1.1 动物
8周龄SPF级雌性C57BL/6J小鼠40只,体质量(20±2) g,由湖南中医药大学动物实验中心提供,许可证号:SCXK(湘)2019-0004。分笼饲养于湖南中医药大学动物实验中心SPF级屏障环境中,室温(21.0±2.0) ℃,相对湿度50.0%±10.0%,自由饮食进水。本实验经湖南中医药大学动物伦理委员会批准,伦理审查编号:LLBH-202111180001。
1.2 药物与试剂
暖巢煲由铁皮石斛、黄精、黄芪、巴戟天组成,均由湖南中医药大学第一附属医院药剂科鉴定并提供。
环磷酰胺注射液粉末(上海百特医疗用品贸易有限公司,批号:PHR1404);瑞氏染液(北京雷根生物科技有限公司,批号:DM0004);抗米勒管激素(anti-Müllerian hormone, AMH)ELISA试剂盒(厦门仑昌硕生物科技有限公司,批号:YD20514);视神经萎缩蛋白1(optic atrophy 1, OPA1)抗体、PTEN诱导假定激酶1(PTEN-induced putative kinase 1, PINK1)抗体均购自江苏阿尔法生物科技有限公司(批号分别为A19024、A19860);β-actin(美国Proteintech公司,批号:60004-1-Ig)。
1.3 主要仪器
正置荧光显微镜(德国蔡司公司,型号:Scope.A1);数字玻片扫描系统(匈牙利3DHISTECH公司,型号:Pannoramic MIDI);酶标分析仪(深圳市汇松科技发展有限公司,型号:MB-5390);透射电镜(上海日立高新技术国际贸易有限公司,型号:HT-7800)。
2 方法
2.1 造模
将40只C57BL/6J小鼠分笼适应性喂养7 d,每天上午9:00行阴道脱落细胞涂片实验,参考预实验及文献方法建立POI小鼠模型[7],环磷酰胺每天100 mg/kg注射1次。模型组造模后第1天开始连续24 d进行阴道脱落细胞涂片,筛选动情周期延长、紊乱、停滞的小鼠[8]。
2.2 动物分组及给药
采用随机数字表法将小鼠分为空白组8只和模型组32只,通过观察动情周期,筛查剔除空白组动情周期延长的小鼠1只,空白组剩7只,其余32只小鼠造模,按随机数字表分为模型组,暖巢煲低剂量组、暖巢煲中剂量组、暖巢煲高剂量组,每组8只。造模成功后第2天开始灌胃,暖巢煲生药量9.36、18.72、28.08 g/kg,分别为成人临床剂量的2、4、6倍,每天给药一次,空白组和模型组均给予0.2 mL生理盐水,连续给药21 d。
2.3 取材
末次给药后禁食不禁水12 h,然后于腹腔注射戊巴比妥,待其处于完全麻醉状态后,眼眶取血,离心后分离的血清,置于-80 ℃冰箱内保存备用。取血后颈椎脱臼法处死小鼠,用组织剪和弯镊分离双侧卵巢,剥离干净后置于电子天平上称量,左侧卵巢放入2.5%戊二醛固定后制作透射电镜切片,右侧卵巢组织置于4%多聚甲醛溶液中固定备用切片。
2.4 檢测指标及方法
2.4.1 小鼠一般状况、体质量增长率、卵巢指数 观察小鼠一般状况(形态、活动、毛色)、根据体质量计算体质量增长率、两侧卵巢湿质量,计算卵巢指数。小鼠体质量增长率=(第n天小鼠体质量-第1天小鼠体质量)/第1天小鼠体质量×100%。卵巢指数=卵巢湿质量(mg)/小鼠体质量(g)[9]。
2.4.2 动情周期 每天早上9:00将小鼠绑定并暴露阴道口,用10 μL移液器吸取生理盐水冲洗阴道,取冲洗物制作涂片,染色、固定后冲片、干燥,荧光显微镜及玻片扫描机观察摄影。观察各种细胞形态以判断动情周期变化。动情前期以有核上皮细胞和部分白细胞为主;动情期有大量扁平无核上皮细胞分布,此期阴道有明显乳白色分泌物,质地黏稠;动情后期有3种细胞:核上皮细胞、角质化无核上皮细胞及白细胞,间情期为少量白细胞为主[10]。
2.4.3 ELISA法检测小鼠血清AMH激素水平变化 全血室温静置3 h,置于4 ℃,5000 r/min(半径6 cm)离心10 min,将收集到的血清标记好储存于-80 ℃冰箱内,按ELISA试剂盒说明书操作,处理完成后在450 nm波长下的酶标仪测定吸光度,根据标准曲线计算各样本指标含量。
2.4.4 HE染色检测卵巢组织病理情况 取出将4%多聚甲醛液的卵巢,梯度乙醇脱水,包埋,制片,常规HE染色,采用蔡司荧光倒置显微成像仪和数字玻片扫描系统采集图像观察卵巢组织。
2.4.5 透射电镜观察卵巢组织线粒体结构 取材时将卵巢放入2.5%戊二醇固定,在4 ℃冰箱内过夜,卵巢组织修样成1 cm×1 cm×1 cm大小,加入1 mol/L的PBS漂洗3次,每次10 min;1%锇酸固定,双蒸水同法再次漂洗3次;50%、70%、90%、100%梯度浓度丙酮脱水,浸透,包埋固化,于37 ℃和60 ℃烘箱干燥,修样后在超薄切片机切片后,醋酸双氧铀和柠檬酸铅双重染色,37 ℃烘箱干燥过夜;透射电镜观察卵巢组织线粒体形态。
2.4.6 Western blot检测OPA1和PINK1表达 将
-80 ℃冰箱冻存的卵巢取出,加入裂解液冰上研磨,4 ℃,12 000 r/min(半径6 cm)离心15 min,进行蛋白定量,制分离胶,将定量后样品与标准品蛋白上样进行凝胶电泳,80 V,120 min恒压电泳;200 mA,100 min恒流电转,脱脂奶粉37 ℃封闭1 h。
2.5 统计学分析
采用SPSS 25.0统计软件和Graph Pad Prism 8.0.1进行数据分析,计量资料均使用“x±s”表示,数据符合正态分布且符合方差齐性检验采用单因素方差分析,组间多重比较采用LSD法。以P<0.05表示差异有统计学意义。
3 结果
3.1 一般情况比较
实验过程中空白组小鼠饮食、活动、二便等情况均正常,毛色有光泽,体质量增长率正常,动情周期规律;模型组小鼠较空白组大便较稀,毛色枯燥,尖端发黄,缺乏光泽。与空白组比较,模型组小鼠体质量增长率明显下降(P<0.05)。与空白组比较,模型组、暖巢煲低剂量组卵巢指数均降低(P<0.01)。与暖巢煲中剂量组相比,模型组、暖巢煲高剂量组卵巢指数均降低(P<0.01)。详见表1、图1。
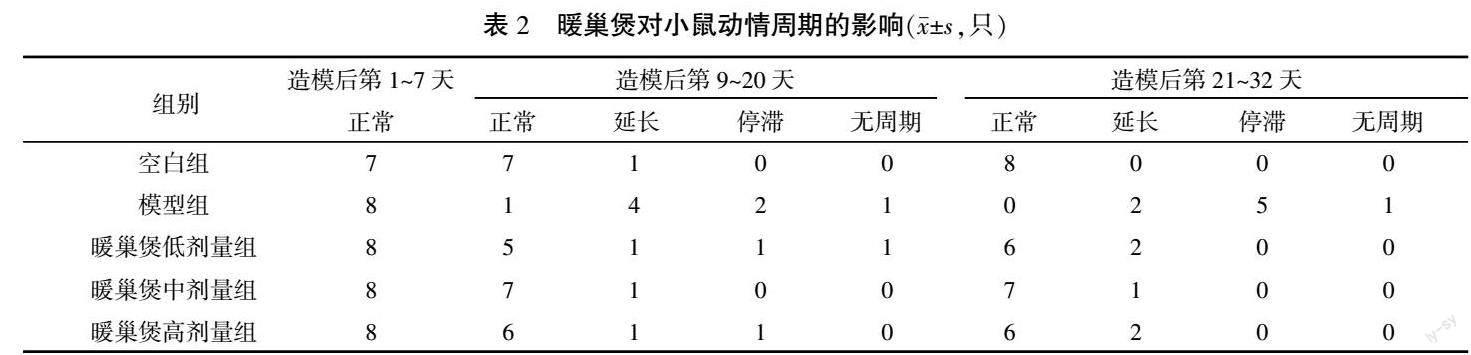
3.2 暖巢煲对POI小鼠动情周期的影响
与空白组小鼠相比,模型组小鼠动情周期紊乱。造模前各组小鼠动情周期正常,为4~5 d,正常可见规律周期性改变(动情前期、动情期、动情后期、动情间期)。造模后,空白组小鼠动情周期规律稳定;模型组表现为周期延长、紊乱、停滞,其中,周期延长居多,多为动情后期和间期,表明模型建立成功。详见图2—3、表2。
3.3 暖巢煲对POI小鼠血清性激素的影响
与空白组比较,模型组、暖巢煲低剂量组小鼠血清AMH明显下降(P<0.05)。与模型组比较,暖巢煲低剂量组无统计学意义。与模型组、暖巢煲低剂量组比较,暖巢煲中、高剂量组血清AMH明显升高(P<0.05)。详见表3。
3.4 暖巢煲对POI小鼠组织形态的影响
空白组卵巢结构清晰,生长卵泡数目较多,少量闭锁卵泡;与空白组比较,模型组生长卵泡数量及颗粒层明显减少,闭锁卵泡数量增加。与模型组比较,暖巢煲低剂量组、暖巢煲中剂量组、暖巢煲高剂量组生长卵泡数量明显增多,形态清晰,闭锁卵泡数量明显减少。详见图4。
3.5 暖巢煲对POI小鼠颗粒细胞线粒体形态的影响
与空白组比较,透射电镜下观察到模型组线粒体密度减低,嵴少见,出现病变如肿胀、空泡样变形成,有白泡样变,基质密度不均匀。空白组的线粒体基本呈椭圆形,分布密度适中,线粒体内嵴清晰,轮廓明显。暖巢煲高剂量组线粒体嵴明显,基质密度均匀,数量较多,暖巢煲低剂量组少量线粒体局部空化。详见图5。
3.6 暖巢煲对POI小鼠OPA1、PINK1蛋白的影响
与空白组比较,模型组OPA1及PINK1蛋白表达量明显下降(P<0.01)。与模型组比较,暖巢煲低、中、高剂量组OPA1蛋白表达量上调(P<0.01)。详见图6。
4 讨论
卵巢是雌性哺乳动物生殖功能中十分重要的器官,卵巢功能的最终体现是卵泡细胞的成熟、发育和排卵。有研究报告称其发病率为1.9%[11],最近进行的一项荟萃分析估计全世界有3.7%的妇女受到影响[12],促成POI患病率的背景是由促性腺毒性治疗引起的医源POI的绝经前癌症幸存者的发病率增加引起的[13]。POI的病因复杂,包括线粒体异常和医源性因素(包括化疗、放疗和外科手术)引起的异质性疾病[14],临床对POI的一般治疗是模拟生理激素释放的激素替代疗法,但临床使用雌、孕激素有局限,存在副作用较多、远期疗效欠佳等弊端,会发生多种并发症[15]。
中医古籍没有POI的相关概念,根据其临床表现可将其归为“月经后期”“月经量少”“闭经”“不孕”“年未老经水断”等范畴。《素问·上古天真论》曰:“女子七岁,肾气盛,齿更发长;二七而天癸至,任脉通,太冲脉盛,月事以时下,故有子。”《素问·六节藏象论》曰:“肾者,主蛰,封藏之本,精之处也。”肾藏精,精化气,肾精足则肾气充,肾—天癸—冲任—胞宫轴调节女子月事,肾中精气的盛衰,直接关系到生殖轴的功能状态。《脉贯·妇人脉》曰:“肾脉微涩与浮……皆经闭不调之候。”《景岳全书·虚损》谓:“五脏之伤,穷必及肾。”肾精亏则肾气衰,肾精先天不足或后天伐伤,天癸无以时至,则冲任空虚,胞宫失养,則经水早断。肾为命门,张景岳认为:“命门之火,谓之元气,命门之水,谓之元精。”尤老师根据多年的临床经验,认为肾精亏虚是该病的根本病机[16],兼肾阴肾阳二者皆虚,肾阴虚则无以盈溢,肾阳虚则失以温运,终至胞宫失养,月水早断。《兰室秘藏·经闭不行有三论》曰:“妇人脾胃久虚或形羸,气血俱衰而致经水断绝不行。”尤老师认为脾胃为后天气血生化之源,精血同源,卵泡的生长发育过程赖于后天精微物质滋养,脾虚则后天之精生化无源,巢中之泡无以滋养,或发育迟缓,或为无用之空泡。卵巢是女性生殖之卵泡发育场所,卵泡发育赖于先天肾精填充以及后天精微物质滋养,自创暖巢煲以补肾益精,暖巢养泡,在临床使用量较大,现代药理研究表明,其组成药物与线粒体功能密切相关[17]。POI发病机制和治疗机制复杂多样涉及多因素、多基因、多环节、多通路,从卵巢功能减退到POI再到卵巢早衰是一个渐进的过程。了解POI的发展规律,寻找一种安全有效的治疗手段,对于女性卵巢健康和POI防治有重大意义,中药复方治疗POI综合多靶点、多环节、多机制,具有独特的治疗特色和优势,以减少传统西药治疗带来的不良反应。因此,研究临床有效的中药复方治疗POI有重要意义。
本實验结果显示,与空白组比较,模型组小鼠体质量增长率缓慢。模型组大部分小鼠动情周期处于紊乱状态,卵巢指数下降;血清AMH呈下调趋势;卵巢组织HE切片提示模型小鼠卵巢形态受损,原始卵泡、窦前卵泡、窦状卵泡均明显减少,闭锁卵泡增多。以上结果均符合POI诊断指征,提示模型建立成功,暖巢煲治疗后,各治疗组小鼠体质量增长率与正常小鼠相当,其暖巢煲中、高剂量组小鼠体质量增长率增加速度较快。《黄帝内经素问集注·五脏生成》曰:“脾主中央土,乃仓廪之官,主运化水谷之精,以生养肌肉,故合肉。”脾为生化之源,脾胃运化水谷精微滋养身体,黄芪、黄精益气健脾,促进小鼠体质量恢复。除暖巢煲低剂量组外,暖巢煲中、高剂量组卵巢指数恢复至与空白组相当,动情周期在治疗后期逐渐恢复。AMH是一种糖蛋白,属于转化生长因子β家族[18],由前窦和小窦卵泡的颗粒细胞产生,是首选的卵巢储备标志物[19]。与空白组比较,模型组、暖巢煲低剂量组小鼠血清AMH明显下降,与模型组、暖巢煲低剂量组比较,暖巢煲中、高剂量组血清AMH明显升高,与空白组相当,说明暖巢煲能改善POI小鼠性激素水平。卵泡正常发育成熟排出需要先天之精和后天精微的濡养,暖巢煲通过益肾健脾、暖巢调泡,改善卵巢储备功能。
卵泡是卵巢中卵母细胞发生和发育的基本功能单位,卵泡由卵母细胞和围绕在其周围的多层颗粒细胞和最外层的卵泡膜细胞组成,卵泡的生长发育是三者相互作用的共同结果。颗粒细胞为卵母细胞提供能量底物,其线粒体的质量会影响卵母细胞[20],多项研究发现,POI主要是由于颗粒细胞凋亡[21]从而引起卵泡闭锁的[22],从生殖角度来看,卵巢功能不全是卵巢功能的逐渐下降,表现为卵泡数量和质量的下降[4],线粒体在滤泡闭锁中起核心作用[23],是细胞凋亡的中枢执行者[24]。线粒体动力学保持其结构完整和细胞内分布以适应细胞能量需求,线粒体动力学可以通过控制融合和自噬蛋白的表达水平和活性来调节。线粒体内膜融合通过OPA1进行,PINK1是一种丝氨酸/苏氨酸激酶,当线粒体损害、膜电位降低时被激活,清除受到严重损害的线粒体[25]。线粒体动力学能够控制、调节并维持线粒体的功能和质量。线粒体动力学改变可能导致线粒体和细胞功能障碍,线粒体功能障碍是影响卵母细胞质量的关键因素,可能直接影响卵巢衰老[26]。形态学研究发现,卵巢衰老会影响卵母中的线粒体功能,导致线粒体肿胀、液泡化和碎裂[27]。在本研究中,与空白组比较,透射电镜下观察到模型线粒体密度减低,嵴少见,出现病变如肿胀、空泡样变形成,有白泡样变,基质密度不均匀。暖巢煲高剂量组线粒体嵴明显,基质密度均匀,数量较多。通过检测与线粒体内膜融合有关的OPA1、与自噬有关的PINK1,与空白组比较,模型组呈明显下调状态,而暖巢煲对这2个蛋白都有显著上调作用。以上结果显示暖巢煲可能通过线粒体融合及自噬的动力过程,维持其结构、功能完整,进而维持卵巢卵泡正常功能。
综上所述,本研究证实暖巢煲能通过调节线粒体功能,改善卵巢功能,保护卵巢储备的功能,从而对POI发挥治疗作用。
参考文献
[1] WESEVICH V, KELLEN A N, PAL L. Recent advances in understanding primary ovarian insufficiency[J]. F1000Research, 2020, 9: 1-13.
[2] MATSUDA F, INOUE N, MANABE N, et al. Follicular growth and atresia in mammalian ovaries: Regulation by survival and death of granulosa cells[J]. The Journal of Reproduction and Development, 2012, 58(1): 44-50.
[3] ADHIKARI D, LEE I W, YUEN W S, et al. Oocyte mitochondria-Key regulators of oocyte function and potential therapeutic targets for improving fertility[J]. Biology of Reproduction, 2022, 106(2): 366-377.
[4] VAN DER REEST J, NARDINI CECCHINO G, HAIGIS M C, et al. Mitochondria: Their relevance during oocyte ageing[J]. Ageing Research Reviews, 2021, 70: 101378.
[5] MAY-PANLOUP P, BOUCRET L, CHAO DE LA BARCA J M, et al. Ovarian ageing: The role of mitochondria in oocytes and follicles[J]. Human Reproduction Update, 2016, 22(6): 725-743.
[6] KASAPO[ˇ][G]LU I, SELI E. Mitochondrial dysfunction and ovarian aging[J]. Endocrinology, 2020, 161(2): bqaa001.
[7] ZHOU F, SONG Y, LIU X, et al. Si-Wu-Tang facilitates ovarian function through improving ovarian microenvironment and angiogenesis in a mouse model of premature ovarian failure[J]. Journal of Ethnopharmacology, 2021, 280: 114431.
[8] SANO K, MATSUDA S, TOHYAMA S, et al. Deep learning-based classification of the mouse estrous cycle stages[J]. Scientific Reports, 2020, 10: 11714.
[9] 劉小虎, 赵志慧, 周 玥, 等. SIRT1在人参皂苷Rg1延缓D-gal诱导的卵巢早衰小鼠模型卵巢早衰中的作用[J]. 中国中药杂志, 2020, 45(19): 4699-4704.
[10] ARMAIZ-PENA G N, MANGALA L S, SPANNUTH W A, et al. Estrous cycle modulates ovarian carcinoma growth[J]. Clinical Cancer Research: an Official Journal of the American Association for Cancer Research, 2009, 15(9): 2971-2978.
[11] LAGERGREN K, HAMMAR M, NEDSTRAND E, et al. The prevalence of primary ovarian insufficiency in Sweden; a national register study[J]. BMC Women's Health, 2018, 18(1): 175.
[12] GOLEZAR S, RAMEZANI TEHRANI F, KHAZAEI S, et al. The global prevalence of primary ovarian insufficiency and early menopause: A meta-analysis[J]. Climacteric, 2019, 22(4): 403-411.
[13] VAN DORP W, MULDER R L, KREMER L C M, et al. Recommendations for premature ovarian insufficiency surveillance for female survivors of childhood, adolescent, and young adult cancer: A report from the international late effects of childhood cancer guideline harmonization group in collaboration with the PanCareSurFup consortium[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2016, 34(28): 3440-3450.
[14] FRAN[?]A M M, MENDONCA B B. Genetics of primary ovarian insufficiency in the next-generation sequencing era[J]. Journal of the Endocrine Society, 2019, 4(2): 1-41.
[15] 加秀凤, 陈 瑞, 罗 丹, 等. 调经养巢方对卵巢早衰模型大鼠卵巢超微结构及细胞凋亡的影响[J]. 湖北中医药大学学报, 2022, 24(2): 5-9.
[16] 李 涵, 刘慧萍, 肖贾丽珏, 等. 补肾活血方对卵巢功能早衰大鼠卵巢组织外泌体相关膜蛋白的影响[J]. 湖南中医药大学学报, 2022, 42(6): 885-892.
[17] 刘垚君, 张玉琴, 方雅玲, 等. 黄精多糖调控SIRT1/AMPK/PGC-1α信号通路改善H2O2诱导的HT22细胞氧化损伤[J]. 中国现代应用药学, 2021, 38(16): 1952-1957.
[18] LA MARCA A, VOLPE A. The Anti-Mullerian hormone and ovarian cancer[J]. Human Reproduction Update, 2007, 13(3): 265-273.
[19] VICTORIA M, LABROSSE J, KRIEF F, et al. Anti Müllerian Hormone: More than a biomarker of female reproductive function[J]. Journal of Gynecology Obstetrics and Human Reproduction, 2019, 48(1): 19-24.
[20] ORISAKA M, TAJIMA K, TSANG B K, et al. Oocyte-granulosa-theca cell interactions during preantral follicular development[J]. Journal of Ovarian Research, 2009, 2(1): 9.
[21] 杨开锋, 李 兰, 周 虹, 等. 氧化应激与细胞自噬凋亡对卵巢早衰调控的研究进展[J]. 湖南中医药大学学报, 2021, 41(5): 809-814.
[22] CHENG J R, PAN Y, YANG S F, et al. Integration of transcriptomics and non-targeted metabolomics reveals the underlying mechanism of follicular atresia in Chinese buffalo[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2021, 212: 105944.
[23] 王雨琦, 严如根, 靖文君, 等. 基于网络药理学及分子对接技术探究北沙参-玉竹治疗卵巢早衰的作用机制[J]. 中药新药与临床药理, 2022, 33(5): 645-654.
[24] TAIT S W G, GREEN D R. Mitochondria and cell death: Outer membrane permeabilization and beyond[J]. Nature Reviews Molecular Cell Biology, 2010, 11(9): 621-632.
[25] 刘 超, 王明娟, 范彦芳, 等. 丹皮酚对大鼠心肌梗死后心脏功能的改善及其对Pink1/Parkin的影响[J]. 世界科学技术-中医药现代化, 2020, 22(5): 1428-1436.
[26] EICHENLAUB-RITTER U, VOGT E, YIN H, et al. Spindles, mitochondria and redox potential in ageing oocytes[J]. Reproductive BioMedicine Online, 2004, 8(1): 45-58.
[27] MADAN S, UTTEKAR B, CHOWDHARY S, et al. Mitochondria lead the way: Mitochondrial dynamics and function in cellular movements in development and disease[J]. Frontiers in Cell and Developmental Biology, 2022, 9: 781933.

