枳术丸对脾虚证慢传输型便秘小鼠结肠黏膜AQP3、AQP9的影响
汤文娟 夏旭婷 刘富林


〔摘要〕 目的 觀察枳术丸对脾虚证慢传输型便秘(slow transit constipation, STC)小鼠结肠AQP3、AQP9表达的影响,探讨枳术丸改善STC症状的可能作用机制。方法 将50只SPF级昆明小鼠随机分成正常组(15只)和造模组(35只),造模组采用复合因素法(番泻叶+限水+控制饮食)建立脾虚证STC小鼠模型,造模成功后造模组小鼠按体质量随机分为模型组(10只)、枳术丸组(10只)、莫沙必利组(10只)。连续给药7 d后,检测各组小鼠的粪便含水量、肠道推进率、血清木糖含量及结肠黏膜组织病理学特征;免疫组化及Western blot法检测AQP3、AQP9蛋白表达。结果 与正常组相比,模型组小鼠粪便含水量显著减少,肠道推进率显著降低,血清木糖含量显著降低,小鼠结肠黏膜AQP3表达显著增多,AQP9表达显著减少(P<0.01);与模型组相比,枳术丸组小鼠粪便含水量显著增加(P<0.05),肠道推进率显著升高(P<0.01),血清木糖含量显著升高(P<0.01),小鼠结肠黏膜AQP3表达显著减少,AQP9表达显著增加(P<0.01);与莫沙必利组相比,枳术丸组小鼠肠道推进率升高(P<0.05),血清木糖含量显著升高(P<0.01),结肠黏膜AQP3表达显著减少(P<0.01),AQP9表达显著增加(P<0.01),粪便含水量差异无统计学意义(P>0.05)。结论 STC的发病与结肠黏膜AQP3上调、AQP9下调有关,枳术丸可以通过下调AQP3的表达、上调AQP9的表达,增加粪便的含水量而改善STC。
〔关键词〕 慢传输型便秘;枳术丸;脾虚证;结肠黏膜;AQP3;AQP9
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.06.006
〔Abstract〕 Objective To observe the effects of Zhizhu Pill on the expressions of AQP3 and AQP9 in the colon of mice with slow transit constipation (STC) of spleen deficiency pattern, and to explore the possible mechanism of Zhizhu Pill in improving STC symptoms. Methods The total of 50 SPF Kunming mice were randomly divided into normal group (n=15) and model-building group (n=35). The STC mouse model of spleen deficiency pattern was established by compound factor method [Fanxieye (Sennae Folium)+ water restriction + diet control]. After successful modeling, the mice of model-building group were randomly divided into model group (n=10), Zhizhu Pill group (n=10), and Mosapride group (n=10) according to their body weight. After 7 days of continuous drug administration, the fecal water content, intestinal propulsion rate, serum xylose content as well as histopathological characteristics of colonic mucosa were determined. Immunohistochemistry and Western blot were used to measure the expressions of AQP3 and AQP9 proteins. Results Compared with normal group, the fecal water content, the intestinal propulsion rate, and the serum xylose content of the mice in model group were significantly lower, the expression of AQP3 in mice colonic mucosa was significantly higher, and the expression of AQP9 was significantly lower (P<0.01). Compared with model group, the fecal water content, the intestinal propulsion rate, and the serum xylose content of Zhizhu Pill group were significantly higher (P<0.05, P<0.01, P<0.01), the expression of AQP3 in mice colonic mucosa was significantly lower, and the expression of AQP9 was significantly higher (P<0.01). Compared with mosapride group, the intestinal propulsion rate and the serum xylose content of Zhizhu Pill group were significantly higher (P<0.05, P<0.01), the expression of AQP3 in mice colonic mucosa was significantly lower(P<0.01), and the expression of AQP9 was significantly higher (P<0.01). The difference of fecal water content between the two groups was of no statistical significance (P>0.05). Conclusion The pathogenesis of slow transit constipation is related to the up-regulation of AQP3 and the down-regulation of AQP9 in colonic mucosa; Zhizhu Pill can relieve slow transit constipation by down-regulating the expression of AQP3, up-regulating the expression of AQP9, and increasing the water content of stool.
〔Keywords〕 slow transit constipation; Zhizhu Pill; spleen deficiency pattern; colonic mucosa; AQP3; AQP9
慢传输型便秘(slow transit constipation, STC)属于功能性便秘的一种,它是指结肠转运较缓慢,肠道动力降低,肠内容物在肠道停留时间过长、不能顺利排出为特点的慢性便秘,主要症状是排便周期延长(严重者5~6 d解1次大便)、粪便排出费力、粪质干结或量少,调查显示STC的发病率女性多于男性[1]。关于STC发病机制的研究是近几年学术研究的热门,普遍认为STC的发病与肠道动力不足及肠道内水分吸收异常有关[2]。长期的慢性便秘会导致患者生活质量下降,引起精神焦虑,严重者可引起急性肠梗阻、肠坏死穿孔等危急重症[3]。因此,加强对STC发病机制的研究,找到治疗STC稳定可靠的治疗手段,受到高度关注。20世纪80年代,科学家从红细胞膜上发现了一种能传输水分子的蛋白质,后经过大量的实验验证,最终鉴定为水通道蛋白,并把它命名为“Aquaporin(AQP)”[4]。目前,在所有哺乳动物身体内至少已找到了13种水通道蛋白(AQP0~AQP12)[5]。水通道蛋白广泛分布在机体的各个组织器官中,参与机体的水液代谢,而胃肠道又是机体水液新陈代谢中最活跃的脏器,所以,水通道蛋白在胃肠道水液的运输与新陈代谢过程中,扮演着关键的角色[6]。其中AQP3、AQP9在结肠表达活跃,参与结肠内水液的吸收与分泌,大量研究证实[7-8],AQP3与水液吸收呈正相关,能促进结肠对水液的吸收从而发生便秘,AQP9与水液分泌呈正相关,它能促进结肠内水液的分泌而改善便秘。现代医学对于STC的治疗有一定的局限性,中医学作为我国的传统医学,对于STC的治疗有着巨大的优势,它能从根本上改善患者的便秘体质,越来越多的便秘患者选择接受中医药治疗。枳术丸由白术、枳实两味中药组成,该方药少力专,方中以白术为主药,枳实为辅药,两药按2∶1的比例配伍,两药配伍,具有健脾益气、行气导滞之功,枳术丸切中脾虚证STC的发病机制,临床疗效确切[9]。莫沙必利是选择性5-羟色胺4受体(5-hydroxytryptamine 4 receptor, 5-HT4R)激动剂,能通过促进乙酰胆碱的释放而发挥促胃肠动力作用,减少粪便在肠道内停留的时间,从而减少粪便水分的重吸收,使粪质变稀,是临床治疗STC的常用药物。此外,前期实验也证实[10],脾虚证STC小鼠结肠黏膜AQP4、AQP8表达升高,莫沙必利与枳术丸均能通过下调AQP4、AQP8的水平而增加粪便含水量,因此本实验选择将莫沙必利作为阳性对照药。已知结肠内AQP的表达异常是STC的发病机制之一,而枳术丸是治疗STC的有效方剂,目前尚无研究证实枳术丸能同时上调与水液吸收呈负相关的AQP9和下调与水液吸收呈正相关的AQP3,有待深入广泛的研究。为此,本实验选择AQP3、AQP9为检测指标,通过在分子水平上观察枳术丸对脾虚证STC小鼠结肠AQP3、AQP9表达的影响,进一步探讨枳术丸改善STC症状的可能作用机制。
1 材料
1.1 动物
50只健康昆明小鼠,体质量为(20±2) g,SPF级,雌性25只,雄性25只。购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0009,合格证号:430727211102193536。
1.2 药物
生白术200 g、麸炒枳实100 g,先加3 L的清水浸泡30 min,再煎煮40 min,并过滤药液后再次加2.4 L清水煎煮40 min,合并2次药液,并将药液浓缩成浓度为1 kg/L的药液,分装入塑胶瓶中,封口,编号,置于4 ℃冰箱冷藏备用;番泻叶500 g加5 L沸水浸泡10 min,并过滤药液,浓缩成浓度为1 kg/L的药液,装入塑胶瓶中,封口,编号,放置在4 ℃冰箱冷藏后备用;枸橼酸莫沙必利(国药准字号:H19990313,批号:1E018,规格:5 mg/片);以上药物均购于湖南中医药大学第一附属医院药房。
1.3 仪器与试剂
台式高速离心机(长沙湘仪离心机仪器有限公司,型号TG16-WS);显微镜(日本Olympus公司,型號BX51);电泳仪(北京六一仪器厂,型号DYY-6C);扫描仪(EPSON,型号V300);匀浆仪(康涛科技有限公司,型号KZ-II);D-木糖试剂盒(南京建成生物工程研究所,货号A035);PBS缓冲液(谷歌生物,货号G0002);兔抗AQP3抗体(货号OM271461)、兔抗AQP9抗体(货号OM167205)均购自美国OmnimAbs生物公司;显影定影试剂(武汉皮诺飞生物科技有限公司,货号G2019);SDS-PAGE凝胶制备试剂盒(武汉皮诺飞生物科技有限公司,货号S8010);BSA(武汉谷歌生物科技有限公司,货号G5001)。
2 方法
2.1 分组
50只小鼠随机分为正常组15只、造模组35只。造模15 d后,两组各抽取5只小鼠用于模型验证,造模成功后正常组剩10只,造模组剩30只,再将造模组30只小鼠随机分为模型组、枳术丸组、莫沙必利组,每组10只。
2.2 造模
参考夏旭婷等[11]方法建立脾虚型STC模型,具体方法流程包括:前7天用番泻叶按20 g/(kg·d)灌胃,灌胃浓度为1 kg/L,正常饮食饮水,造成脾虚模型;第8~15天停用番泻叶,隔天喂生米,每次6 g/只,饮水30 min,造成便秘模型,造模时间共15 d,最后复制出脾虚证小鼠STC模型。小鼠外形瘦弱、皮肉松懈,毛质粗犷萎黄,活动迟缓,部分拱背,纳食少,体质量增长缓慢。粪便干结、量少粒细,检测肠道推进率和血清D-木糖水平明显下降,HE染色未见结肠黏膜器质性变化,表示模型建立成功。
2.3 给药
造模完成后,按小鼠与成人给药系数计算出小鼠的每天给药量,枳术丸组按9.0 g/(kg·d)(生药含量)给药,莫沙必利组按2.5 mg/(kg·d)给药,模型组和正常组给予0.1 mL/10 g蒸馏水灌胃,每天2次,持续给药7 d。
2.4 取材
小鼠禁食不禁水24 h,除正常组2只小鼠外,其余每只小鼠灌胃0.3 mL D-木糖溶液,20 min后开始眼球取血,血液静置于1.5 mL离心管中以备离心;眼球取血后颈椎脱臼处死小鼠,剖腹取出幽门至回盲部的全部肠道,测量肠道推进率;最后将横结肠剪成约2 cm的小段,取3段,分别用生理盐水清洗,2段放在多聚甲醛液中固定,以备HE染色及免疫组化,另1段放在冻存管中,置于-80 ℃冰箱,以备Western blot检测。
2.5 观察指标及检测方法
2.5.1 小鼠一般行为学观察及排便观察 每天观察及记录小鼠的活动情况、毛发光泽度及排便情况,每3天记录一次体质量。
2.5.2 粪便含水量检测 收集小鼠造模前、造模后、治疗后3 h内的粪便并称取粪便湿重,放入干燥机中烘干3 h,称取干重,测定粪便含水量。粪便含水量=(湿重-干重)/湿重×100%。
2.5.3 肠道推进率检测 测量幽门至回盲部的肠道全长和染黑肠道的长度。肠道推进率=(染黑肠道长度/肠道全长)×100%。
2.5.4 血清D-木糖含量检测 将离心管对称放入离心机中,以3500 r/min的速率,离心半径13.5 cm,离心15 min,提取血清,根据木糖试剂盒说明书步骤,应用比色分析法测定各组小鼠血清D-木糖含量。
2.5.5 结肠黏膜病理检测 取出固定好的结肠组织,脱水,石蜡包埋,做成0.4 μm的组织切片,用HE染色法,在光学显微镜下观察结肠黏膜病理改变,并拍照记录。
2.5.6 免疫组化检测结肠黏膜AQP3、AQP9的表达 先将固定好的切片组织干燥12 h,再放入二甲苯中脱蜡,然后用不同浓度的乙醇逐级脱水,蒸馏水浸泡5 min;将切片放置在PBS缓冲液中,煮沸15 min,再冷却15 min,冷却后用PBS缓冲液洗涤3次,每次3 min;加入1%高碘酸,室温10 min以灭活内源性酶,PBS冲洗3次,每次3 min;滴加适当稀释(1∶400)的一抗(AQP3、AQP9),4 ℃过夜,PBS冲洗5 min×3次,滴加与一抗相同种属的二抗,室温孵育50 min;滴加预先准备好的显色剂DAB浓缩液50~100 μL,室温温度以孵育1~5 min为宜,在镜下调节反应持续时间,用蒸馏水浸泡;苏木素复染5~10 min,蒸馏水冲洗,PBS返蓝;再用不同浓度乙醇逐级脱水,取出后放入二甲苯10 min,用中性树胶封片、显微镜下观测。
2.5.7 Western blot检测结肠黏膜AQP3、AQP9蛋白的表达 组织块用PBS洗涤,剪成小块置于匀浆器;匀浆液移入离心管中,4 ℃离心,2100 r/min离心5 min,离心半径13.5 cm;取上清再次离心,4 ℃,2100 r/min离心5 min,离心半径13.5 cm;再将离心后的上清(浆蛋白)置于-20 ℃冰箱保存;沉淀为膜蛋白,用PBS缓冲液漂洗,弃组织块;离心,4 ℃,2100 r/min离心5 min,离心半径13.5 cm;BCA法测蛋白浓度;清洗玻璃板,灌胶与上样,按实验安排配制分离胶,加入TEMED后立即摇匀即可灌胶,梳子插入浓缩胶中,加足够的电泳液后上样电泳。浓缩胶电压75 V,分离胶用120 V;电泳至溴酚蓝刚跑出即可终止电泳,进行转膜;将转好的膜于室温下脱色摇床上用5%的脱脂牛奶,封闭1 h;除去封闭液,加入稀释好的一抗4 ℃过夜,0.01 mol/L PBS漂洗5 min×3次;将二抗用TBST稀释3000倍,室温下孵育30 min后,0.01 mol/L PBS漂洗5 min×3次;滴加新鲜配制的ECL混合溶液到膜的蛋白面侧,暗室中曝光;根据不同的光强度调整曝光条件,显影、定影。
2.6 統计学方法
用SPSS 23.0统计软件对数据进行分析处理,实验数据以“x±s”形式表示,采用单因素方差分析,两两比较时选择LSD法,P<0.05为差异有统计学意义。
3 结果
3.1 小鼠一般行为学观察及排便观察
正常组小鼠外形饱满,表现敏捷,纳食正常,大便质软成形,量一般,体质量持续增长。造模组小鼠反应速度迟缓,外形瘦弱、毛质粗犷萎黄,纳食少,体质量增长缓慢,大便初期稀溏,次数增加,后期大便逐渐变硬,频次、数量均减少,粪便颗粒细小。造模成功后,给予不同药物干预,枳术丸组小鼠精神状态转佳,外形较前丰满,反应速度变灵敏,纳食日渐增多,体质量逐步增长,大便日渐变软,数量增加,颗粒变大。莫沙必利组小鼠精神、外形、皮色毛质、反应较前无改善,但纳食明显增加,体质量逐渐增长,大便较前变软,数量增加,颗粒变大。
3.2 粪便含水量检测
与正常组相比,造模后(2周),模型组小鼠粪便含水量减少(P<0.01);与模型组相比,治疗后(3周)枳术丸组小鼠粪便含水量增加(P<0.05);枳术丸组与莫沙必利组相比,两组之间粪便含水量比较差异无统计学意义(P>0.05);说明便秘模型复制成功。详见表1。
3.3 肠道推进率检测
与正常组相比,模型组小鼠肠道推进率明显降低(P<0.01);经枳术丸及莫沙必利干预后,小鼠肠道推进率显著升高(P<0.01),且两组之间以枳术丸的效果最好(P<0.05)。详见表2。
3.4 血清D-木糖含量检测
与正常组相比,模型组小鼠血清D-木糖含量显著降低(P<0.01);与模型组相比,枳术丸组、莫沙必利组小鼠血清D-木糖含量均显著升高(P<0.01),且以枳术丸组升高显著(P<0.01)。详见表3。
3.5 结肠黏膜病理检测
各组小鼠黏膜病理检测结果无较大差别,均未发现明显黏膜器质性损伤,模型组部分结肠黏膜可见少量炎癥细胞浸润、腺体固有层间隙增宽等表现。详见图1。
3.6 免疫组化检测结肠黏膜AQP3、AQP9的表达
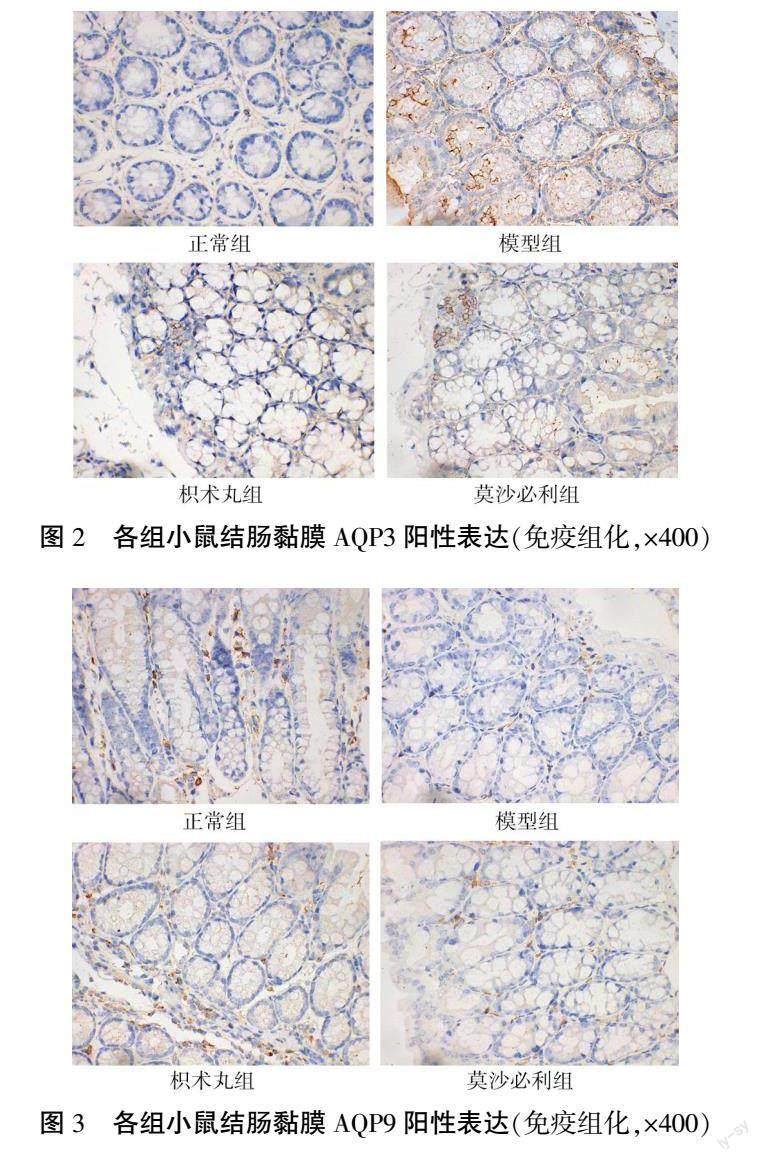
与正常组相比,模型组小鼠结肠黏膜AQP3分布密集,表达显著增多(P<0.01),而AQP9分布稀疏,表达显著减少(P<0.01);经枳术丸及莫沙必利干预后,小鼠结肠黏膜AQP9表达增多(P<0.01),AQP3表达减少(P<0.01),且两组之间以枳术丸的干预效果更明显(P<0.01)。详见表4、图2—3。
3.7 Western blot检测结肠黏膜AQP3、AQP9的表达
与正常组比较,模型组小鼠结肠黏膜AQP3表达增多(P<0.01),AQP9表达减少(P<0.01);经枳术丸及莫沙必利干预后,AQP3表达显著减少(P<0.01),AQP9表达显著增加(P<0.01),且两组之间以枳术丸的干预效果更明显(P<0.01)。结果见图4、表5。
4 讨论
中医学根据疾病证候表现,将STC归属于“便秘”。中医学认为便秘是由于肠道传导功能失常,致使大便秘结不通,出现排便周期延迟,或粪质干结,或排便不畅的病症。大肠的主要功能是传化糟粕和主津。大肠主传化糟粕即是指饮食物通过大肠的重吸收功能形成粪便,并在肠道的蠕动作用下向外排出的过程。大肠主津是指大肠吸收饮食糟粕中部分津液,使之形成有形之粪便的作用。若大肠主津功能失常,过度吸收食物糟粕中的津液而造成大便干结或肠道本身津液匮乏,胃肠失于濡养,导致粪便艰涩难出,出现便秘。便秘的病位虽然主要在大肠,却与其他脏腑如脾、胃、肺、肝、肾等脏腑的功能失调相关[12],其中主要与脾胃的关系最为密切。六腑以通为用,饮食由口入胃,在胃气的通降作用下饮食糟粕才能下传大肠并排出体外,故胃气失于通降,则导致肠道传导失职。此外胃中有实热,消烁肠道津液,也会导致肠道干枯,大便秘结。脾具有运化功能,既能运化谷食也能运化水饮。脾能布散津液,将饮食水谷中吸收的津液布散于全身,以发挥濡养作用。若脾气虚,运化功能失常,不能输布布散津液,导致胃肠津液不足,大便干燥而发为便秘。大肠的传导功能还有赖于脾气的充足,具体表现为两点,其一,脾气能促进肠道蠕动,推动肠道运行;其二,脾可以化生气血以濡养肠道。若脾气不足,推动作用减弱,肠道蠕动缓慢,则发生腹胀、便秘;脾气不足,气血生化乏源,肠道津液不足,失于濡润,亦可发为便秘。根据便秘病理因素的不同,可将便秘分为虚实两大类,STC属于虚证类的便秘。虚证类的便秘主要包括气虚型、津亏型、阳虚型。脾气既能推动肠道运行,也能化生气血以濡养肠道,故脾虚既能导致气虚也能导致津亏,因此健运脾胃是治疗STC的核心治法。
枳术丸是临床治疗脾虚便秘的有效方剂,该方药少力专,由白术、枳实两味中药组成,是由张仲景的枳术汤化裁而来,枳术汤与枳术丸在药物组成上一样,但药物配比不一样。枳术丸中以白术为主药,枳实与白术用量为1∶2,主治脾虚食积之痞证,具有健脾行气消痞之功,补大于消。枳实性味辛、苦,主归脾、胃两经,辛味药具有行气作用,能行中焦胃肠之气,苦味药具有通泄作用,能通泄大便。白术性味甘温,主归脾胃两经,甘味药具有补益作用,能健脾益气,主治脾气虚弱主证。枳术丸方中白术健脾益气,培补脾胃为主药,枳实行气导滞为辅药,两药合用,使脾虚得补,气滞得行。枳术丸药少力专,直达病所,临床上对STC的治疗效果显著[13]。
STC主要是以胃肠道传输迟缓、大便干燥为特点,便秘患者结肠内水分的异常分泌或吸收可能是STC的发病机制之一。肠道的主要功用是吸收水分,使粪便成形,并能分泌一定的黏液润滑肠道,促使粪便顺利排出。AQP是位于细胞膜上的一种转运载体,作为载体它可以转运水分子、甘油、尿素等小分子,在人体内广泛分布,尤其是水液代谢活跃的结肠,它参与结肠对水分的吸收与分泌作用[14]。AQP在肠道内正常表达,肠道内的水液代谢得以正常进行,AQP表达的增加或减少,则会引起便秘或腹泻。目前已有研究证明,AQP3、AQP9在胃肠道大量分布,参与了胃肠道内水分的吸收和分泌[15]。AQP3主要分布于肾脏、消化系统、呼吸系统。在消化系统中AQP3主要分布在远端结肠与胃贲门腺黏膜,它不仅能促进结肠对水分的吸收,还能促进结肠对甘油、尿素等的转运[16]。KON等[17]研究表明吗啡能够上调结肠组织AQP3表达,从而增强由侧腔到血管侧的水分吸收,而导致便秘。周永学等[18]研究表明,升高结肠AQP3的水平能有效改善腹泻。钱海华等[19]研究证实,通便颗粒能减少肠道AQP3的表达,进而改善便秘。AQP9主要存在于肝脏及肠道,尤其在近端结肠及远端小肠中高度表达[20],参与肠内保护黏膜及促进肠内黏液的吸收与分泌。冉吕等[21]研究表明AQP9在近端结肠中具有分泌黏液的功能,但对于便秘患者近端结肠AQP9表达降低,提示AQP9表达的减少促进了便秘的发生。耿学斯等[22]实验证明,便秘大鼠AQP9低表达、AQP3 高表达。在蒋峰等[23]实验中,采用复方地芬诺酯建立便秘模型,通过计算每周的粪便含水率,用PCR及Western blot法测定AQP3和AQP9基因和蛋白表达状况,结果表明模型组的粪便含水率显著减少,AQP3表达增多,而AQP9表达降低,表明粪便含水率和AQP9的表达呈正相关,与AQP3的表达呈负相关。以上实验结果均证实,AQP3、AQP9在结肠的异常表达均可导致便秘,与STC的发病密切相关,同时也给临床治疗STC提供了新的思路和靶点。
STC以肠道运行缓慢、粪质干结、排便量少为主要表现,属于功能性便秘的类型,故我们选择肠道推进率来评估肠道动力,选择粪便含水量来评估大便干结情况,观察小鼠排便情况来评估是否符合大便量少的情况,以结肠黏膜病理检测反映结肠有无器质性病变。有研究表明,血清D-木糖含量是反映脾虚状态异常的指标之一,可以反映肠道的吸收功能,故本实验选则小鼠血清D-木糖含量作为验证脾虚证模型的客观指标。本实验结果显示,模型组小鼠外形瘦弱、毛质粗犷萎黄,纳食少,体质量增长缓慢,反应速度迟缓,大便质硬,量少,颗粒细小,粪便含水量降低,肠道推进率显著减少,血清D-木糖含量也減少,并且结肠黏膜无器质性病变,符合临床上脾虚证STC的诊断标准。本实验选择枳术丸组作为实验组,将莫沙必利组作为阳性对照组,结果显示,经过药物治疗干预后,枳术丸组和莫沙必利组小鼠体质量均较造模前明显增加,排便情况也较模型组明显改善,肠道推进率及血清D-木糖含量也显著超过了模型组,且枳术丸改善程度优于莫沙必利。前期研究结论证实,由于水通道蛋白在肠道内的异常表达引起了结肠对水分的过度吸收,从而引起了便秘的发生,其中AQP3、AQP9在结肠黏膜表达活跃,因此本实验选择AQP3和AQP9作为检测指标,并通过免疫组化和Western blot法测定其在结肠黏膜的表达情况。免疫组化结果和Western blot结果均显示模型组小鼠结肠黏膜AQP3表达升高,而AQP9表达降低。经过枳术丸干预后,小鼠结肠黏膜AQP3、AQP9表达恢复正常水平,说明枳术丸可通过下调AQP3的水平并上调AQP9的水平来抑制结肠对水分的重吸收,增加粪便含水量。
参考文献
[1] 崔文文, 管忠安. 中医诊治慢性便秘现状与进展[J]. 现代中西医结合杂志, 2021, 30(36): 4094-4099.
[2] 吴本升, 陈玉根. 慢性传输性便秘病理基础研究[J]. 长春中医药大学学报, 2012, 28(5): 824-825.
[3] VAZQUEZ ROQUE M, BOURAS E P. Epidemiology and management of chronic constipation in elderly patients[J]. Clinical Interventions in Aging. 2015, 10: 919-930.
[4] 庞 坤, 刘英丽, 韩立强. 水通道蛋白结构及调控的研究进展[J].畜牧与饲料科学, 2015, 36(12): 69-72.
[5] 张丽娅, 王永兵. 水通道蛋白在便秘肠道表达的中西医研究进展[J]. 中国当代医药, 2019, 26(35): 25-28.
[6] DANIALI M, NIKFAR S, ABDOLLAHI M. An overview of interventions for constipation in adults[J]. Expert Review of Gastroenterology & Hepatology, 2020, 14(8): 721-732.
[7] 詹 敏, 尹园缘, 李 逵, 等. 益气滋阴汤治疗慢传输型便秘大鼠的实验研究[J]. 中医药导报, 2021, 27(5): 40-43.
[8] 冯 智, 陈 强, 李毅忠, 等. 黄芪增液汤对便秘大鼠结肠AQP9的表达影响[J]. 中医临床研究, 2020, 12(6): 147-149.
[9] 宗 阳, 孙明明, 乐音子, 等. 白术-枳实配伍治疗慢传输型便秘的研究概述[J]. 中国药房, 2018, 29(16): 2300-2304.
[10] 樊俊阳. 枳术丸对STC模型小鼠结肠组织AchE、5-HT7R及水通道蛋白表达的影响[D]. 长沙: 湖南中医药大学, 2015.
[11] 夏旭婷, 樊俊阳, 王碧玉, 等. 脾虚证慢传输型便秘小鼠模型构建方法的比较研究[J]. 湖南中医药大学学报, 2014, 34(12): 4-7, 81.
[12] 吴勉华, 王新月. 中医内科学[M]. 9版. 北京: 中国中医药出版社, 2012.
[13] 章 慧. 生白术与枳实配伍治疗慢传输型便秘的临床研究[D]. 南京: 南京中医药大学, 2017.
[14] BLACK C J, FORD A C. Chronic idiopathic constipation in adults: Epidemiology, pathophysiology, diagnosis and clinical management[J]. The Medical Journal of Australia, 2018, 209(2): 86-91.
[15] FINN R N, CERDà J. Evolution and functional diversity of aquaporins[J]. The Biological Bulletin, 2015, 229(1): 6-23.
[16] 赵广西. 水通道蛋白3和8在消化系统的表达及其在炎症性肠病动物模型中的改变[D]. 上海: 复旦大学, 2014.
[17] KON R, IKARASHI N, NAGOYA C, et al. Rheinanthrone, a metabolite of sennoside A, triggers macrophage activation to decrease aquaporin-3 expression in the colon, causing the laxative effect of rhubarb extract[J]. Journal of Ethnopharmacology, 2014, 152(1): 190-200.
[18] 周永学, 王郁金, 张 红, 等. 血管活性肠肽对便秘大鼠排便及结肠组织中VIP-cAMP-PKA-AQP3信号通路的影响[J]. 中南大学学报(医学版), 2016, 41(11): 1175-1180.
[19] 钱海华, 徐天舒, 曾 莉, 等. 通便颗粒调节慢传输型便秘大鼠结肠水通道蛋白3, 水通道蛋白8表达的研究[J]. 中国实验方剂学杂志, 2014, 20(24): 180-184.
[20] 赵凯科, 郑 立, 毛智斌, 等. 水通道蛋白与胃肠道疾病关系研究进展[J]. 动物医学进展, 2016, 37(1): 77-80.
[21] 冉 吕, 梅浙川. 水通道蛋白9与消化系统疾病[J]. 检验医学与临床, 2013, 10(8): 1000-1002.
[22] 耿学斯, 罗春华, 肖秋平, 等. 肠润方对功能性便秘大鼠结肠黏膜AQP3、AQP9表达的影响[J]. 中华中医药杂志, 2016, 31(11): 4699-4703.
[23] 蒋 峰, 周锦勇, 刘明浩, 等. 养阴润肠方对便秘小鼠结肠水通道蛋白3/9的影响[J]. 中国实验方剂学杂志, 2018, 24(5): 114-120.

