胸段食管鳞癌患者经Ivor Lewis手术治疗后预后生存状况分析
沈晓玲,刘高利,张 娟,曾 艳
(武汉大学人民医院 a.东院,b.光谷院区,湖北 武汉 430060)
食管癌具有发病率高、预后差等特点,早期症状一般不明显,偶有吞咽食物不适,中晚期才发展成进行性吞咽困难,最终水和唾液均无法吞咽,晚期会出现持续性胸背疼痛症状,此时患者可有消瘦、脱水、体重下降、贫血、恶液质、肝脑转移等临床表现,对其身心都带来了极大的损害[1,2]。研究表明,我国在食管癌的病因、病理机制及治疗方法上与国外存在差异。其中我国病理类型以鳞癌最为常见,达到95%以上,多发生于食管胸中段,而国外以腺癌为主,多发生于食管胸下段[3,4]。目前我国临床对于食管鳞癌的治疗仍以手术方法为主,对于这些手术之间的疗效差异,国内医学专家们意见不一。因此,为了优化手术效果,需要进一步探究手术治疗后的预后生存状况及存在影响的危险因素。既往研究证实,微创Ivor Lewis手术相对于开放手术缩短了通气时间和住院时间,降低了肺部并发症的出现[5]。此外,国外对于食管腺癌复发危险因素相关文献有很多,而国内对于食管鳞癌术后复发危险因素的研究相对较少。本文旨在分析Ivor Lewis手术治疗后胸段食管鳞癌患者的预后生存状况及其预后的影响因素。
1 资料与方法
1.1 一般资料2015年3月至2018年6月在我院行Ivor Lewis术的97例食管鳞癌患者。纳入标准:①符合食管鳞癌诊断标准[6];②所有患者术后活检均确诊为鳞状细胞癌。排除标准:①有严重造血系统疾病和传染病者;②合并心、肺、肝、肾等其他脏器并发症者;③合并其他恶性肿瘤和严重全身感染者;④存在认知功能障碍和心理问题者。其中男73例,女24例,年龄35~74岁[(59.35±6.23)岁];肿瘤分布位置:胸中段56例,胸下段33例,胸上段8例。根据美国食管癌TNM分期标准评估[7],肿瘤病理:pT1期26例,pT2期17例,pT3期50例,pT4期4例。淋巴结病理:pN0期50例,pN1期26例,pN2期16例,pN3期5例。本研究获得我院医学伦理委员会同意批准。
1.2 方法术前经多名专家共同讨论,符合新辅助治疗适应证的患者,首先进行新辅助治疗,给予铂类方案化疗,第一天为75 mg/m2,3周为1个疗程,连续化疗2个疗程,在化疗基础上给予41.4~50 Gy总放射量的放疗,从化疗第一天开始同步进行,范围包括原发肿瘤和术前CT检查发现的肿大区域淋巴结,完成后进行术前检查和评估再行Ivor Lewis手术治疗。Ivor Lewis手术治疗:患者取仰卧位,选择上腹部中段为手术入口,取下部分游离胃组织,被动分离胃脾韧带,切断结扎胃短血管,分离食管膈韧带,向上打开胃黏膜,沿胰囊上缘找到胃左动脉,切开双结扎,沿胃小曲上缘向食管裂孔游离小网膜,注意保护右大网膜和右胃血管。清洁贲门及左胃动脉周围淋巴结,胸部右后外侧小切口,游离胸食管,用吻合器在右胸进行高位吻合,并用咬合器封闭患者残胃。
术后对患者进行病理评估,有高危复发因素的患者,在术后3周对其行术后辅助治疗。化疗方案同术前新辅助化疗相同,术后辅助放疗在化疗的基础上给予50.4 Gy总放射量的放疗,从化疗第一天开始同步进行,范围包括原发肿瘤和术后病理阳性淋巴结区域,连续治疗6周。
1.3 观察指标①分析97例食管鳞癌患者术后生存预后、复发及远处转移情况:对患者术后2、4年进行随访跟踪,随访资料来源于患者住院病历本、影响学检查及出院后电话随访,随访时间截止到2022年6月,观察记录患者术后2、4年生存情况,包括生存率、复发率、远处转移情况等。②分析食管鳞癌患者预后的独立危险因素。
1.4 统计学方法采用SPSS 28.0统计学软件分析数据。计量资料比较采用t检验;计数资料比较采用χ2检验;采用Logistic回归分析食管鳞癌患者预后的独立危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料97例患者中,38例使用了镇痛泵,吸烟史42例,酗酒史21例,合并糖尿病21例,合并高血压13例,存在胃排空障碍30例,术后并发症中,合并感染5例,吻合口瘘9例,因出血再次手术4例,心律失常6例及乳糜胸2例。
2.2 术后生存预后、复发及远处转移情况97例胸段食管鳞癌患者中共有30例(30.93%)术后出现复发转移,其中单纯局部复发14例(46.67%),远处器官转移9例(30.00%),全身多发性转移7例(23.33%)。在远处器官转移患者中,肺转移最多,共3例(33.33%),其次是肝转移2例(22.22%),其余骨转移、脑转移、肾转移和肾上腺转移各1例(11.11%)。30例术后复发转移患者的2、4年累计生存率分别为46.67%、20.00%,67例术后无复发转移患者的2、4年累计生存率分别为88.06%、76.12%,术后复发组2、4年累计生存率低于无复发组(P<0.05)。见表1。

表1 术后复发与无复发患者累计生存率比较 [n(%)]
2.3 复发组与无复发组临床资料比较复发组与无复发组年龄、肿瘤位置、有无术前新辅助治疗、术后有无胃排空障碍、吻合口瘘及乳糜胸等比较,差异无统计学意义(P>0.05);性别、病理T分期、病理N分期、肿瘤分化程度及有无术后辅助治疗等比较,差异有统计学意义(P<0.05)。见表2。
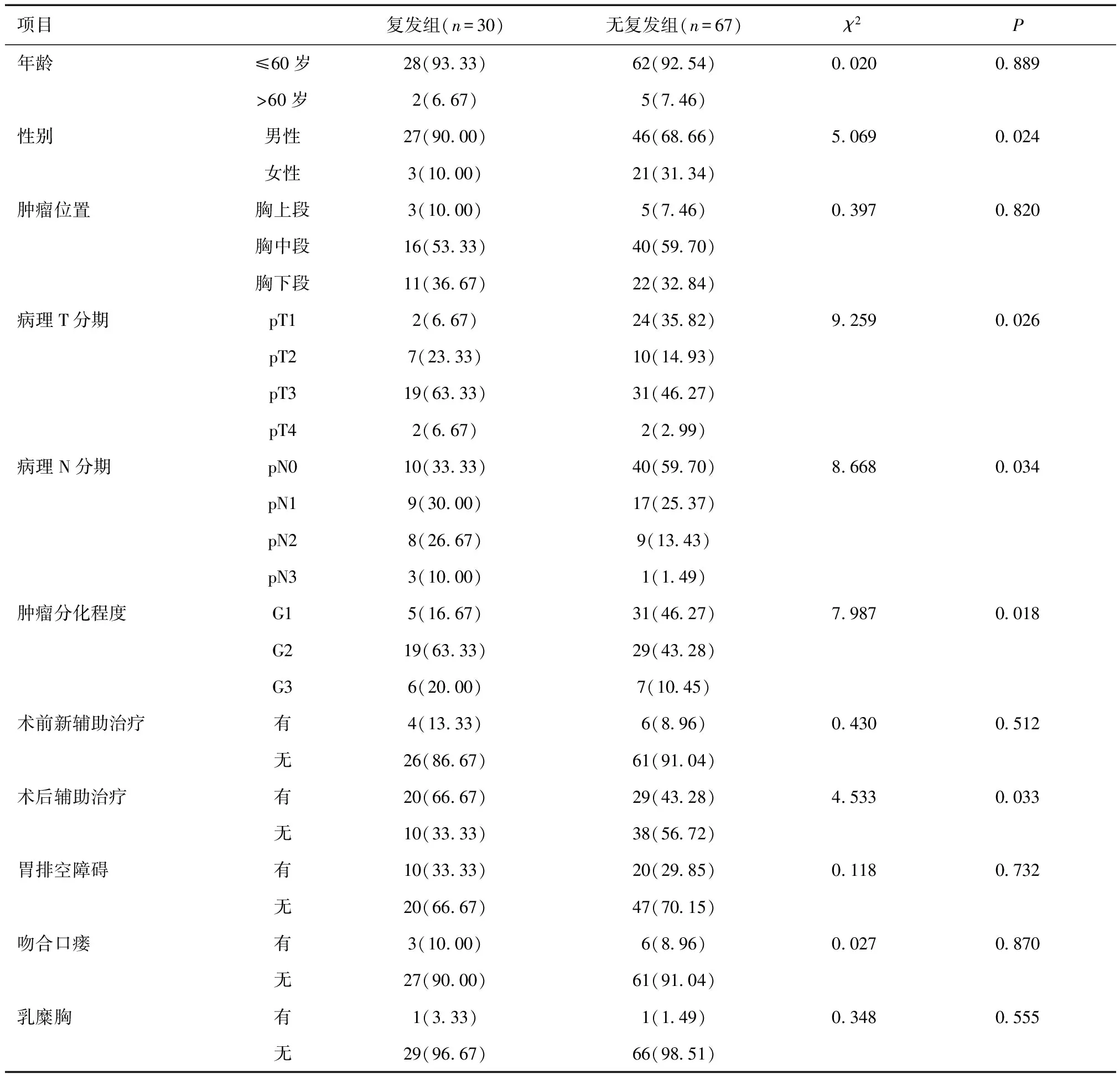
表2 复发组与无复发组临床资料比较 [n(%)]
2.4 胸段鳞癌患者预后生存的影响因素分析肿瘤浸润深度、淋巴结转移数量、肿瘤分化程度、术后辅助治疗及基础疾病种类为影响胸段鳞癌患者预后生存的独立危险因素(P<0.05)。见表3。
3 讨论
迄今为止,手术治疗都是食管癌的主要治疗手段和首选方法,1946年Lewis-Sanby首次提出以上腹正中切口为切入点的Ivor Lewis术式合以左胸后外侧为切入点的sweet术式,这两种术式都可以很好地暴露整个胸段的食管,使手术视野明确清晰,便于大范围淋巴结清扫,特别是位于喉返神经旁的上纵膈淋巴结及腹部淋巴结,而在这一方面Ivor Lewis术式优势更明显,它能更充分地显露上纵膈和腹部,更有利于彻底清扫淋巴结[8~10]。
国外有学者通过研究Ivor Lewis术式与sweet术式的优劣势和区别,发现Ivor Lewis术式胸内操作时间短,对心肺功能影响小,术后并发症少,术后恢复快,各方面比sweet略胜一筹,且近年来已逐渐得到医学专家的认可[11,12]。本研究中30例在Ivor Lewis手术后出现复发转移,30例术后复发转移患者的2、4年累计生存率分别为46.67%、20.00%,中位生存时间约为3年,67例术后无复发转移患者的2、4年累计生存率分别为88.06%、76.12%,中位生存时间未达到,术后复发转移组预后显然差于术后无复发转移组,该结果与以往研究结果相近。说明随着时间的推移,食管鳞癌患者术后生存率会逐渐降低,且术后有复发转移现象的患者生存机会相比未复发转移的会更小一些。此外,本研究发现,性别、病理T分期、病理N分期、肿瘤分化程度及有无术后辅助治疗等因素比较具有统计学差异,是可能造成胸段食管鳞癌患者术后复发的影响因素,推测其原因可能是年龄越大,身体抵抗力会更差,免疫力也会随之下降,更容易出现营养不良,营养吸收不佳等,手术不耐受率会增加,术后并发症更容易出现,死亡率也就越高;另外由于家族遗传的原因,男性患病者也比女性患病者多至两倍,男性由于吸烟酗酒等不良生活习惯,容易刺激食管黏膜,因此术后男性也更容易复发[13,14];同时,国内有研究发现,手术后辅助化疗是食管鳞癌患者预后的保护因素,因为手术不一定可以彻底将病灶完整去除,特别是微量残留的癌细胞,故术后通过辅助放化疗的方式有利于杀灭残留的微小病灶,也能有效降低患者术后复发的风险,提高其疾病生存率[15,16]。Logistic回归分析结果显示,肿瘤浸润深度、淋巴结转移数量、肿瘤分化程度、术后辅助治疗及基础疾病种类为影响胸段鳞癌患者预后生存的独立危险因素。胸段食管鳞癌患者经Ivor Lewis治疗后有30例出现复发转移,复发后造成预后不良,其主要出现在手术后4年内,特别是术后2年内,因此这个时间段应更频繁的开展随访复查。同时对于存在高复发危险因素的患者,需要制定更加个体化与专一化的随访方案。
综上所述,影响胸段食管鳞癌患者经Ivor Lewis治疗后预后生存的相关因素较多,对合并危险因素者,临床需要提前采取合理预防手段,提高患者预后生存时间。本次研究的不足之处在于样本较低,结果存在一定的局限性,结论仍然需要扩大样本进一步证实。

