小粒野生稻内生细菌的分离鉴定和促生功能分析
杨立凡 田青霖 龚禹瑞 李臻园 李庆懋 李沁妍 黄立钰 胡凤益 秦世雯
(云南大学农学院/农业农村部多年生稻生物学与种质创新重点实验室,昆明650091;#共同第一作者;*通讯作者:shiwenqin@ynu.edu.cn)
小粒野生稻(Oryza minuta)是四倍体(BBCC 基因组)、多年生的野生稻种质资源,适应性强且具有良好的稻瘟病、白叶枯病、纹枯病和稻飞虱抗性[1]。目前,研究人员已从小粒野生稻中挖掘出多个可用于栽培稻遗传改良的抗性、产量和品质相关优异基因[2]。研究还发现,小粒野生稻比栽培稻具有更为丰富的内生细菌多样性[3]。说明小粒野生稻的遗传基础和微生态对其环境和胁迫适应性起到重要作用。
植物内生菌是一类定殖于植物体内的微生物资源,对植物的生长发育具有重要影响[4]。植物内生细菌通过固氮、溶磷、解钾、分泌植物生长激素、铁载体、ACC 脱氨酶(1-aminocyclopropane-1-carboxylicacid deaminase)、抗生素或激发子等来提高植物营养吸收、促进生长、抑制病原菌和诱导植物系统性抗性[5-9]。此外,研究表明,将干旱、寒冷、高温、盐碱和污染等环境下生长的植物进行内生细菌分离,回接到寄主或非寄主植物中,可以显著提高植物在逆境条件下的生长[10-14]。因此,植物内生细菌在植物保护、绿色可持续农业发展、生态环境修复等领域具有重要的研究意义和应用开发前景。内生细菌作为小粒野生稻微生态系统的重要组成部分,对其挖掘和功能研究尚少。
多年生稻是种植一次可以连续收获多年(季)的新型稻作品种[15]。相对于一年生水稻,多年生稻从第2 季起,在稻作生产过程中不再需要买种、育秧、犁田、耙田、移栽等生产环节,而只需要田间管理和收获2 个生产环节,节约了人工投入、降低了劳动强度。多年生稻进行连续生产需采取合适的施肥手段才能保证良好的土壤结构以保障其生长发育。绿色、友好、无残留的微生物菌肥可满足多年生稻绿色轻简化的生产模式,提高多年生稻抗病虫能力、避免土壤结构恶化和环境污染。因此,本研究分离小粒野生稻的内生细菌,挖掘具有对多年生稻促生能力的细菌资源,为小粒野生稻微生态功能研究和多年生稻微生物菌肥开发提供参考。
1 材料与方法
1.1 试验材料
小粒野生稻(Oryza minuta)、多年生稻籼稻品种云大107 和粳稻品种PR23 均由农业农村部多年生稻生物学与种质创新重点实验室提供。
1.2 内生细菌的分离纯化
分别剪取小粒野生稻健康的根、茎和叶组织,无菌水冲洗表面污渍。组织表面消毒采用75%酒精浸泡2~5 min,无菌水漂洗1 次,2.5%次氯酸钠浸泡2~4 min,无菌水漂洗3 次。组织研磨后,将研磨液进行梯度稀释(10-2~10-5),取100 μL 稀释液涂布于NA 培养基[16]。吸取第3 次漂洗液涂布至NA 培养基,用来检测组织表面消毒是否彻底。28 ℃黑暗倒置培养1~3 d,待细菌菌落长出,挑取形态不同的细菌菌落进行纯化和保存。
1.3 内生菌促生功能测定
1.3.1 溶磷能力测定
在无机磷培养基[17]和有机磷培养基[18]上放置灭菌滤纸片,每个滤纸片上接种5 μL 菌液(OD600nm=1.0),以接种5 μL 的NB 培养液作为对照,28 ℃倒置培养2~3 d后观察是否形成透明圈。根据透明圈直径和菌落圈直径的比值(mP值)评估菌株的溶磷能力。
1.3.2 固氮作用检测
采取划线法,在Ashby 培养基[19]上接种内生细菌,以NB 培养液作为对照,28 ℃倒置培养2~3 d,将能够稳定生长的菌株视为固氮菌。利用引物ZehrF(5’-TGYGAYCCNAARGCNGA-3’)和ZehrR(5’-NDGCCATCATYTCNCC-3’)对菌株的固氮酶基因nifH 进行PCR 扩增,PCR 产物经琼脂糖凝胶电泳检测后测序。
1.3.3 产铁载体能力测定
在铬天青(CAS)培养基[20]上放置灭菌滤纸片,每个滤纸片上接种5 μL 菌液(OD600nm=1.0),以接种5 μL 的NB 培养液作为对照,28 ℃倒置培养2~3 d 后观察是否有橙黄色变色圈,根据变色圈直径和菌落圈直径的比值(mP值)评估菌株的产铁载体能力。
1.3.4 产吲哚乙酸能力测定
定性分析采用比色法[21],将菌株接种至King B 培养基[22]中,28 ℃、120 r/min 振荡培养2 d。吸取等体积菌悬液和Salkowski’s 试剂[23]于白色点滴板上,阳性对照为50 mg/L 吲哚乙酸(indole-3-acetic acid, IAA),阴性对照为King B 培养基。避光30 min 后观察其颜色变化,呈现粉红色说明菌株能产生IAA。
IAA 定量测定:配制浓度为10~60 mg/L 的IAA 标准品溶液,分别与Salkowski’s 试剂等体积混合,25 ℃避光反应30 min,测定OD530nm值,绘制标准曲线。将上述定性测定中具有产IAA 功能的菌株接种于King B培养基中,设置3 个重复,37 ℃、200 r/min 振荡培养48 h后,10 000 r/min 离心。取上清液与Salkowski’s 显色剂等体积混合,25 ℃避光反应30 min,测定OD530nm值。King B 培养基与Salkowski’s 试剂等体积混合为空白对照。根据IAA 标准曲线方程y=0.0195x-0.0129,R2=0.9953 计算菌株的IAA 产量。
1.4 菌株的形态学观察和分子鉴定
将菌株在NA 平板上37 ℃培养24 h 后观察单菌落形态特征。菌株在NB 培养基中,37 ℃、200 rpm 振荡培养16~24 h 后进行革兰氏染色和菌体形态特征观察。利用细菌基因组DNA 提取试剂盒提取菌株DNA后,进行16S rRNA 序列(引物序列为:5’-AGAGTTTGATCCTGGCTCAG-3’和5’-GGTTACCTTGTTACGACTT-3’)和gyrB 基因(引物序列为5’-GAAGTCATCATGACCGTTCTGCA-3’和5’-AGCAGGGTACGGATGTGCGAGCC-3’)的PCR 扩增。PCR 产物测序后在NCBI 数据库进行Blastn 比对。利用MEGA 11 软件的最大似然法(Maximum Likelihood),与NCBI 中相似性高的菌株构建16S rRNA 与gyrB 串联拼接序列的系统发育树,Bootstrap 值为1000。
1.5 促生效果测定
选取健康一致的多年生稻品种PR23 和云大107种子,用75%酒精洗2 次,每次5 min,15%次氯酸钠洗3 次,每次8 min 进行消毒。浸种处理:108cfu/mL 的菌株悬液浸泡种子12 h,对照以无菌水进行浸泡,然后催芽至露白,随后播种于苗盘中,每穴9 粒种子,每个处理3 个重复。拌土处理:将30 mL 108cfu/mL 的菌株悬液与500 g 灭菌土中混合均匀,放置于苗盆中,将催芽至露白的种子播种于苗盘中,每穴9 粒种子,每个处理3 个重复。待多年生稻长至4 叶期时测量其株高、根长、鲜质量、叶绿素和氮素含量。
1.6 数据处理
利用SPSS 17 软件对数据进行统计分析,以单因素方差分析和Duncan’s 法检验数据差异显著性,利用Graphpad Prism 8.0 软件绘图。
2 结果与分析
2.1 小粒野生稻内生细菌的分离和纯化
通过组织分离法和菌种纯化,从小粒野生稻的根、茎和叶部中分别获得40、20 和25 株内生细菌菌株,共计85 株。根部分离获得的内生细菌数量多于叶部和根部,这可能是由于土壤根际效应使得根部相较于其他组织内生细菌的种类和数量较多。
2.2 内生细菌的溶磷能力
具有溶磷效果的内生细菌可以将无机磷和有机磷培养基中难溶性磷转变为可溶性磷,使得菌落周围出现明显的透明圈(图1A 和1D)。本研究获得21 株具有溶解无机磷能力的细菌菌株,mp值在1.10~1.73 范围(图1B),22 株具有溶解有机磷能力的细菌菌株(图1E),mp值在1.10~2.05 范围。统计分析显示,茎部分离到的内生细菌溶解无机磷能力高于其他组织的内生细菌(图1C)。
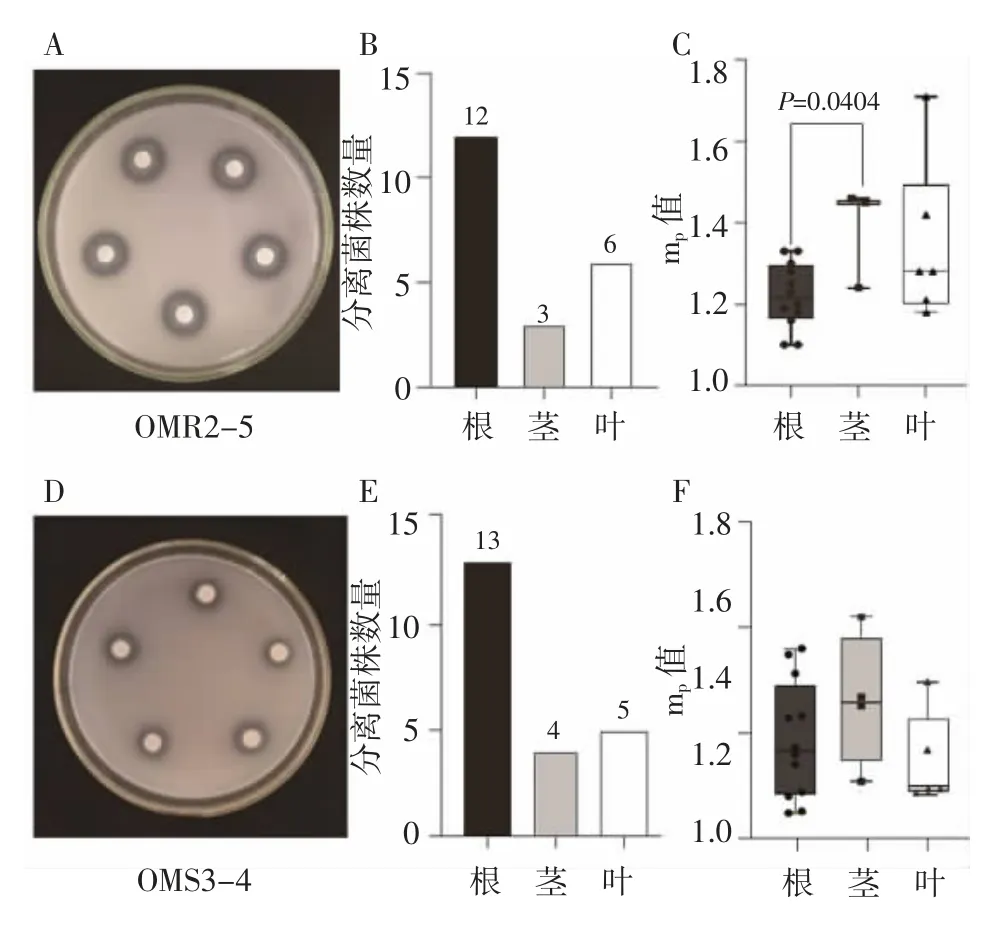
图1 具有溶磷能力的内生细菌数量及其mp 值
2.3 内生细菌的固氮作用
利用Ashby 固氮培养基对内生细菌进行培养,共有19 个内生细菌菌株可稳定生长(图2A 和2B),说明其具有固氮功能。通过固氮酶基因nifH 的PCR 扩增和测序分析发现,其中15 个菌株具有固氮酶基因nifH(图2C),说明这15 个菌株可以通过nifH 基因进行固氮作用,而未扩增出nifH 基因的4 个菌株可能通过其他机制进行固氮。

图2 具有固氮作用的内生细菌数量及其固氮酶基因nifH 的扩增
2.4 内生细菌的产铁载体能力
利用蓝色的铬天青培养基(CAS)对内生细菌进行培养,29 株的内生细菌周围呈现明显的橙黄色变色圈(图3A 和3B),mp值在1.09~4.57 范围(图3C),说明其具有产铁载体的能力。统计比较显示根、茎和叶部分离的内生细菌的产铁载体mp值无显著差异(图3C)。
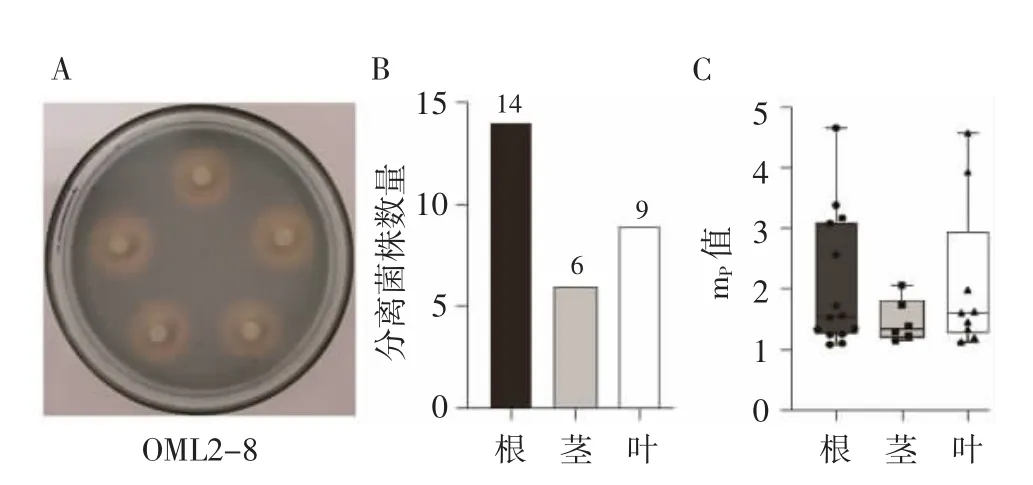
图3 产铁载体内生细菌的数量及其mP 值
2.5 内生细菌产吲哚乙酸能力
利用IAA 显色反应发现,共有13 株内生细菌在30 min 后使反应液呈现粉红色(图4 A 和4 B),说明其具有产IAA 功能。通过定量测定,13 株内生细菌的IAA 分泌量在0.12~17.22 mg/L 范围(图4 C)。其中分离自根部的OMR2-3 菌株和分离自叶部的OML3-4 菌株IAA 分泌量显著高于其他菌株,分别为17.22 mg/L 和16.59 mg/L,说明其具有较高的IAA 分泌能力。

图4 小粒野生稻中产吲哚乙酸菌株的数量及产量
2.6 OMR2-3 和OML3-4 菌株的鉴定
选取高产IAA、铁载体和固氮的OMR2-3 菌株和高产IAA、溶磷和固氮的OML3-4 菌株进行形态学和分子鉴定。结果发现,OMR2-3 菌株属于革兰氏阴性细菌,杆状,菌体大小为(0.8~1.0)μm×(2.0~3.0)μm(图5 A);在NA 培养基上单菌落为淡黄色,圆形,无凸起,表面光滑,边缘整齐,菌落大小为4~5 mm(图5 B);OMR2-3 菌株与阴沟肠杆菌ATCC 13047 菌株的16S rRNA 和gyrB 基因序列相似性最高,分别为98.11%和97.26%,并与阴沟肠杆菌134B5 菌株同处一个进化分支(图5 C),鉴定为阴沟肠杆菌(Enterobacter cloacae)。OML3-4 菌株属于革兰氏阴性细菌,杆状,菌体大小为(0.8~1.0)μm×(4.0~5.0)μm(图6A);在NA 培养基上单菌落为乳白色,圆形,无凸起,表面光滑,边缘整齐,菌落大小为2.0~3.0 mm(图6 B)。OMR3-4 菌株与路德维希肠杆菌WAB1946 菌株的16S rRNA 和gyrB 基因序列相似性最高,分别为99.58%和98.7%,并同处于一个进化分支(图6 C),鉴定为路德维希肠杆菌(Enterobacter ludwigii)。
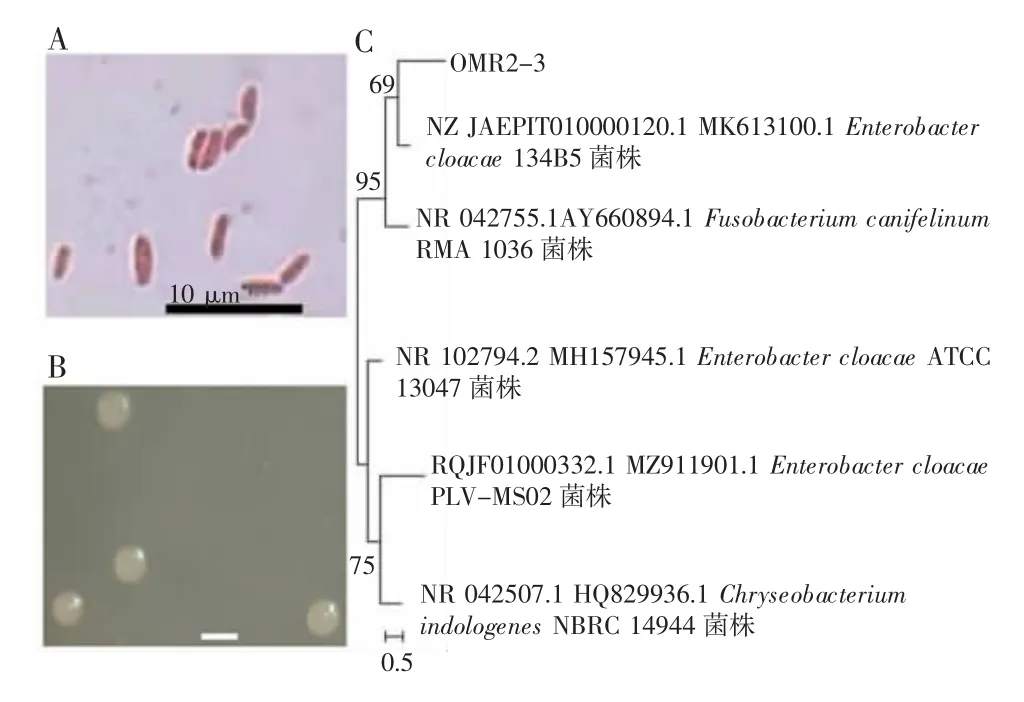
图5 阴沟肠杆菌OMR2-3 菌株鉴定及进化系统发育树
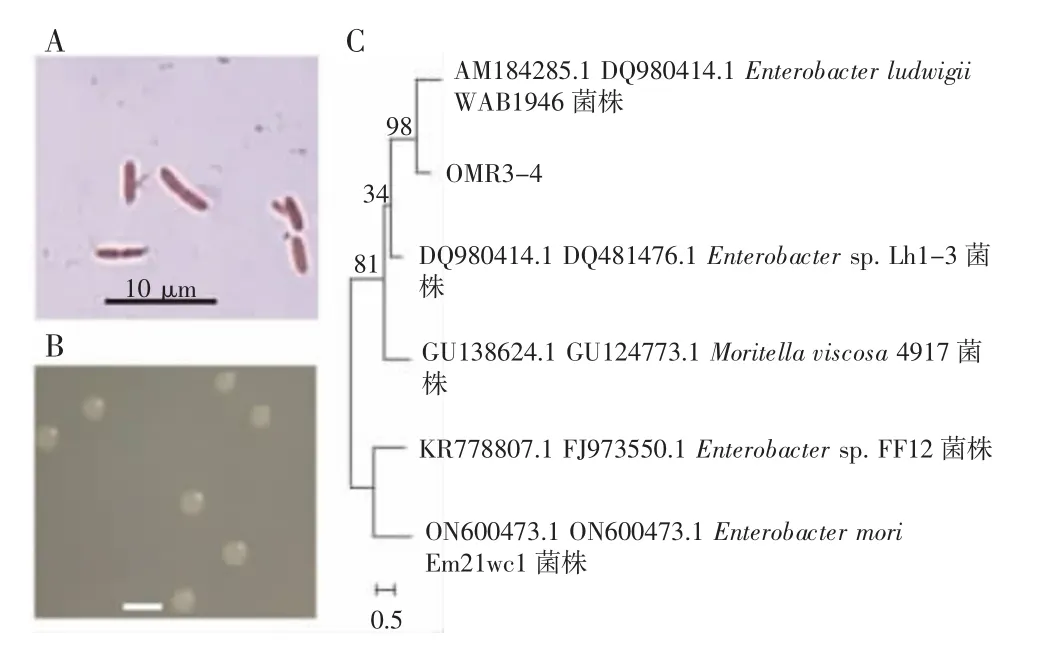
图6 路德维希肠杆菌OML3-4 菌株鉴定及进化系统发育树
2.7 OMR2-3 和OML3-4 菌株对多年生稻的促生效果
进行菌株浸种及拌土处理后,多年生稻栽种至4叶期时发现,OML3-4 和OMR2-3 菌株对多年生稻粳型品种PR23 和籼型品种云大107 均具有促生效果(图7)。OMR2-3 菌株浸种处理可显著提高PR23 的株高、根长、鲜物质量、叶绿素和氮素含量;而拌土处理对PR23 无明显促生效果。OML3-4 菌株浸种处理可显著提高PR23 的根长和叶绿素含量,拌土处理可显著提高PR23 株高、根长、鲜物质量、叶绿素和氮素含量(表1)。OMR2-3 菌株浸种处理可显著提高云大107 的鲜物质量、叶绿素和氮素含量,拌土处理可显著提高云大107的根长、鲜物质量、叶绿素和氮素含量。OML3-4 菌株浸种和拌土处理均可显著提高云大107 的根长、鲜物质量、叶绿素和氮素含量(表1)。以上结果说明,阴沟肠杆菌OMR2-3 菌株和路德维希肠杆菌OML3-4 菌株能够促进多年生稻的细胞伸长、光合作用和生物量积累。
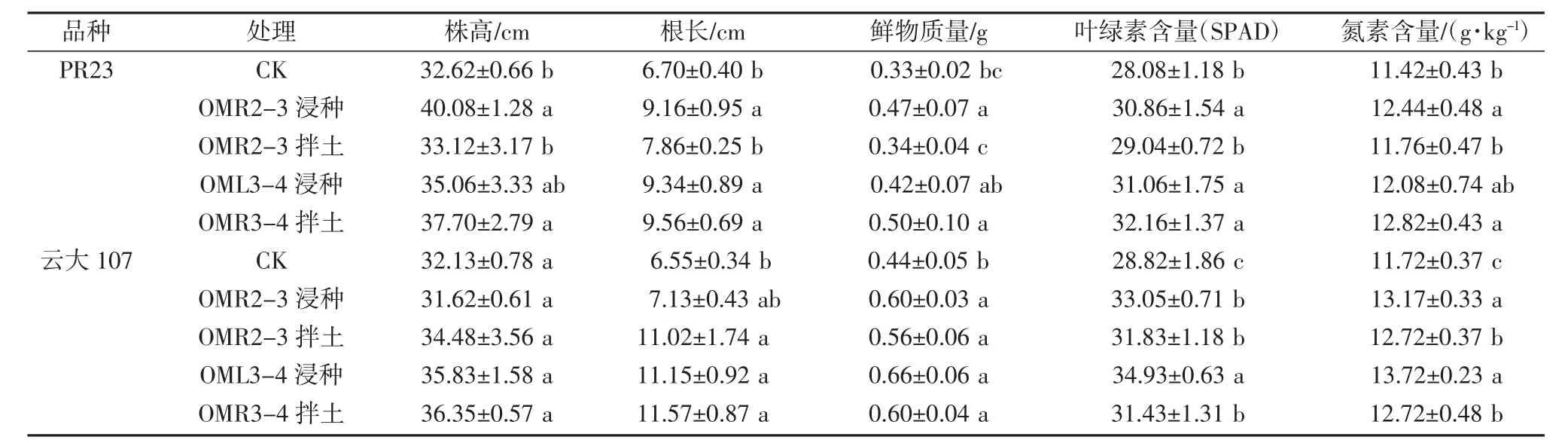
表1 阴沟肠杆菌OMR2-3 菌株和路德维希肠杆菌OML3-4 菌株对多年生稻PR23 和云大107 的促生效果

图7 阴沟肠杆菌OMR2-3 菌株和路德维希肠杆菌OML3-4菌株对多年生稻的促生效果
3 结论与讨论
内生菌是植物微生态的重要组成部分,遍布在植物组织内,与宿主形成紧密的互利共生关系。内生菌通过固氮作用、促进有机和无机营养(磷、铁和钾)的吸收、产生植物激素(吲哚乙酸、生长素、赤霉素等)等机制直接促进寄主的生长[24-27]。本研究从小粒野生稻中共筛选到具有溶磷能力内生细菌43 株,固氮内生细菌19 株,产铁载体内生细菌29 株,产IAA 内生细菌13株,分别占总分离菌株数量的50.6%、22.3%、34.1%和15.3%。已有研究从澳洲野生稻[28]、尼瓦拉野生稻[29]、南方野生稻[22]、药用野生稻[30]和普通野生稻[31]中筛选到具有以上促生功能的内生细菌。说明野生稻蕴含丰富的内生细菌资源,可作为微生物肥料和微生物菌剂开发的重要菌种筛选来源。
野生稻内生细菌能有效定殖于不同栽培稻和多年生稻品种,通过菌株特异性调控机理促进寄主生长。普通野生稻(O. rufipogon)内生无丙二酸柠檬酸杆菌(Citrobacter amalonaticus)具有固氮功能,显著提高籼型水稻华航1 号株高和鲜物质量[32]。药用野生稻(O. officinalis)内生细菌克雷伯菌(Klebsiella variicola)具有固氮、产IAA 和铁载体能力,显著提高水稻中嘉早17 号的分蘖数、株高和叶绿素含量[33]。本研究从小粒野生稻中筛选到具有固氮作用、产铁载体和IAA 的阴沟肠杆菌OMR2-3 菌株,以及具有溶磷、固氮和产IAA 的路德维希肠杆菌OML3-4 菌株,其对多年生稻PR23 和云大107 的株高、根长、鲜物质量、叶绿素和氮素含量具有不同程度的促进作用。目前研究还发现,阴沟肠杆菌和路德维希肠杆菌分别对烟草[34]和小麦[35]也具有促生作用。因此深入研究野生稻内生细菌介导的促生效应,将有助于定向改善水稻对环境的适应性及其生产力,为水稻生物育种及增产提供新途径。
植物种子内生菌群是建立植物内生菌群的基础,种子内生菌群能够随着种子萌发转移至幼苗,促进寄主生长发育[36]。本研究采用菌株浸种和拌土方法来构建多年生稻种子内生菌群,结果发现,OMR2-3 菌株拌土处理对多年生稻PR23 无显著促生作用,可能是由于土壤微生物的稀释效应[37]对OMR2-3 菌株的运动和定殖起到了负面影响。因此,针对不同菌株需采取适宜的接种方法,建立多年生稻生态菌肥的播种和田间管理措施,精准培育“多年生稻-微生物共生体”。本研究仅进行了2 株菌株的多年生稻促生效果评价,后续还需挖掘更多的多年生稻促生菌株,深入分析促生菌株的大田长期效应及对农业生态的影响,构建多年生稻“促生微生物组”,助力多年生稻绿色轻简化生产。

