鸽源白色念珠菌的分离鉴定及药物敏感性分析
程相宁,张 韵,何佳蔚,陈政锟,金美兰,丁红雷*,王庆华*
(1.西南大学动物医学院动物支原体学实验室,重庆 400715;2.西南大学实验动物中心,重庆 400715)
白色念珠菌(Candidaalbicans)又名白假丝酵母菌,是广泛存在于人和动物皮肤、口腔、上呼吸道等处的一种条件性致病真菌[1]。家禽的白色念珠菌病又称霉菌性口炎,俗称鹅口疮,多见于幼龄鸡、鸽、火鸡和鹅,表现为上消化道黏膜形成白色假膜,甚至出现溃疡[2];造成患禽脾、胸腺、哈德氏腺、法氏囊、骨髓等免疫器官萎缩,引起免疫抑制,进而容易导致其它病原的继发感染[3]。人和哺乳动物较少发病。
禽白色念珠菌病是一种条件性疾病,当菌群失调或宿主抵抗力较弱时,以及饲养管理不善和饲养环境差就会发生;以幼龄禽多发,成年禽亦有发生。该病发生以夏秋炎热多雨季节为甚。病禽和带菌禽是主要传染来源。病原通过分泌物、排泄物污染饲料、饮水经消化道感染。整体发病率不高,国内外报道较少。但近年来鸽白色念珠菌病的发生在我国呈上升趋势,给养鸽业带来极大经济损失。雏鸽感染主要是通过带菌亲鸽的“鸽乳”而传染。2020年10月,重庆某鸽场出现大批幼鸽喉头被黄色干酪样物堵塞无法进食,最终导致死亡的现象。本课题组采集样品后进行了病原分离鉴定、人工感染试验及药物敏感性测定,找到了引起该鸽场雏鸽发病的病原,为该鸽场此类传染病的防控提供了依据。
1 材料与方法
1.1 病料采集
重庆某鸽场1~3周龄幼鸽出现喉头被干酪样物阻塞导致无法进食、最终死亡的现象。在该鸽场取5只有上述典型症状的幼鸽带回实验室。用乙醚将鸽子麻醉后剪开颈部左侧动脉放血,至血液流干净后待下一步解剖处理。
1.2 主要试剂、培养基及参考菌株
快速DNA提取检测试剂盒购自天根生化科技(北京)有限公司;3-(N-吗啡啉)丙磺酸-游离酸(3-(N-Morpholino) propane-sulfonic acid,MOPS)、2×SanTaqMaster Mix购自生工生物工程(上海)股份有限公司;革兰染色试剂盒购自北京索莱宝科技有限公司;乳酸酚棉蓝染色液购自北京酷来搏科技有限公司;胎牛血清、RPMI 1640培养基购自美国Gibco公司;氟苯尼考购自上海阿拉丁生化科技股份有限公司;灰黄霉素、培氟沙星购自上海麦克林生化科技有限公司;水溶性两性霉素B、制霉菌素、克霉唑购自南京都莱生物技术有限公司;马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基购自北京索莱宝科技有限公司;酵母浸出粉胨葡萄糖琼脂(Yeast extract peptone dextrose agar,YEPD)培养基由本实验室制备。白色念珠菌CMCC(F)98001菌株购自青岛高科技工业园海博生物技术有限公司。
1.3 病原分离
无菌操作取病鸽喉头、嗉囊、腺胃、肌胃、心、肺、肝、肾、脾,以接种环轻刮病鸽的嗉囊、腺胃、肌胃内表面以及无菌切开的喉头干酪样物、心、肺、肝、肾、脾内部,划线接种含1%庆大霉素PDA平板,28 ℃恒温培养箱培养3~4 d,每天观察菌落生长情况;待长出菌落后用接种环挑取平板上单个菌落再次划线接种含1%庆大霉素PDA平板进行纯培养,3 d后观察菌落形态,并挑取单菌落进行革兰染色和棉蓝染色(根据说明书进行操作),染色后在400倍显微镜下镜检。
1.4 病原的分子生物学鉴定
根据镜检结果,挑取对应的单菌落接种YEPD液体培养基,30 ℃、200 r·min-1摇床培养20 h。取1 mL菌液置于1.5 mL离心管,10 000 r·min-1室温离心1 min,弃上清,沉淀用快速DNA提取检测试剂盒提取分离菌株基因组,制备DNA模板。根据文献报道[4]设计PCR扩增引物CaF:5′-TTTATCAACTTGTCACACCAG-3′和CaR:5′-ATCCCGCCTTACCACTACCG-3′。PCR反应体系:2×SanTaqPCR mix 12.5 μL,CaF、CaR各1 μL(10 mmol·L-1),ddH2O 9.5 μL,模板1 μL。反应条件:94 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃延伸10 min。1.5%琼脂糖凝胶电泳检测扩增产物。扩增的目的片段为白色念珠菌rDNA基因间转录间隔区序列。扩增的片段送生工生物工程(上海)股份有限公司测序。测序结果进一步进行BLAST序列比对。
1.5 芽管生成试验
于载玻片上滴加5 μL胎牛血清,用接种环挑取单菌落与血清混合均匀,盖上盖玻片,37 ℃培养,每小时在显微镜下镜检,3 h内观察到芽管生成判定为芽管生成阳性。
1.6 动物回归试验
21只3日龄健康雏鸡购自重庆某种鸡场,经病原学检测为白色念珠菌阴性。随机取14只为试验组,其余7只为对照组。取分离菌CAL2020P8接种20 mL YEPD液体培养基,30 ℃、200 r·min-1培养20 h,用灭菌PBS将菌液浓度调整为1×107CFU·mL-1,以1 mL·只-1的剂量嗉囊接种试验组鸡,对照组嗉囊注射等量灭菌PBS。两组鸡隔离,常规饲养。接种后每天观察鸡的精神、饮食、粪便等情况。每3 d宰杀试验组鸡2只与对照组鸡1只。按“1.3”的方法取嗉囊和肝等组织分离病原。取每只鸡的嗉囊、肝、肾,保存于40 mL·L-1甲醛固定液中,送成都里来生物医学实验中心制作组织切片,并将切片进行苏木精-伊红(hematoxylin-eosin,HE)染色与高碘酸-希夫染色(periodic acid-Schiff,PAS)染色,显微镜下观察组织学病变和病原生长情况。
1.7 药物敏感性试验
根据《肉汤稀释法抗真菌敏感性试验参考方法(第四版)》(CLSI M27-A4)[5],采用微量肉汤稀释法检测分离菌株对抗菌药物的敏感性。使用的抗真菌药物包括两性霉素B、制霉菌素、灰黄霉素和克霉唑,抗细菌药物包括氟苯尼考和培氟沙星。两性霉素B耐药折点按《抗真菌药敏试验的流行病学临界值(第三版)》(CLSI M59)[6]耐药折点判读,制霉菌素和克霉唑耐药折点根据文献[7-8]给定的耐药折点耐药折点。
2 结 果
2.1 菌株分离鉴定
病鸽的喉头被黄色干酪样物堵塞(图1),造成其无法吞咽食物和水。其他组织器官无肉眼可见的病变。在5只病鸽的喉头干酪样物分离到5株菌,命名为CAL2020P1~CAL2020P5;在嗉囊分离到3株菌,命名为CAL2020P6~CAL2020P8。在腺胃、肌胃、心、肺、肝、肾、脾中未分离到病原。
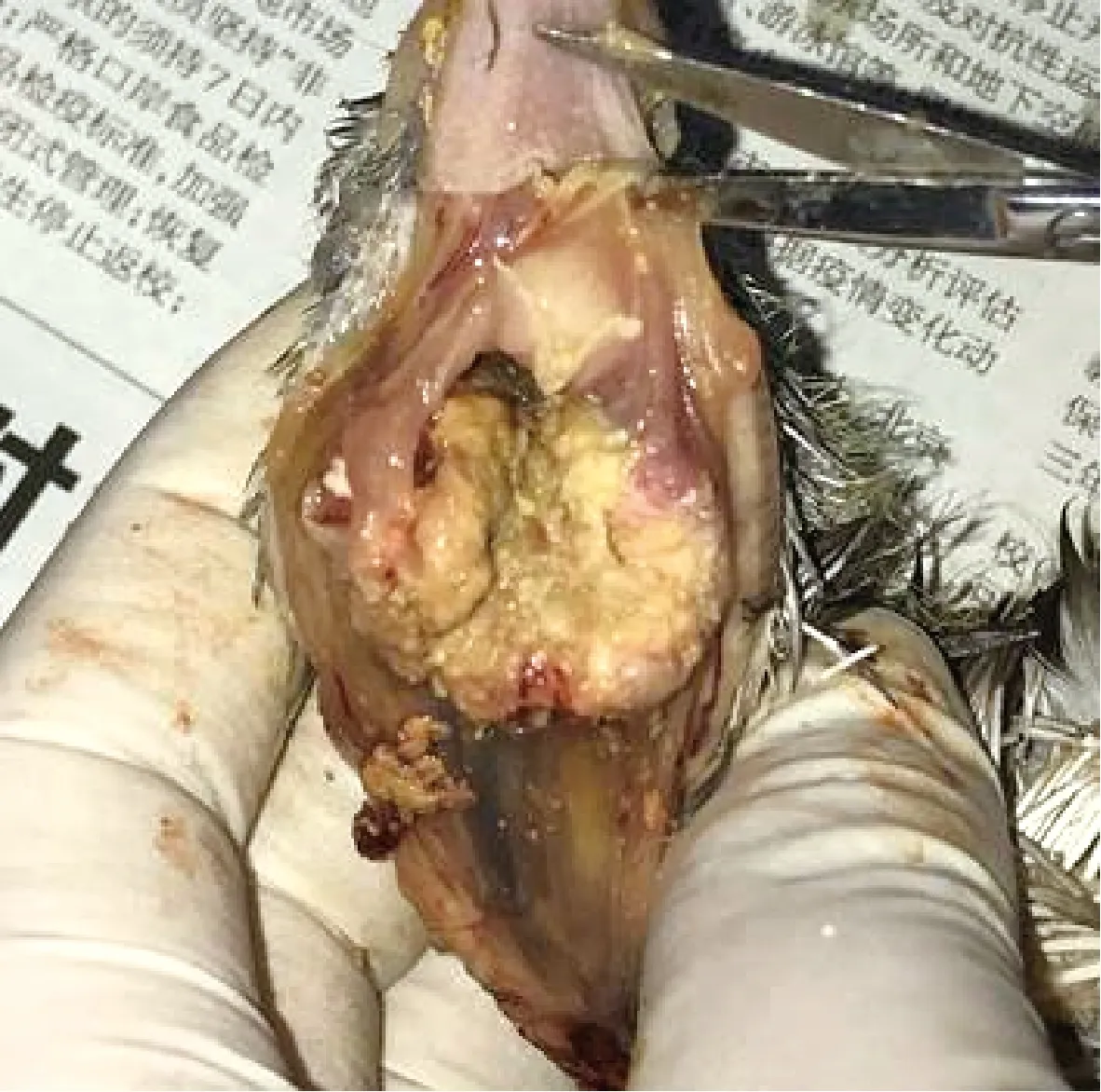
图1 患鸽喉头被干酪样物堵塞Fig.1 The larynx of the affected pigeon is blocked by caseous substance
分离的菌株使用白色念珠菌特异性引物进行PCR扩增,所有分离株均能扩增出与预期片段大小相同的约500 bp的片段(图2)。扩增的rDNA基因间转录间隔区序列测序后进行BLAST序列比对,所有菌株扩增片段的核苷酸序列完全一致,且与白色念珠菌rDNA基因间转录间隔区序列最为相似(图3),其中与白色念珠菌44(GenBank accession number:OP627169.1)的序列完全一致,与其它白色念珠菌,如Gm(GenBank accession number:OP629553.1)、29_v9g_F(GenBank accession number:OP601587.1)、J115(GenBank accession number:OP824698.1)等的rDNA基因间转录间隔区序列的相似性也超过98.5%。
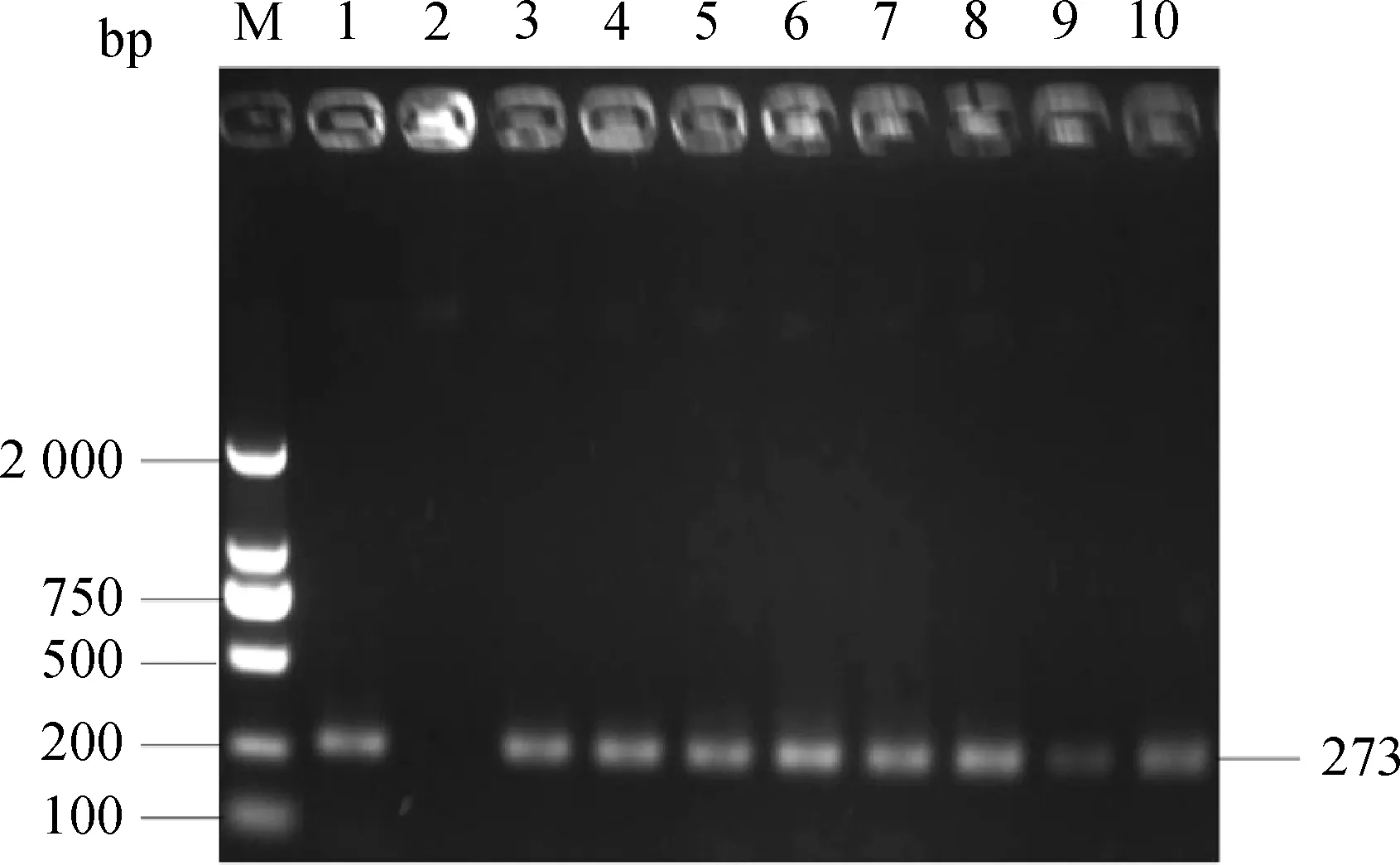
M.DNA marker;1.阳性对照CMCC(F)98001;2.阴性对照;3.CAL2020P1;4.CAL2020P2;5.CAL2020P3;6.CAL2020P4;7.CAL2020P5;8.CAL2020P6;9.CAL2020P7;10.CAL2020P8M.DNA marker; 1.Positive control CMCC(F)98001;2.Negative control;3.CAL2020P1; 4.CAL2020P2; 5.CAL2020P3; 6.CAL2020P4; 7.CAL2020P5; 8.CAL2020P6; 9.CAL2020P7; 10.CAL2020P8图2 PCR扩增白色念珠菌rDNA基因间转录间隔区序列Fig.2 Amplification of the intergenic transcriptional spacer sequence of rDNA gene from Candida albicans by PCR
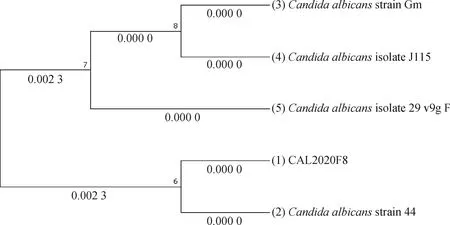
图3 分离菌rDNA基因间转录间隔区序列系统发育树Fig.3 Phylogenetic trees of the isolated bacteria based on intergenic transcriptional spacer sequence of rDNA
分离菌株在含1%庆大霉素PDA平板上生长为乳白色、不透明、边缘呈放射状的菌落(图4A、B)。对分离菌株进行革兰染色,病原菌在400倍显微镜下呈卵圆形、黑色或粉紫色着色不均匀的革兰阳性酵母样菌体, 有些长出芽体(图4C);棉蓝染色显示菌体长出长长的菌丝(图4D)和孢子(图4D,a)。所有分离菌在胎牛血清中孵育3 h内,在显微镜下均观测到芽管生成(图4E)。
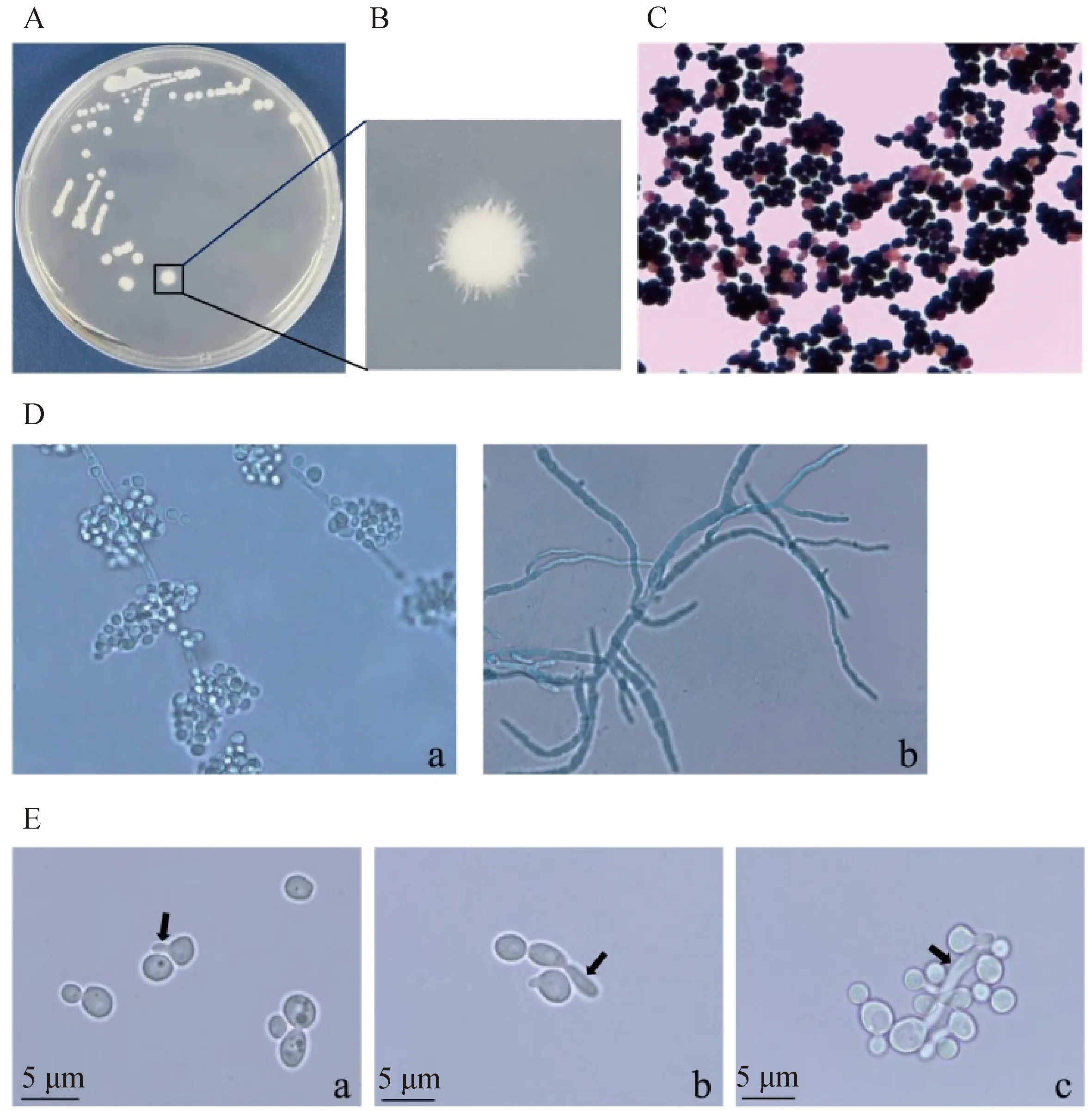
A和B. 白色念珠菌在含1%庆大霉素PDA平板的菌落形态;C. 白色念珠菌革兰染色后的真菌形态;D. 白色念珠菌棉蓝染色后的孢子和菌丝形态(a. 白色念珠菌的孢子和菌丝形态;b. 白色念珠菌的菌丝形态);E. 白色念珠菌形成的芽管(a. 孵育1 h;b. 孵育2 h;c. 孵育3 h)A and B. Colony morphology of Candida albicans on PDA plate containing 1% gentamicin; C. Fungal morphology of Candida albicans after Gram staining; D. Morphology of spores and hyphae of Candida albicans after cotton blue staining (a. Morphology of spores and hyphae of Candida albicans; b. Morphology of hyphae of Candida albicans); E. Germ tubes of Candida albicans (a. Incubate for 1 h; b. Incubate for 2 h; c. Incubate for 3 h)图4 白色念珠菌CAL2020P8的菌落形态、真菌形态及芽管生成Fig.4 Colony morphology, fungal morphology and germ tube formation of Candida albicans strain CAL2020P8
根据分子生物学鉴定结果、菌落形态和真菌形态、生化特性,确定分离的病原为白色念珠菌。
2.2 动物回归试验
试验组鸡在接种菌株CAL2020P8后第3天出现采食量下降,嗉囊触之较为坚硬;随着感染时间延长,上述症状逐渐加重;在感染后第9天症状最严重,之后逐渐减轻;从第12天开始,部分鸡的临床症状逐渐消失,至第21天所有鸡的临床症状均消失。未接种病原的对照组没有出现任何临床症状。在感染后的第3、6、9、12、15、18、21天每天宰杀试验组鸡2只和对照组鸡1只,进行剖检。结果可见在感染第9天病变最为严重,嗉囊明显增厚、上有白色物质附着(图5);感染第12天后病变逐渐减轻且在感染第21天消失。
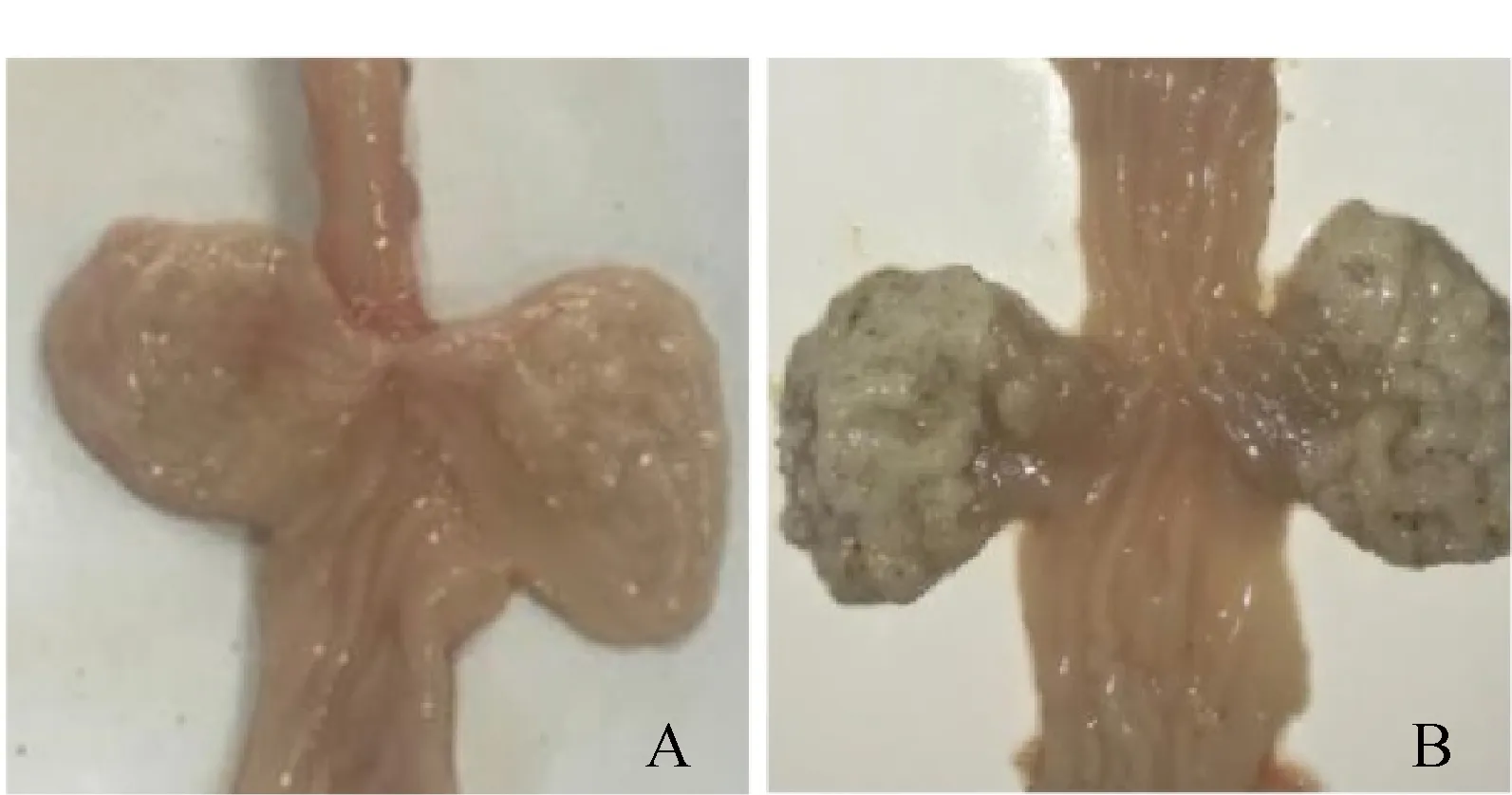
A. 对照组鸡的嗉囊;B. 试验组鸡的嗉囊A. Crop of chicken from control group; B. Crop of chicken from tested group图5 鸡接种白色念珠菌第9天的嗉囊病变Fig.5 Crop lesions of chicken inoculated with Candida albicans on the 9th day
2.3 组织切片染色与观察
将人工感染后第3、6、9、12、15、18、21天的嗉囊、肝、肾制作组织切片,分别进行HE染色和PAS染色。肝、肾的HE切片未见任何病变,PAS染色也未见白色念珠菌感染。嗉囊HE染色的结果显示:感染第3天时表皮角质层开始脱落(图6A、F);感染第6天时表皮的鳞状上皮细胞开始变性坏死、脱落(图6B、G);感染第9天时表皮鳞状上皮细胞变性坏死现象达到高峰(图6C、H);感染第12天时表皮出现轻微结痂(图6D、I);感染第21天时表皮基本恢复,只有部分角质层未完全恢复(图6E、J);对照组无任何病变(图6K~O)。
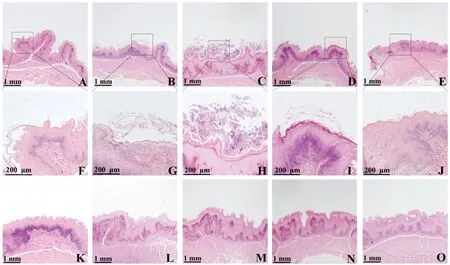
A. 感染3 d的嗉囊(20×);B. 感染6 d的嗉囊(20×);C. 感染9 d的嗉囊(20×);D. 感染12 d的嗉囊(20×);E. 感染21 d的嗉囊(20×);F. 感染3 d的嗉囊(100×);G. 感染6 d的嗉囊(100×);H. 感染9 d的嗉囊(100×);I. 感染12 d的嗉囊(100×);J. 感染21 d的嗉囊(100×);K. 灌服PBS 3 d的嗉囊(20×);L. 灌服PBS 6 d的嗉囊(20×);M. 灌服PBS 9 d的嗉囊(20×);N. 灌服PBS 12 d的嗉囊(20×);O. 灌服PBS 21 d的嗉囊(20×)A. Crop after infection on day 3 (20×); B. Crop after infection on day 6 (20×); C. Crop after infection on day 9 (20×); D. Crop after infection on day 12 (20×); E. Crop after infection on day 21 (20×); F. Crop after infection on day 3 (100×); G. Crop after infection on day 6 (100×); H. Crop after infection on day 9 (100×) ; I. Crop after infection on day 12 (100×); J. Crop after infection on day 21 (100×); K. Crop on day 3 after PBS administration (20×); L. Crop on day 6 after PBS administration (20×); M. Crop on day 9 after PBS administration (20×); N. Crop on day 12 after PBS administration (20×); O. Crop on day 21 after PBS administration (20×)图6 白色念珠菌感染鸡后不同时间点嗉囊的组织病理变化(HE染色)Fig.6 Histopathological changes of crop in chicken infected with Candida albicans at different time points (HE staining)
PAS染色的结果显示:感染第3天时开始在表皮角质层出现白色念珠菌菌丝(图7A、F);随着感染时间延长,菌丝数量逐渐增加(图7B、G);在感染第9天时达到高峰(图7C、H);之后菌丝数逐渐下降(图7D、I),并在第21天时完全消失(图7E、J);在对照组嗉囊未见白色念珠菌(图7K~O)。
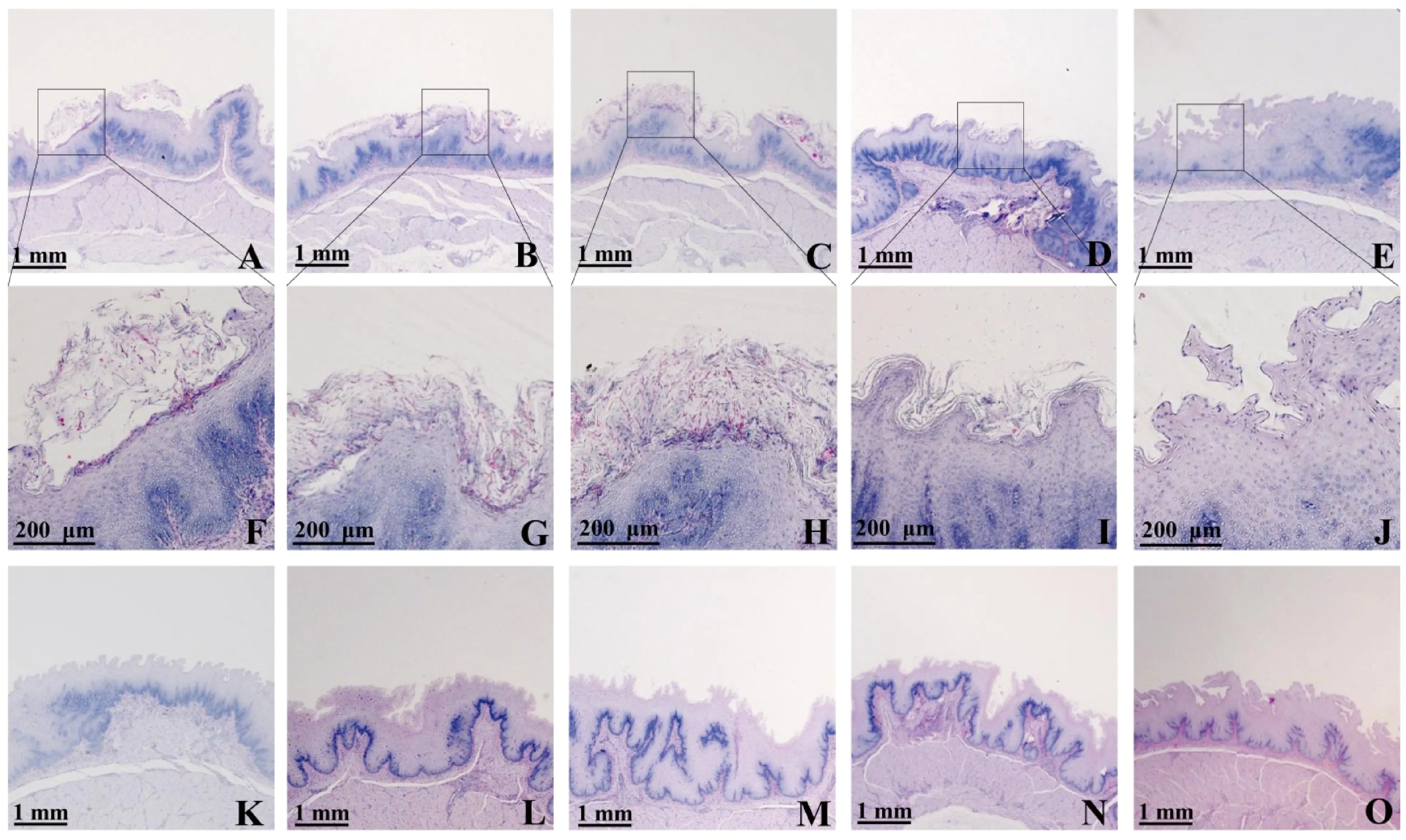
A. 感染3 d的嗉囊(20×);B. 感染6 d的嗉囊(20×);C. 感染9 d的嗉囊(20×);D. 感染12 d的嗉囊(20×);E. 感染21 d的嗉囊(20×);F. 感染3 d的嗉囊(100×);G. 感染6 d的嗉囊(100×);H. 感染9 d的嗉囊(100×);I. 感染后12 d的嗉囊(100×);J. 感染21 d的嗉囊(100×);K. 灌服PBS 3 d的嗉囊(20×);L. 灌服PBS 6 d的嗉囊(20×);M. 灌服PBS 9 d的嗉囊(20×);N. 灌服PBS 12 d的嗉囊(20×);O. 灌服PBS 21 d的嗉囊(20×)A. Crop after infection on day 3 (20×); B. Crop after infection on day 6 (20×); C. Crop after infection on day 9 (20×); D. Crop after infection on day 12 (20×); E. Crop after infection on day 21 (20×); F. Crop after infection on day 3 (100×); G. Crop after infection on day 6 (100×); H. Crop after infection on day 9 (100×) ; I. Crop after infection on day 12 (100×); J. Crop after infection on day 21 (100×); K. Crop on day 3 after PBS administration (20×); L. Crop on day 6 after PBS administration (20×); M. Crop on day 9 after PBS administration (20×); N. Crop on day 12 after PBS administration (20×); O. Crop on day 21 after PBS administration (20×)图7 白色念珠菌感染鸡后不同时间点嗉囊中白色念珠菌菌丝生长情况(PAS染色)Fig.7 Growth of Candida albicans mycelium in crop after infection of chicken at different time points (PAS staining)
2.4 药物敏感性结果
测定8株白色念珠菌分离株对4种抗真菌药物和2种抗细菌药物的敏感性。由表1可见,分离菌株对两性霉素B、制霉菌素、克霉唑敏感,对灰黄霉素的最低抑菌浓度(minimal inhibitory concentration,MIC)均>64 μg·mL-1,对氟苯尼考和培氟沙星的MIC均>512 μg·mL-1。
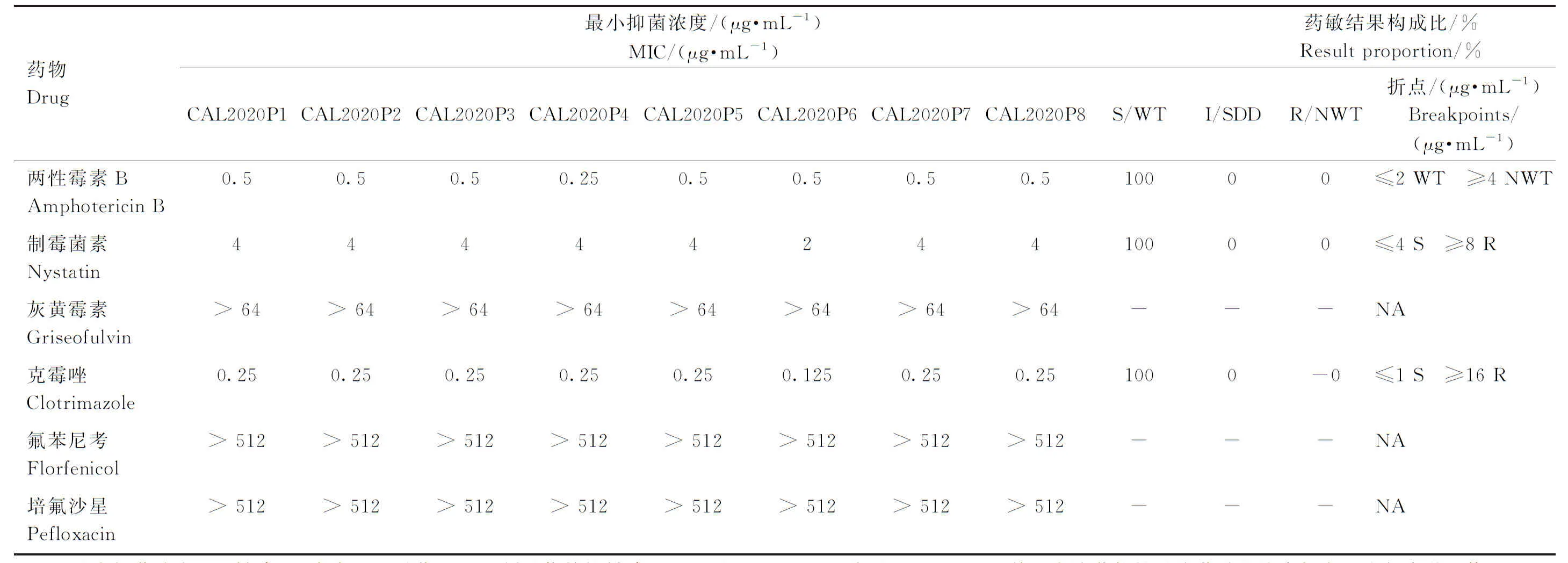
表1 白色念珠菌分离株对4种抗真菌药物和2种抗细菌药物的药物敏感性Table 1 The susceptibility of 4 antifungals and 2 antimicrobials to Candida albicans isolates
2.5 白色念珠菌的再分离及鉴定
试验组和对照组鸡剖检后,采集喉头干酪样物、嗉囊进行白色念珠菌的再分离。刮取所有感染组鸡的两个部位接种含1%庆大霉素PDA平板,均有菌长出;使用白色念珠菌rDNA基因间转录间隔区序列引物,在分离菌均能扩增出270 bp左右的片段,说明能在这些部位再次分离出白色念珠菌。而对照组的相应部位接种1%庆大霉素PDA平板,没有菌长出。
3 讨 论
白色念珠菌在自然界广泛存在,是健康动物上呼吸道和肠道等处的常在菌。尽管在健康和发病家禽中都分离到另外一些念珠菌,但白色念珠菌是导致家禽发病的最主要病原。念珠菌病又名鹅口疮,是一种内源性的条件性真菌病。禽类的念珠菌病最易发生在口腔和嗉囊。鸡、火鸡、鹅、鸽、珍珠鸡、雉、翎颌松鸡、鹌鹑、孔雀、吸蜜鹦鹉、小鹦鹉、鹦鹉和长尾小鹦鹉都有发生过念珠菌病的报道[2,9]。家禽念珠菌病往往呈散在发生,且主要发生于幼龄禽。现阶段我国家禽中发生念珠菌病的报道较为少见[10]。
根据发病鸽场负责人介绍,近年来,我国广东省很多养鸽场出现幼鸽喉头被干酪样物堵塞,最终导致无法进食而死亡的情况。而该养殖场的鸽子则购自广东省曾经暴发过此类疾病的鸽场。根据幼鸽出现的临床症状,作者初步怀疑该病是念珠菌病或毛滴虫病。
在病原的鉴定中,除了进行常规的菌落和病原菌形态观察,作者还通过棉蓝染色确定了分离菌菌丝和孢子的存在,通过芽管生成试验确定了分离菌芽管的生成。根据上述结果以及此次疫情的流行病学、病鸽的临床症状和病理剖检变化,初步判定分离的病原为白色念珠菌。为了进一步确认,作者扩增了白色念珠菌的rDNA基因间转录间隔区序列,通过序列测定确定扩增的基因片段和白色念珠菌rDNA基因间转录间隔区序列片段的核苷酸序列完全一致。最终确定从发病幼鸽分离的菌株为白色念珠菌,并通过动物试验证明了分离菌株的致病性。作者还采集病料检查了幼鸽是否感染毛滴虫,结果在显微镜下没有观察到毛滴虫的存在。因此,作者确定造成该鸽场幼鸽发病的病原为白色念珠菌。
幼鸽出生后需要母鸽喂食一个月左右才能独立采食。该鸽场虽然出现幼鸽念珠菌病的暴发,但未见青年鸽和母鸽发病,虽然在母鸽和青年鸽的喉头和嗉囊也能分离到白色念珠菌。这说明白色念珠菌主要导致不能独立进食的幼鸽发病;而对于成年鸽,白色念珠菌是其上消化道的常在病原。
在动物回归试验中,用鸽作为感染动物是最好的选择。但由于鸽的养殖企业和养殖户较少,作者没有找到无特定病原体(specific pathogen free,SPF)鸽。考虑到白色念珠菌也能导致鸡发病,作者选择使用白色念珠菌阴性的雏鸡作为攻毒动物。试验结果表明,在幼鸽分离的白色念珠菌具有较强的致病力,能导致鸡发病。这进一步说明导致鸽场发病的病原是白色念珠菌。
作者测定了分离菌株对部分抗菌药物的敏感性。结果显示抗细菌药物对分离菌完全无效;分离菌对两性霉素B、制霉菌素和克霉唑敏感;虽然没有灰黄霉素对白色念珠菌的耐药标准,但灰黄霉素对分离菌的MIC均大于64 μg·mL-1。根据药敏试验结果,鸽场投喂了制霉菌素,同时还加强了鸽场的生物安全措施,如通风、消毒以及粪便清理,但没有明显减少幼鸽的发病。作者分析出现此种情况可能有如下原因:一是由于幼鸽不能自由采食,需要母鸽喂养,因此鸽场实际是向母鸽投喂药物,再由母鸽将混有药物的饲料喂给幼鸽,这就造成幼鸽接受的药物没有达到治疗的剂量。二是白色念珠菌具有复杂的致病和耐药机制。白色念珠菌形成的生物膜对大多数已知的抗真菌药物天然具有抗性,如多烯类药物(包括制霉菌素和两性霉素B)对白色念珠菌生物膜无效[3]。此外,白色念珠菌还能上调药物外排泵的表达[11-12],大量分泌细胞外基质导致药物无法进入细胞内[13-14]等。
考虑到现有药物对鸽白色念珠菌病的治疗效果,鸽场应按照《中华人民共和国动物防疫法》要求,及时淘汰和无害化处理所有鸽。之后对鸽场进行彻底的消毒,直至清除鸽场中所有的白色念珠菌。然后再从没有暴发过传染病的鸽场购入新的鸽。鸽场在今后的养殖过程中也应加强生物安全措施,如入场车辆、人员、物资的清洗消毒,鸽场消毒药的选择及合适消毒频率的确定,鸽场粪便的清理等。此外,鸽场还可制备白色念珠菌卵黄抗体[15]饲喂种鸽,用于预防白色念珠菌感染。
4 结 论
从暴发某种传染病鸽场的发病幼鸽分离到8株真菌,通过分离培养、分子生物学鉴定和动物回归试验等确定导致该鸽场发病的病原为白色念珠菌,药物敏感性试验测定发现分离菌对两性霉素B、制霉菌素和克霉唑敏感。对鸽场投喂制霉菌素不能减少鸽的发病。因此建议鸽场对鸽进行淘汰和无害化处理,对鸽场进行全面彻底的消毒。对之后新购入鸽加强检疫和提高生物安全防控措施,以防再次发生类似疫情。

