不同保鲜剂对爆杖花切花的保鲜效果
杨秀梅,张艺萍,赵阿香,王丽花,解玮佳
(云南省农业科学院 花卉研究所/国家观赏园艺工程技术研究中心/云南省花卉育种重点实验室,云南 昆明 650205)
爆杖花(Rhododendron spinuliferum)为杜鹃花属、糙叶杜鹃亚属(Subgen.Pseudorhodorastrum)植物,主要分布于云南中部、北部和西部及四川西南部,是我国西南地区特有的观赏和药用植物[1-2]。爆杖花花期为2—6月,花期早且长达4个月[3];花序伞形,花色朱红、鲜红或橙红;花形筒状,形似炮仗。因其观赏价值高,而深受人们喜爱[4-5]。
我国切花市场的花卉大多为外来品种,中国特有的传统花卉应用较少[6]。杜鹃花作为中国传统名花,观赏价值高,栽培历史悠久,文化内涵丰富,其作为盆栽花也深受消费者欢迎,但目前以杜鹃花作为切花材料在市场上还未有成熟的商品[7]。云南省农业科学院花卉研究所于2018年开始对分布于云南昆明地区的野生杜鹃爆杖花进行了引种栽培并获得了成功。栽培后的爆杖花枝叶繁茂、花序饱满、花色艳丽,极具切花观赏特质。因爆杖花具有花期早且长、花型奇特的优点,具备被开发成为“年宵花”的潜质,因此爆杖花切花材料极具开发和利用价值。
为进一步促进爆杖花切花的应用和推广,开展切花保鲜技术的研究很有必要。目前国内杜鹃花切花的开发利用及保鲜研究尚处于起步阶段,郭碧花[8]分别以蔗糖、8-羟基喹啉、水杨酸、硝酸银和蒸馏水配置了5种保鲜剂,研究了保鲜剂对切花保鲜时长的影响,结果表明3种水杨酸处理均可促进花枝吸水、增大花径和维持切花水分平衡,有效提高了切花的观赏品质。汪劲松[9]开展了瓶插杜鹃花游离脯氨酸含量和可溶性蛋白的变化研究,结果表明杜鹃切花经50 mg/L 6-BA+200 mg/L 8-HQS+100 mg/L CA+2%蔗糖处理后,可以明显降低游离脯氨酸上升的幅度和延缓可溶性蛋白降解的速度,从而延缓切花衰老。郑芳等[10]探索了红珊瑚杜鹃(Rhododendron hybridum‘Hong Shanhu’)和锦绣杜鹃(Rhododendron pulchrum)2种杜鹃花切花开放和衰老过程中活性氧代谢及其清除系统的变化情况,发现活性氧清除酶在花瓣衰老过程中具有重要作用。
鉴于爆杖花具有开发为切花的潜质和优势,本试验以人工栽培的爆杖花为材料开展瓶插试验,选用市场销售的3种切花保鲜剂对爆杖花花枝进行保鲜处理,测定瓶插过程中其丙二醛含量、细胞质膜透性、水分平衡值及菌落总数的动态变化,评价其瓶插观赏效果及确定其瓶插期,以期为爆杖花及野生杜鹃花资源的合理开发利用提供参考。
1 材料与方法
1.1 试验材料
供试的爆杖花花枝采自云南省农业科学院花卉研究所试验基地的5年生实生苗植株。选取花枝健壮无病虫害,花朵雌蕊柱头伸出筒状花但雄蕊未外露的花枝作为试材。试验在云南省农业科学院花卉研究所进行,瓶插花枝置于室内散射光下,瓶插期间室温为18~22 ℃,相对湿度为50%~60%。
1.2 主要试剂与仪器
供试的3种切花保鲜剂均购于昆明市呈贡区斗南花卉市场,分别为荷兰可利鲜公司生产的鲜花保鲜剂(处理A)、美国史密夫·奥赛斯公司生产的免切鲜花营养液(处理B)、国内某公司生产的切花保鲜剂(处理C)。菌落总数测试片由美国3M公司生产;三氯乙酸、硫代巴比妥酸为国产分析纯试剂。主要仪器包括5430R型高速冷冻离心机、UV-VIS型紫外分光光度计、CS601型恒温水浴和EL30K型电导仪。
1.3 试验方法
爆杖花花枝在蒸馏水中剪切,每枝斜剪去约1 cm,插入装有350 mL保鲜液的三角瓶中,每瓶插1枝,每个处理10枝花,以蒸馏水为对照。
1.4 指标测定
1.4.1 MDA含量及细胞质膜透性测定 于爆杖花切花保鲜处理前及瓶插3、7、10、14 d时,采用硫代巴比妥酸显色法测定叶片MDA含量,用电导法测定细胞质膜透性[11]。
1.4.2 瓶插保鲜液细菌菌落总数测定 以无菌吸管吸取1 mL保鲜处理前及瓶插3、7、10、14 d的瓶插保鲜液于9 mL灭菌生理盐水中,充分混匀,制成1∶10的匀液,经对应倍数稀释后,使用3M菌落测试片进行菌落总数培养和计数。
1.4.3 水分平衡值测定 参照娄喜艳等[12]的方法,分别于瓶插3、5、7、10、12、14 d时称取溶液+瓶的质量,2次的差值为吸水量;每次称取溶液+瓶+花枝的质量,2次的差值即为失水量(蒸腾量);水分平衡值=花枝吸水量-失水量。
1.4.4 花朵开放情况及瓶插寿命观测 分别于瓶插3、5、7、10、12、14 d时统计每枝花枝上筒状小花的开放情况;当50%筒状小花出现萎蔫并自然下垂时视为切花瓶插寿命终止,以此统计切花瓶插天数。
1.5 数据处理
使用Excel 2013软件完成数据整理、统计和制图,方差与差异显著性分析使用SPSS 19.0软件完成。
2 结果与分析
2.1 不同处理爆杖花切花MDA含量的变化
MDA是膜稳定性指标,与鲜切花衰老进程密切相关。MDA含量越高,生物膜受损伤的程度越严重[13]。由图1可知,爆杖花切花采后初始的MDA含量为5.2 mmol/g,随瓶插时间的延长,对照及保鲜处理切花的MDA含量均呈明显的下降趋势。爆杖花切花瓶插3 d后对照的MDA含量逐渐上升,瓶插7 d时达到高值,之后呈下降再略微上升的波动趋势。处理A的爆杖花切花瓶插3 d后的MDA含量逐渐上升,瓶插10 d时达到高值,之后呈下降趋势。处理B的爆杖花切花的MDA含量呈下降趋势,瓶插7 d后逐渐上升。处理C的爆杖花切花MDA含量在瓶插3 d后呈缓慢下降趋势,总体变化幅度不大。爆杖花切花在瓶插前期(7 d内)对照的MDA含量均明显高于经保鲜剂处理的,表明瓶插保鲜液能抑制切花的膜脂过氧化。

图1 不同处理爆杖花切花MDA含量的变化情况
鲜切花采后处理过程中的MDA含量累积值能直接反映生物膜受损程度,因此可通过比较不同保鲜剂处理下切花的MDA含量累积值来评价不同保鲜剂的保鲜效果。从不同处理爆杖花切花的MDA含量累积图(图2)可以看出,爆杖花切花在对照中的MDA累积值略高于其他用保鲜剂处理切花的,且以处理B切花的MDA累积值最低,说明以美国史密夫·奥赛斯公司生产的免切鲜花营养液保鲜的爆杖花切花生物膜受损程度最低,保鲜效果最好。

图2 不同处理爆杖花切花MDA含量的累积值
2.2 不同处理爆杖花切花细胞质膜透性的变化
电导率可以用来衡量细胞质膜透性的大小,电导率越大,表示细胞质膜受损害程度越严重、电解质的渗漏量越多[14]。由图3可知,爆杖花切花采后的初始电导率为0.33 μs/cm,瓶插处理后对照及保鲜处理切花的电导率均有所降低,对照及处理A、B切花的电导率在瓶插3 d后仍然继续下降,瓶插10 d后逐渐上升。处理C切花的电导率在瓶插3 d后呈缓慢上升趋势,瓶插10 d后逐渐下降。
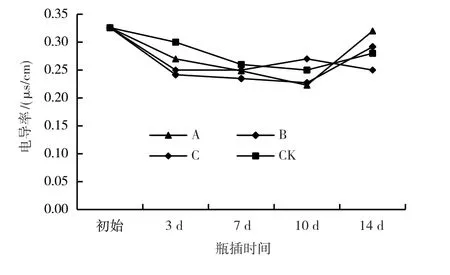
图3 不同处理爆杖花切花电导率的变化情况
切花采后处理过程中电导率的累积值能直接反映细胞质膜受损伤的程度。从不同处理爆杖花切花的电导率累积值(图4)可以看出,对照切花的电导率累积值略高于3种保鲜处理切花的电导率累积值,以处理B切花的最低,说明以美国史密夫·奥赛斯公司生产的免切鲜花营养液保鲜的爆杖花切花生物膜受损程度最低,保鲜效果最好。

图4 不同处理爆杖花切花电导率的累积值
2.3 不同处理瓶插液的菌落总数变化
由表1可看出,CK的初始菌落数为62 CFU/mL,瓶插保鲜液的初始菌落数均为0 CFU/mL。瓶插3 d时,CK的菌落数快速增加,达到了1.3×104CFU/mL,且随着瓶插时间的延长,菌落数数值略有增高。在3个保鲜处理中,瓶插保鲜液的菌落数在瓶插10 d后开始逐渐增加,但始终显著低于对照,但3个保鲜处理间的差异不显著。试验结果表明,3种切花保鲜液均具有良好的抑菌效果。

表1 不同保鲜处理瓶插液的菌落总数 CFU/mL
2.4 不同处理对爆杖花切花水分平衡值的影响
如图5所示,在瓶插第3~5天,CK及保鲜处理切花的水分平衡值均呈快速下降趋势,处理C的下降速度较快,在第5天时达到最低值,说明该处理切花的失水量(蒸腾量)远大于吸水量,花枝失水严重。处理B及CK切花的水分平衡值维持正值的时间较长,在第5天时仍为正值,说明这个阶段切花的吸水量大于失水量,更有利于维持切花的水分平衡。在瓶插第5~10天,对照及处理A、B切花的水分平衡值继续呈下降趋势,CK的下降速度最快,在第10天时达到最低值。在瓶插10 d后,CK及处理A、C切花的水分平衡值逐渐升高,但始终处于负值水平,此时切花的失水量大于吸水量,花枝逐渐萎蔫。
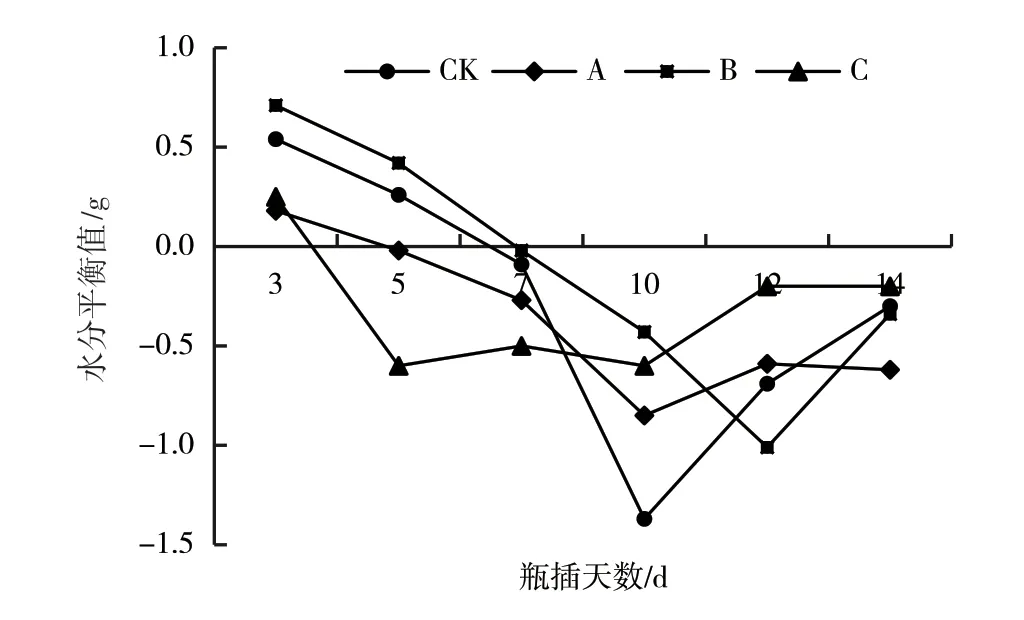
图5 不同处理爆杖花水分平衡值的变化情况
2.5 不同处理对爆杖花切花花朵开放情况及瓶插寿命的影响
如图6所示,处理A、B切花的开花率在瓶插第3天时迅速上升,表明这2种保鲜液有催花效果,能促进爆杖花切花快速开放。处理B在瓶插第5天、处理A在第7天时达到最大开花率,此后开花率逐渐下降。CK的开花率从第3天开始缓慢上升,到第5天时达到最大值,随后开花率迅速下降。处理C在整个瓶插期花朵开放率较低,表明其对爆杖花切花开放无明显促进作用。

图6 不同处理爆杖花切花开花率的变化情况
不同保鲜处理对爆杖花切花观赏品质和瓶插寿命影响程度见图7。由图7可知,处理A、B能快速促进爆杖花切花开放,筒状花形态饱满且花色艳丽,花枝具有较好的观赏品质,这2个处理切花的瓶插寿命均较长,分别为10、14 d。CK的切花在瓶插期能正常开放,但花朵开放不充分,筒状花不饱满,瓶插期为7 d。处理C的切花在瓶插第5天、花朵尚未完全开放时就出现萎蔫,瓶插第7 天时发现部分花枝茎杆及叶片变成褐色且落叶严重,表明该保鲜液可能对爆杖花切花造成了伤害。

图7 不同处理爆杖花切花的开放情况
3 结论与讨论
爆杖花切花经3种保鲜液处理后,瓶插前期MDA含量及细胞质膜透性均显著低于对照的,表明保鲜处理能抑制细胞质膜的膜脂过氧化,维持细胞质膜相对稳定。处理B的切花在瓶插过程中MDA含量及电导率累积值均最低,表明在瓶插过程中以美国史密夫·奥赛斯公司生产的免切鲜花营养液处理的爆杖花切花细胞质膜的受损程度较低,能维持切花较好的观赏品质,这与瓶插寿命的试验结果一致。
大量研究结果表明,延长切花保鲜时间的主要因素是供给必要的营养物质、防止导管阻塞和抑制乙烯合成[15-16]。切花瓶插过程中细菌的大量繁殖会导致乙烯含量增加及花茎基部导管堵塞,影响花枝吸水进而加快切花衰老[17]。保鲜剂配方中大多含有广谱型杀菌剂,其目的是防腐杀菌及抑制微生物繁衍,防止花茎导管堵塞,促进花枝吸水[18-19]。供试3种保鲜液的菌落数始终维持在较低水平,表明其能长效抑制瓶插过程中滋生的细菌,具有较好的抑菌效果。
鲜切花与母体分离后,当水分平衡值为负值时,切花会逐渐萎蔫[20]。赵敏等[21]用不同保鲜剂处理非洲菊切花时发现,不同处理的水分平衡值随瓶插时间的延长呈下降趋势,瓶插初期水分平衡值急剧下降,后期下降速度变缓,这与本研究结论一致。处理B的水分平衡值明显高于对照及其他处理的,表明该处理可促进爆杖花切花瓶插期间的水分吸收,能够有效维持其水分平衡。综合分析认为,与CK及处理A、C相比,处理B能促进爆杖花切花开放,花色艳丽,花朵开放整齐,瓶插期长达14 d,其对爆杖花切花具有明显的保鲜效果。处理C的切花在瓶插第5天时花朵开始出现萎蔫,第7天时发现部分花枝茎杆和叶片出现褐化,该保鲜液可能对爆杖花切花产生了伤害,其原因有待进一步研究。
采用适宜的保鲜剂是延长切花瓶插寿命和提高其观赏价值的关键,目前有关杜鹃花切花保鲜剂的研发尚属空白,鉴于杜鹃花具备切花开发潜质,下一步可开展专用保鲜剂的研发工作,为杜鹃花资源的开发利用及产业发展提供技术支撑。

