酢浆草属植物组织培养技术研究进展
江杰,李娜,王建强,张思思,章晓琴
(武汉市园林科学研究院,武汉 430081)
0 引言
酢浆草是酢浆草科酢浆草属的多年生草本植物[1]。酢浆草属植物主要分布在热带、亚热带和温带地区,国内各地均广泛分布[2],目前有800余种,主要有酢浆草(Oxalis corniculata)、三角紫叶酢浆草(O.triangliaris)、红花酢浆草(O. corymbosa)、黄花酢浆草(O.pes-caprae)、钝叶酢浆草(O.obtusa)、大花酢浆草(O.bowiei)、山酢浆草(O.acetosella)等[3]。作为优良的地被植物,适宜粗放管理,耐病虫害[4],在园林景观中得以广泛应用,同时可以盆栽在家庭园艺中观赏[5]。酢浆草含有黄酮类、酚类、苯丙素类、萜类以及单糖类化合物[6],其体外抑菌作用及抗炎功效证明全草均可入药[7]。现代医药研究表明,酢浆草具有保肝、抗菌消炎、抗肿瘤、抗氧化等功效[8],在医药上具有较高的潜在开发和应用价值[9]。
酢浆草多采用鳞茎或球茎繁殖,受繁殖季节和自然环境影响较大,且存在着繁殖速度慢、效率低等情况[10]。此外病毒易在鳞茎或球茎中逐年积累导致开花减少、花瓣变小[11]。酢浆草的果实为蒴果,自然结实率较低,利用种子繁殖周期长,难以满足市场化需求[12]。
组织培养技术因可人工控制生长条件,不受地区、季节和气候环境的限制,具有繁殖速度快、可连续生产等优点。笔者对酢浆草属植物组织培养技术研究进展进行总结,以期为酢浆草属植物的进一步研究提供参考。
1 外植体
1.1 再生体系的选择
酢浆草属植物再生体系的建立有器官发生途径和体细胞胚再生途径。体细胞胚再生途径是指体细胞胚经历与合子胚相似的阶段,形成两极性的体细胞胚,然后形成完整的植株。由于体细胞胚诱导对材料培养环境要求较高,诱导畸形胚发生率高[13],该途径在酢浆草组培中使用较少,李耀亭等[14]曾对三角紫叶酢浆草诱导愈伤组织和体细胞胚分化获得再生苗。
目前,通过器官发生途径获得组培苗是常用的组培方法,在酢浆草中即为由离体器官产生不定芽和根,从而生长为完整植株。器官发生途径又可分为直接器官发生途径和间接器官发生途径,区别在于,前者无需形成愈伤组织,由外植体直接产生不定芽和根,如鳞茎、茎段等;后者发生需由外植体如叶片、叶柄等脱分化形成愈伤组织,再分化出芽和根,最终形成完整植株。
1.2 外植体的选择
选择适合的外植体是建立组织培养体系的第一步。对近20年来的研究结果总结发现,酢浆草属植物组培较多选择叶片、叶柄、鳞茎、茎段等作为外植体。酢浆草的叶片、叶柄是较为常用的外植体材料[15]。耿开友等[16]以叶柄为外植体出芽率达75%。李霖等[17]以叶柄成功地培养出小苗,出芽率均达到了90%。胡国富等[18]对比发现叶片为最佳外植体,诱导率为93.3%。宋满坡等[19]使用叶片和叶柄为外植体,诱导率最高为86.3%。张兴桃等[20]使用叶片作为外植体时,出芽率最高达95%。蔡丽琼等[21]的研究表明,紫叶酢浆草的叶片比叶柄更容易分化出不定芽,是最适宜的外植体。高贵珍等[22]研究发现,与叶柄相比,三角紫叶酢浆草叶片作为外植体,愈伤组织形成和芽的分化较早、诱导率更高、形成的芽更多。王金刚等[23]以大花酢浆草鳞茎作为外植体材料进行组织培养,诱导率达到了80%。邓小梅等[24]以三角紫叶酢浆草地下鳞茎为外植体材料,但认为污垢相对比较多、无菌材料较难获得。
1.3 外植体处理和灭菌
外植体灭菌是组培成功的关键,针对不同外植体及其幼嫩程度需要选择不同的灭菌方式。通常情况下,清水洗净后先用75%酒精,再用0.1%HgCl2或3%NaClO分2步进行灭菌[25]。由于各种消毒剂对外植体都有着不同程度的伤害,必须对灭菌时间严格把控,酒精处理在1 min以内,NaClO、0.1%HgCl2等消毒剂的处理时间控制在3~8 min 最佳,具体处理时间根据外植体选材而定,处理完毕接种前需用无菌水冲洗干净[26]。具有代表性的灭菌方式汇总情况见表1。
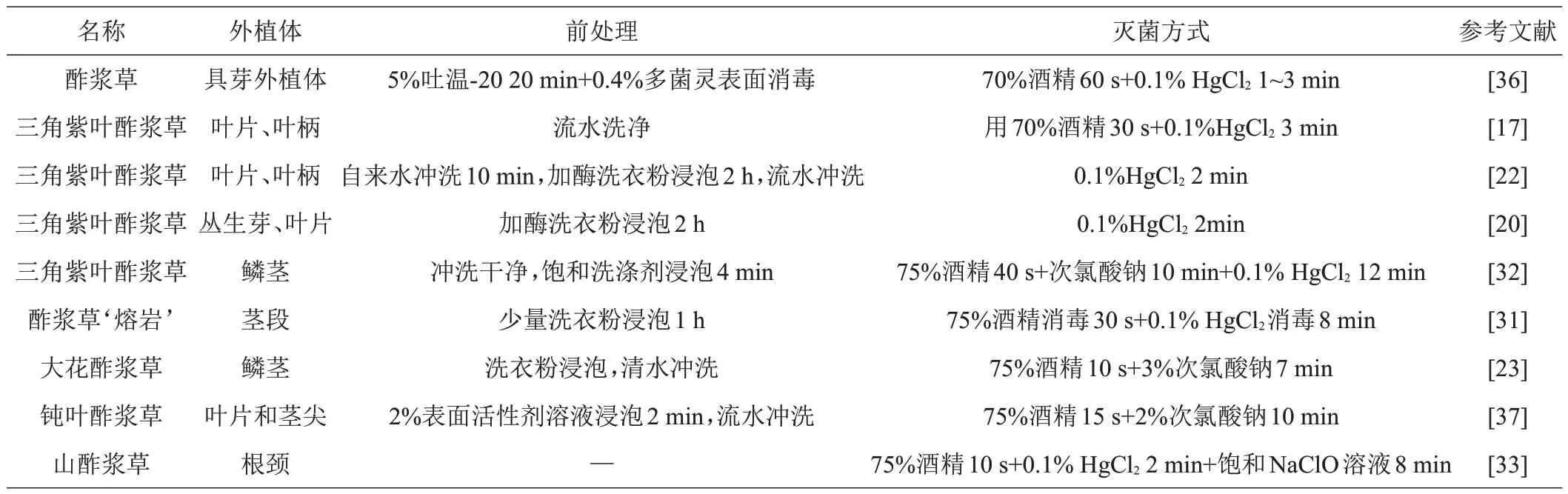
表1 酢浆草属植物不同外植体常用消毒方法
2 培养基与培养条件
2.1 基本培养基
组培实验中常用的培养基类型有MS、1/2MS、White、B5、N6培养基等。其中,B5培养基铵含量较低,适合部分植物愈伤组织和细胞悬浮物的培养;N6培养基无机盐含量较低,适合禾本科植物的花药和花粉培养;MS 培养基无机盐浓度相对较高,钾、铵和硝酸盐的含量高,目前使用最为广泛。
杜金龙等[27]诱导三角紫叶酢浆草愈伤组织时,对比了不同基本培养基的生长效果,结果表明MS 培养基上愈伤组织的诱导率、时间和生长速度最高,White次之,B5和N6较差。质地疏松的愈伤组织有利于不定芽的分化,MS培养基上质地较为疏松,White次之,B5和N6上质地都较致密。各项指标综合比较显示,MS培养基较有利于三角紫叶酢浆草愈伤组织的诱导。
目前,酢浆草属植物组培普遍使用的基本培养基是MS 和1/2MS,MS 培养基多用于愈伤组织、丛生芽诱导和增殖培养,1/2MS则主要用于生根培养。
2.2 碳源和支撑物
碳源的种类与浓度对于体细胞的诱导有重要的作用[28]。刘建等[29]研究了不同碳源(蔗糖、果糖、可溶性淀粉)对三角紫叶酢浆草组培苗的分化发现,MS培养基中添加3%蔗糖效果最好,芽和根的分化率分别为94.44%和96.30%。培养基中的糖源不仅为外植体提供碳素,而且能够调节渗透势从而影响外植体的分化和发育。常规培养一般以MS、1/2MS 培养基添加3%蔗糖为主,并添加0.7%~1%琼脂作为支撑物。
2.3 植物生长调节剂
植物生长调节剂的组合及其配比是酢浆草属组培研究的核心。植物激素主要有5类,即生长素类、细胞分裂素类、赤霉素类、乙烯和脱落酸。组培实验中常使用的植物激素主要为6-BA、KT、ZT 等细胞分裂素和IAA、NAA、IBA、2,4-D等生长素。合适的生长素和细胞分裂素配比对再生体系建立过程中愈伤组织诱导与分化、丛生芽的增殖以及生根等具有积极的作用。酢浆草属不同品种、不同外植体材料诱导愈伤组织、丛生芽和生根的培养基成分之间存在差异,归纳汇总见表2。诱导阶段6-BA、NAA 是常用激素,使用范围分别是0.5~2.0、0.2~0.5 mg/L,其他辅用激素的使用频率由高至低依次为KT、2,4-D、IBA。增殖阶段6-BA、NAA仍为常用激素,使用范围分别是0.5~3.0、0.1~0.5 mg/L。生根阶段常见NAA单独使用,使用范围是0.05~2.5 mg/L。
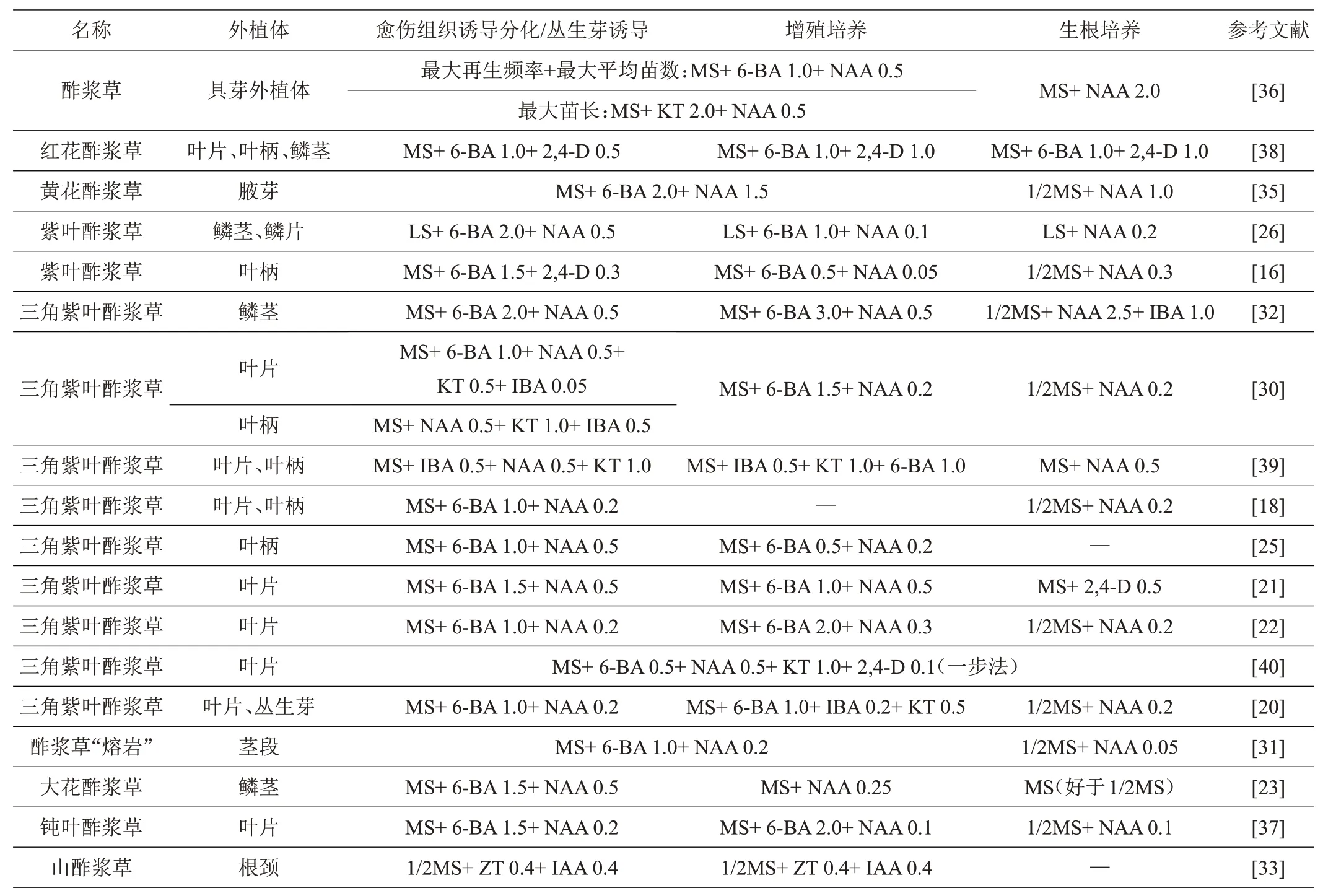
表2 部分酢浆草属不同外植体组织培养培养基成分mg/L
2.4 培养条件
综合近年来酢浆草属植物组培研究,通常情况下培养温度设置为(25±1)℃;每天连续光照12 h,最长不超过16 h;光照强度1500~2000 lx,不超过3000 lx。
3 酢浆草属植物组培体系
3.1 丛生芽的诱导与增殖
利用器官直接发生途径诱导丛生芽发生与增殖是一种快速获得组培苗的方式。较低浓度的生长素有利于丛生芽的诱导与增殖,生长素NAA 0.2 mg/L时酢浆草‘熔岩’茎段丛生芽增殖系数最高,NAA浓度升高会导致基部愈伤增多、丛生芽增殖系数降低,6-BA 高于1.0 mg/L 时丛生芽生长细弱,最适宜丛生芽诱导与增殖的培养基为MS+6-BA 1.0 mg/L+NAA 0.2 mg/L[31]。王金刚等对大花酢浆草鳞茎组培研究表明,6-BA 对丛生芽诱导具有重要的作用,6-BA 1.5 mg/L、NAA 0.5 mg/L时诱导率达到82%,增殖阶段NAA 0.25 mg/L增殖系数可达28.5[21]。余朝秀等[32]离体培养三角紫叶酢浆草鳞茎,诱导和增殖阶段NAA添加浓度均为0.5 mg/L,诱导阶段以6-BA 2.0 mg/L 最佳,增殖阶段以6-BA 3.0 mg/L 最佳,此时增殖率达到29.3。宋诗迎等[33]对山酢浆草根颈进行培养,以1/2MS+0.4 mg/L ZT 为基本培养基,比较了不同浓度2,4-D、NAA、IBA、IAA 对根茎生长的影响,从试管苗、根茎的生长率和长势等指标对比显示,添加0.4 mg/L IAA时效果最好,使用该培养基进行继代繁殖,平均50 d 一个培养周期,繁殖系数为4.2。倪苏等[34]研究了生长迟缓剂B9对三角紫叶酢浆草试管苗增殖的作用,结果表明增殖培养时添加20 mg/L B9试管苗粗壮,增殖倍数达17.12。吴杰等[35]在诱导黄花酢浆草丛生芽时在MS+ 6-BA 2.0 mg/L+NAA 1.5 mg/L 培养基中添加了10 mg/L 秋水仙素,出芽率达100%,且出现茎膨大、矮化等现象。Swetha等[36]研究细胞分裂素6-BA、KT 及生长素NAA、IBA、IAA 对酢浆草具芽外植体诱导产生再生苗的影响,结果表明培养基添加6-BA 1.0 mg/L+ NAA 0.5 mg/L 培养时增殖效率最大为96%,培养基添加KT 2.0 mg/L+NAA 0.5 mg/L 培养时苗长最大,说明KT 可以促进茎的生长,而6-BA作用于茎的增殖。
生长素和细胞分裂素的配比决定了丛生芽增殖的数量和长势,以6-BA与低浓度的NAA配合使用效果最好,NAA一般为0.2~0.5 mg/L,过高时愈伤过多、增殖系数降低;6-BA的浓度根据外植体材料不同而定,鳞茎作为外植体时浓度在1.5~3.0 mg/L为优,使用茎段、叶柄等浓度一般低于1.0 mg/L。此外,附加一定浓度的生长迟缓剂或秋水仙素等处理能够促进试管苗矮壮。
3.2 愈伤组织的诱导和分化
器官间接发生途径是通过外植体诱导出愈伤组织,再分化出不定芽。该过程因酢浆草品种、外植体材料存在差异,愈伤组织的诱导率、诱导数量以及质量也明显不同。诱导愈伤组织的激素有6-BA、NAA、2,4-D、KT等。
细胞分裂素是诱导愈伤组织的重要条件,在诱导愈伤组织与分化时培养基中一般6-BA与NAA组合使用,6-BA 与NAA 浓度比在5:1~2:1 之间,6-BA 的使用浓度一般不超过1.5 mg/L,过高时会产生玻璃化现象。胡国富等[18]在诱导培养三角紫叶酢浆草的叶片时,研究了6-BA、NAA 不同激素水平对三角紫叶酢浆草组培的影响,以叶片作为外植体,6-BA 或者NAA 单独存在时对叶片诱导形成不定芽效果不佳,6-BA 1.0 mg/L、NAA 0.2 mg/L 配合使用时,出芽率最高达93.3%。张兴桃等[20]培养三角紫叶酢浆草叶片时,6-BA 1.0 mg/L+NAA 0.2 mg/L 出芽率为95%。采用6-BA 1.5 mg/L+NAA 0.2 mg/L对钝叶酢浆草启动培养,愈伤组织和茎尖生长最好,继代培养(NAA 0.1 mg/L)时随着6-BA 浓度升高,钝叶酢浆草芽的生长速度加快、分枝增加,6-BA 2.0 mg/L芽生长速度最快、高度适中、分枝较多、茎直立健壮[37]。
同类型的植物激素一般可以相互替换。诱导红叶酢浆草(实为三角紫叶酢浆草)外植体产生愈伤组织时,细胞分裂素是主要影响因子,MS+6-BA 1.0 mg/L+2,4-D 0.5 mg/L 诱导效果最佳,继代增殖时MS+6-BA 1.0 mg/L+2,4-D 1.0 mg/L 效果较好[38]。王钰等[39]离体培养三角紫叶酢浆草叶片、叶柄时,在MS+IBA 0.5 mg/L+NAA 0.5 mg/L+KT 1.0 mg/L 中分化最优,出芽率为40%。任杰等[40]以三角紫叶酢浆草叶片为材料,采用固定配比的6-BA(0.5 mg/L)和NAA(0.5 mg/L)研究“一步法”诱导再生体系,结果发现0.1 mg/L 2,4-D和1.0 mg/L KT配合前述配比的6-BA、NAA使用最有利于愈伤组织、根和不定芽的形成,也有效地减少了工作量。
3.3 生根
生长素在组培苗生根阶段具有重要的作用。王金刚等[23]将继代苗直接在MS 培养基上培养,生根效果最好,生根率达90%以上。培养7 d后幼苗基部愈伤组织膨大形成块茎,有细小的呈淡灰色的根长出;培养20 d幼苗高达3~4 cm,根数均达到10条。1/2MS培养基较多使用在生根培养中,高贵珍等[22]以1/2MS 为基本培养基,设置0、0.1、0.2、0.3 mg/L 4 个NAA 浓度梯度,发现不添加任何激素的基本培养基上就可生根,但是根数量相对较少且生长较弱,添加0.2 mg/L NAA时根的数量多、根粗壮、生长较强。有研究比较了相同浓度的NAA 与IBA 诱导三角紫叶酢浆草生根的效果,NAA 效果更好,使用1/2MS+0.2 mg/L NAA 时生根最早、根系粗壮,生根率达93.8%[18]。张兴桃等[20]在1/2MS 中添加0.2 mg/L NAA 时,不仅生根早且根壮,苗基部出现组织块并发育成块茎。邱凯男等[37]以1/2MS 为基本培养基,发现不添加6-BA时,随着NAA浓度升高,根的生长速度加快,NAA 0.1 mg/L时根密而粗壮,叶绿色,植株健壮,长势最好;添加0.5 mg/L 6-BA时,NAA 浓度升高会抑制根的生长,最适宜生根的培养基为1/2MS+NAA 0.1 mg/L,出根率达59.2%。陈芬等[31]研究表明,1/2MS 中添加0.05~1.0 mg/L 的NAA酢浆草‘熔岩’的生根率均能达到100%,其中使用0.05 mg/L NAA时生根最早、根生长最好,NAA浓度增加根生长量下降。Swetha等[36]对酢浆草组培生根研究表明,MS 培养基添加IBA 或者NAA 均能促进生根,MS附加2.0 mg/L NAA时生根率达到了98%。
由于酢浆草在不定芽的分化和增殖过程中已经有少量不定根的形成,一般认为试管苗的生根较容易,在附加较低浓度的生长素如NAA、2,4-D 等的1/2MS 培养基上,试管苗生长茁壮,生根较早、快,生根率高。此外酢浆草属球根植物,在生根过程中肉质鳞茎状或块茎状地下根茎的形成尤为重要,具有这些结构的植株移栽方便、后期存活率高。
3.4 炼苗移栽
酢浆草组培苗在移栽前选用健壮、根系发达的植株进行炼苗,使其充分适应外界环境。通常炼苗时仅松开封口皮筋、培养瓶盖或打开一半封口膜,再逐步去掉封口膜,炼苗2~3 d。取出组培苗后用清水洗净基部培养基。陈芬等[31]在移栽组培苗时基质选用草炭、珍珠岩按7:3混合,控制好温湿度,每3 d浇水1次。李霖等[17]仅使用营养土作为移栽基质,成活率100%。胡国富等[18]使用营养土并混合粗砂,成活率达98%以上。王金刚等[23]使用经灭菌的基质(园土:珍珠岩:木屑=2:1:1)进行移栽,并用无菌水一次浇透,在温度24℃、湿度90%的人工气候箱中炼苗,存活率在85%以上。余朝秀等[32]采用腐叶土、田园土、珍珠岩等作为混合基质,并对其蒸汽灭菌。移栽后保持空气湿度80%左右,温度20~30℃,成活率可达95%以上。酢浆草组培苗一般移栽在富含营养土的基质中,可混合一定比例砂、珍珠岩等,并保持合适温湿度,移栽成活率极高。
4 问题与讨论
污染、褐化、玻璃化是植物组织培养过程中的3个难题,是影响组培成功的关键性因素[41]。在酢浆草属植物组培过程中,控制污染、降低褐化和玻璃化的发生,能够提高组培苗的获得率,有效降低繁殖成本。
4.1 污染问题
污染是影响植物组培的首要问题,通常情况下污染是由于工作台环境、外植体材料、培养基和工具等消毒灭菌不规范、不彻底以及组培操作不当。酢浆草组培时由于外植体选取的差异,以及不同材料的灭菌方式,灭菌的效果具有显著差异[42]。选择酢浆草叶片作为外植体时因叶片表面着生柔毛,在消毒剂的水溶液中较容易产生气泡,阻碍消毒剂表面的接触,降低了消毒剂的灭菌效果。多项研究表明,在消毒剂中加入表面活性剂,如吐温-20等,能减少叶片表面气泡的产生,促进消毒剂发挥作用,显著提升消毒效果,并在短时间内完成消毒过程,降低了幼嫩叶片被消毒剂杀死的概率,同时降低污染率。选择鳞茎为外植体时需在消毒前洗净,彻底除去表面杂质,消毒时间可以相应增加,有助于提高消毒灭菌效果。
4.2 褐化问题
褐化是植物组培中最常见的问题之一,对愈伤组织的分化、组培苗的生长等产生不利影响,普遍认为褐化是由酶促反应引起的[43]。外植体生理状态直接影响褐化程度,老熟组织较为严重。添加0.1%~0.5%活性炭等吸附产生的褐色物质等,降低褐化的风险,也可提升芽的质量[26]。培养基中激素浓度过高,会导致一些生长较弱的丛生芽发生褐化而死亡[31]。根据褐化产生的机理,在酢浆草组培时,可以通过添加一定浓度抗氧化物质如维生素C等,避免培养温度过高、光照过强等也可起到降低多酚氧化酶活性的作用,发生褐变的材料要及时转移出去[42]。
4.3 玻璃化现象
玻璃化现象是植物组织培养中另一大难题,具体表现为植株生长异常,组织结构畸形,茎、叶片等呈现渍水状态[42]。造成玻璃化现象的原因较多,例如培养基成分、植物激素浓度、培养温度、光照强度等环境因素以及植物品种、外植体老幼程度等内在因素。有研究表明,适当降低培养基中的激素浓度可以有效抑制玻璃化现象的产生。李耀亭等[14]诱导体细胞胚时6-BA 的使用浓度高于1.0 mg/L 会产生玻璃化胚状体现象,同时抑制体细胞胚的进一步发育,说明使用较高的激素浓度会引起玻璃化现象的发生。愈伤组织诱导阶段应在黑暗条件或弱光条件下,而在不定芽分化阶段一般需要较高强度的光照。培养基中糖的浓度可使培养基的渗透压处于一定的范围,通常糖浓度越高玻璃化程度越低[43],避免培养过程温度过高也会降低玻璃化发生的概率。
5 展望
目前酢浆草属植物组培与再生体系建立的研究已有不少报道,国内外在酢浆草组培方面也取得了一定进展,主要是利用器官发生途径的研究,体细胞胚再生途径相关研究内容较少。酢浆草属植物具有广泛的花色、叶色变异范围[44]。不同基因型酢浆草之间花色、叶色等差异主要是由花青素、黄酮、胡萝卜素等色素沉着不同引起的,这些色素的合成机制也较为明晰[45]。基于再生体系建立研究的成果,对相关色素合成途径中的通路基因和转录因子进行基因编辑,如苯丙氨酸解氨酶PAL、查耳酮合酶CHS 和转录因子MYB113 等,进而影响其合成与积累,定向培育色彩缤纷、观赏价值较高的酢浆草新品种[46],满足市民对高品质园林绿化的需求。近年来,植物天然产物的合成生物学领域研究发展迅速。酢浆草中黄酮类、酚酸类和挥发油类等主要成分有着广泛的药理作用,生长迅速、管理较为简单等优势使得酢浆草成为良好的植物天然产物提取原料[7]。基于其内源次生代谢通路的解析,对黄酮类、酚酸类等天然产物合成途径中的功能基因或转录因子定向编辑,以酢浆草为底盘合成所需目的天然产物,进一步发挥酢浆草属植物在临床医药等研究方向上的应用前景[47]。

