层状双氢氧化物在干细胞治疗中的应用进展*
庞思妍,张世文,陈昌杰,杨清玲,王文锐
(1.蚌埠医学院癌症转化医学安徽省重点实验室,安徽 蚌埠 233030;2.蚌埠医学院生命科学学院;3.生物化学与分子生物学教研室;4.蚌埠医学院生物技术教研室)
干细胞的自我更新,多向分化和免疫调节的特性,使其成为组织生物学,药物学,医学等研究的焦点。干细胞依照发育阶段基本可以分为两类:由胚胎内细胞团或原始生殖细胞发育而来的胚胎干细胞(embryonic stem cells, ESCs)和存在于机体组织的成体干细胞(adult stem cells, ASCs),可以用作免疫治疗和基因治疗[1-3]。临床上常用的干细胞疗法主要有:一为干细胞免疫治疗,指通过调节炎症因子的产生与作用来抑制损伤细胞增殖与免疫反应,从而修复机体内受损组织细胞[4-5];二为分化治疗,即诱导干细胞增殖与分化,利用干细胞分化功能,弥补受损或病变组织。一般通过向机体移植干细胞,干细胞通过分泌生长因子等或通过与组织细胞间直接的相互作用促进组织细胞自我修复,产生新生组织细胞,从而治疗病变或受损组织[6-8]。研究表明,干细胞治疗中直接移植干细胞常发生炎症反应,使用的药物如小分子药物[9-10]等也常常会发生诸如生物利用率低、毒性大、无法靶向运输等问题。为了解决这些问题,开发新型生物材料与干细胞联合应用对于组织再生或肿瘤治疗等具有一定的必要性和临床意义[11-12]。
层状双氢氧化物(layered double hydroxides, LDHs)又称阴离子黏土或水滑石,是一种二维无机纳米材料,由二价和三价金属阳离子与羟基共价结合以八面体形式组合形成带正电荷的层板结构,层间由水分子和可替换的阴离子补偿主层板上的电荷平衡。LDHs组成和结构的丰富可调性以及主客体相互作用,有利于在此基础上构建新型LDHs纳米复合材料。该类材料具有合成简单、物理化学性质稳定、生物相容性良好等特点,在体内外药物递送等方面具有独特优势[13-15]。干细胞在疾病治疗中具有显著的优势和重要的地位。近年来,国内外研究人员将层状双氢氧化物引入干细胞治疗领域,发现这一类纳米材料能够稳定地促进多种干细胞的黏附、增殖,并诱导干细胞分化。本文总结了LDHs及其纳米复合材料在调控干细胞治疗方面的应用进展以及未来所面临的挑战。
1 层状双氢氧化物与胚胎干细胞
胚胎干细胞(ESCs)最早提取于1981年[16],是来源于早期胚胎(原肠胚期之前)或原始性腺中的内细胞团的多潜能干细胞,具有体外培养无限增殖、自我更新和多向分化的特性[17],目前在治疗脊髓损伤、心肌梗死等方面显示出良好的潜力。控制或诱导ESCs的自我更新或分化对于其应用于临床治疗具有重大意义。小鼠胚胎干细胞(mouse embryonic stem cells, mESCs)由于其无限增殖及多向分化的潜能广泛应用于药物的胚胎毒性研究。Wang等[18]表明LDHs能够显著降低化疗药物VP16引起的mESCs细胞毒性,包括对细胞存活率、克隆形成能力、细胞凋亡、细胞周期及线粒体膜电位的影响,并能够在很大程度上恢复mESCs的自我更新特性及向三胚层分化的能力,维持mESCs的干细胞特性。
Wu等[19]制备的生物相容性较好的Mg-Al-LDHs纳米复合材料,可以通过激活PI3K/Akt信号通路来促进mESCs的自我更新和抑制其自发分化。此外,Wu等[20]进一步研究了不同粒径的LDHs对mESCs的影响。结果显示,与100 nm LDHs相比,50 nm LDHs更容易被mESCs细胞摄入。He等[21]进一步构建了相较于Mg-Al-LDHs性能更优异的Mg-Fe-LDHs,可以有效替代白血病抑制因子LIF维持mESCs的自我更新。Mg-Fe-LDHs相比于LIF和Mg-Al-LDHs,其释放的Fe2+进一步促进TET的表达,从而控制多潜能相关基因的表达和DNA去甲基化。见图1。
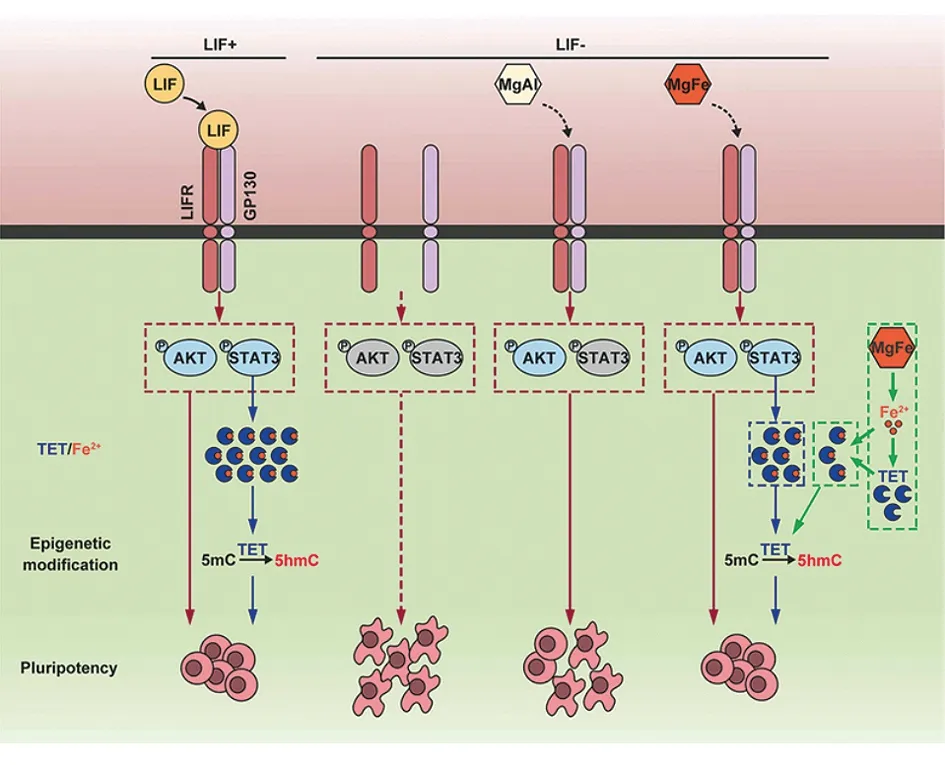
图1 Mg-Fe-LDHs纳米复合材料功能机制示意图[21]
2 层状双氢氧化物与间充质干细胞
MSCs是一类来源于中胚层和外胚层的细胞,主要包括脂肪、髓、脐带和脐带血等,因其具有强大的增殖能力、低免疫原性、多向分化潜能、免疫调控等特点[22-25],常被用于细胞治疗等领域。近年来,MSCs已被广泛用于帕金森综合征、阿尔茨海默病、心血管疾病、肌肉退行性疾病等多种疾病的治疗[26-28]。
2.1骨髓间充质干细胞 骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是临床干细胞治疗中最常应用的一种MSCs,可分化为骨骼、脂肪、软骨等多种间质组织。研究表明,在骨修复过程中,可以诱导BMSCs定向分化为成骨细胞[29]。赵敏龙等[30]利用LDHs作为骨修复药物的输送系统,构建针对成纤维细胞活化蛋白的纳米抗体(fibroblast activation protein Nanobody,FAP Nb)的FAP Nb/LDHs纳米载体,改善了骨修复药物纳米抗体FAP Nb因半衰期短而出现的疗效限制问题,提高了人骨髓间充质干细胞定向分化为成骨细胞的效率。Kang等[31]开发的基于LDHs的夹载有腺苷的纳米复合材料(MgFe-Ado-LDHs),可以通过Mg-Fe-LDHs纳米层的溶解释放,以持续的方式共同递送腺苷配体分子(Ado)和配体活化剂(Mg2+离子),Fe3+离子作为Mg-Fe-LDHs层状结构的组成部分,尚未有研究报道影响腺苷的连接。Mg2+离子促进Ado与BMSCs细胞膜上的腺苷受体(A2bR)结合并刺激其表达,用于协同诱导体内干细胞成骨分化和大鼠胫骨组织愈合,比直接补充腺苷效果更好。Chen等[32]报道了自组装合成的PFTα-LDHs-CS纳米复合材料能够弥补壳聚糖(CS)仅有骨传导性而不具有骨诱导性的缺陷。LDHs-CS纳米复合材料相对于单独LDHs来说,对PFTα药物分子表现出更高的负载效率和更优异的药物缓释性能,可以刺激BMSCs成骨分化。某研究制备一种新型的具有良好的生物相容性和矿化性能的含有β-磷酸三钙(β-TCP)和LDHs的纳米复合材料(β-TCP-LDHs),不仅可以改善β-TCP的力学和抗压性能,适宜范围的微孔隙有利于毛细血管生长,还可以促进MSCs的黏附和增殖[33]。Huang等[34]制备了由聚多巴胺(polydopamine, PD)涂层LDHs(PD-LDHs)纳米复合材料交联的生物活性纳米PEG水凝胶。PD-LDHs不仅可以作为纳米交联剂增强水凝胶的机械强度,还可以促进人骨髓间充质干细胞的成骨分化。
Li等[35]在钛表面成功制备了一种Mg-Fe-LDHs薄膜,通过改变Mg/Fe原子占比调节LDHs膜的有机阴离子吸附量,从而调节机体组织微环境,并调控大鼠骨髓间充质干细胞(rat bone marrow mesenchymal stem cells, rBMMSCs)的增殖和成骨分化。结果表明,当Mg/Fe比值为4时对rBMMSCs的增殖和分化的促进作用最显著。Wang等[36]通过对LDHs设计优化,将其与石墨烯量子点(graphene quantum dots, GQD)进行结构复合,开发出的复合材料能有效提高GQD的生物利用度。利用该复合材料处理BMSCs,并在成骨分化的体系中分别进行7 d和14 d的培养,碱性磷酸酶染色和茜素红染色结果表明LDHs-GQD能显著促进BMSCs成骨分化,为GQD的体内应用和临床转化提供了前景。
2.2牙髓干细胞 牙髓干细胞(dental pulp stem cells,DPSCs)存在于牙髓内,通常呈纤维状,具有多向分化的潜能,免疫原性低,相较于其他间充质细胞更具有优势。临床研究中将牙髓干细胞与新型牙科材料结合作为支架或载体来处理、携带和植入患者体内用作牙髓再生。Tammaro等[37]在Bis-GMA/TEGDMA牙科树脂材料中加入少量的氟化物层状双氢氧化物(LDHs-F)纳米复合材料,改善Bis-GMA/TEGDMA牙科树脂材料机械性能,缓慢释放的氟化物离子有助于HDPSCs细胞分化。
2.3脂肪干细胞 脂肪间充质干细胞(adipose derived stem cells, ADSCs)取材较为容易,对机体损伤小,在体外稳定增殖,免疫原性低,目前除了被定向诱导分化为如成骨细胞等组织细胞用于骨组织修复的再生治疗,更被集中研究应用于皮肤伤口的愈合研究中[38-40]。Vasile等[41]通过熔融插层法在LDHs中加入了聚(3-羟基丁酸酯-co-3-羟基戊酸酯)(poly(3-hydroxybutyrate-co-3-hydroxyvalerate),PHBHV),并用十二烷基硫酸钠(SDS)修饰增加了PHBHV和LDHs的相容性,制备了兼具无序剥离、插层结构的PHBHV/LDHs-SDS纳米复合材料,该纳米复合材料对ADSCs表现出低毒性,且使得ADSCs黏附在PHBHV/LDHs-SDS 5 %纳米复合材料上,分泌生长因子参与伤口的愈合[42-43]。Shafiei等[44]采用LDHs搭载细胞外基质纤维支架模拟天然细胞外基质纤维,改善了支撑材料的机械性能,促进ADSCs的增殖与成脂分化。
3 层状双氢氧化物与神经干细胞
神经干细胞(neural stem cells, NSCs)是一类具有自我更新能力并具备可以分化成诸如神经元、少突胶质细胞和星形胶质细胞等的潜力[45]。已有研究表明,Mg-Al-LDHs的结构对抗原和药物分子表现出较高的亲和力,可增强免疫应答,表现出优异的生物安全性[46]。Zhu等[47]发现Mg-Al-LDHs纳米复合材料可以改善损伤区域的免疫微环境,促进NSCs定向分化和神经元的再生。Mg-Al-LDHs纳米复合材料对激活NSCs,加速NSCs迁移、控制神经分化以及诱导动作电位产生等方面表现出显著的性能。此外,该材料还具有可生物降解以缓释在材料上负载的神经营养因子3,调节损伤部位免疫微环境,抑制病变部位的炎症反应。
干细胞具有自我更新和免疫调节能力以及多向分化潜能,在组织学修复学等多领域展现诱人的应用前景。LDHs以其优异的负载效率和缓释性能,低成本、低毒性和较高的生物利用率有望在干细胞治疗中占据一席之地。研究表明,LDHs通过减小药物对ESCs毒性提高胚胎安全性,诱导成体干细胞增殖与成骨分化,调节组织微环境,抑制炎症反应。但是由于干细胞培养成本高昂且耗时长,在临床应用中无法控制干细胞干性与疗效的稳定性,存在一定的个体差异[48]。LDHs对干细胞的安全性评估尚无统一的行业标准等问题,今后还需要进一步研究其作为材料载体来揭示其在干细胞的活动规律,以便于保证临床转化中的安全性和有效性。随着纳米技术的研究与干细胞治疗相关技术的不断发展,LDHs及其他纳米材料今后会更加深入地研究并应用于干细胞治疗,这也将为干细胞治疗与再生医学等多领域提供一条新思路。

