液相色谱-质谱-质谱联用仪测定花生油中黄曲霉毒素B1
周琴 刘新月 李绍仙 张晓花 谭文涵
摘 要:目的:采用液相色谱-质谱-质谱联用仪建立花生油中黄曲霉毒素B1的检测方法。方法:样品提取经免疫亲和柱净化,以甲酸水和乙腈为流动相,采用phenomenx Kinetex 2.6 μm Biphenyl 100A色谱柱
(100 mm×3.0 mm)梯度洗脱分离,多重反应监测模式对花生油中黄曲霉毒素B1进行定性分析,同位素内标法定量。结果:黄曲霉毒素B1在1~20 ng·mL-1线性内呈良好线性关系(R2为0.999 3),在2.0 μg·kg-1、
5.0 μg·kg-1、10.0 μg·kg-1的加标水平下,回收率在94.1%~107.4%,相对标准偏差(n=6)为5.6%~9.3%,采用该方法测定花生油中黄曲霉毒素B1质控样,检测结果在质控样范围内。结论:该检测方法简便快捷、无需衍生、特异性强,灵敏度高且线性关系良好,准确度和精密度均满足定量分析的要求,适用于花生油中黄曲霉毒素B1的定量分析。
关键词:液相色谱-质谱-质谱联用仪(LC-MS/MS);黄曲霉毒素B1;花生油
Determination of Aflatoxin B1 in Peanut Oil by LC-MS-MS
ZHOU Qin, LIU Xinyue*, LI Shaoxian, ZHANG Xiaohua, TAN Wenhan
(Puer Comprehensive Technical Testing Center, Puer 665000, China)
Abstract: Objective: To establish a method for the determination of aflatoxin B1 in peanut oil by LC-MS/MS. Method: The sample was extracted and purified by an immunoaffinity column. Formic acid water and acetonitrile were used as mobile phases, and the gradient elution separation was carried out on the phenomenx Kinetex 2.6 μm Biphenyl 100A chromatographic column (100 mm×3.0 mm).The qualitative analysis of aflatoxin B1 in peanut oil was carried out by multiple reaction monitoring mode, and the quantity was determined by isotope internal standard. Result: Aflatoxin B1 showed a good linear relationship in the linear range of 1~20 ng·mL-1 (R2=0.999 3), at the spiked levels of 2.0 μg·kg-1, 5.0 μg·kg-1 and 10.0 μg·kg-1, the average recovery rate was 94.1%~107.4%, and the relative standard deviation (n=6) was 5.6%~9.3% . The method was used to determine aflatoxin B1 quality control samples in peanut oil, and the detection results were within the range of quality control samples. Conclusion: This detection method is simple, fast, does not require derivatization, has strong specificity, and has high sensitivity and good linear relationship. The accuracy and precision meet the requirements of quantitative analysis, and is suitable for the quantitative analysis of aflatoxin B1 in peanut oil.
Keywords: liquid chromatography tandem mass spectrometry (LC-MS/MS); aflatoxin B1; peanut oil
花生油含有豐富的不饱和脂肪酸,其中油酸能降低低密度脂蛋白胆固醇水平,而不会破坏高密度脂蛋白,有助于维持血脂平衡,预防心血管疾病[1]。此外,油酸还具有抗炎、预防肥胖、预防衰老、预防动脉硬化和增强自身免疫力的功能[2-3]。然而,在对人体有益的同时,花生油也存在安全隐患。黄曲霉毒素(Aflatoxin,AFT)是造成花生油污染的主要原因之一[4],在自然界中其主要以黄曲霉毒素B1、B2、G1和G2存在,具有强毒性、致癌性、致畸性和致突变性,而黄曲霉毒素B1(AFB1)含量最高[5-6]。何景等[7]2019年在抽检北京小包装花生油时,黄曲霉毒素检出率为26.67%。胡振等[8]在对2016—2017年广西14个地级市抽检食用植物油样品时发现,花生油中黄曲霉毒素B1检出率达到8.85%,花生油合格率仅为87.83%。真菌毒素是对人和动物有严重慢性毒性的物质[9],如果大量摄入或长期少量摄入黄曲霉毒素,可能会导致慢性中毒、增加致癌风险。因此,研究花生油中黄曲霉毒素B1的检测方法具有重要意义。
黄曲霉毒素检测方法有酶联免疫法(Enzyme-Linked Immunosorbent Assay,ELISA)[10]、高效液相色谱法(High Performance Liquid Chromatography,HPLC)[11]等,酶联免疫吸附法简单、快速、特异性高,但假阳性较多;高效液相色谱法具有良好的准确性和高灵敏度,但需要衍生,检测周期长,且较浪费溶剂。液相色谱-质谱-质谱联用仪(LC-MS/MS)特异性强,定性定量准确,检出限低,从而被广泛应用于农残、兽残以及真菌毒素类的痕量检测领域[12-15]。黄曲霉毒素的离子化状态可利用电喷雾离子源实现,电喷雾离子源有正、负离子两种模式,在正离子模式下效果最好[16],因此,黄曲霉毒素离子化模式为ESI+。黄曲霉毒素净化小柱包括两个类型:多功能净化柱与免疫亲和柱。其中,多功能净化柱采用复合材料,可以吸附蛋白质、色素等[16]。尽管这种方法的净化速度相对较快,但不能全面有效地消除干扰物质。因此,在实际实验中,多使用免疫亲和柱来净化样品。本研究利用液相色谱-质谱-质谱联用仪对花生油中黄曲霉毒素B1进行定量分析,并对实验条件进行了探讨。
1 材料与方法
1.1 仪器与试剂
液相色谱-质谱-质谱联用仪(3200QTRAP,美国AB Scies);色谱柱(phenomenex Kinetex 2.6 μm Biphenyl 100A,100 mm×3.0 mm);3K15台式高速冷冻离心机(德国Sigma公司);涡旋搅拌混匀器(英国Grant公司);AL204电子天平(瑞士梅特勒);IKA HS501振荡器(德国IKA仪器设备有限公司);N-EVAP-24氮吹仪(美国Organomation公司);微量可调移液枪(0.1~1.0 mL,德国Eppendorf公司)。
花生油,购于沃尔玛超市。黄曲霉毒素
B1(100 μg·mL-1,天津阿尔塔科技有限公司);黄曲霉毒素B1内标液(0.5 μg·mL-1,天津阿尔塔科技有限公司);乙腈(色谱纯,德国 Merck 公司);黄曲霉毒素B1免疫亲和柱(普瑞邦公司);质控样[MRM-AO,质控值范围为(12.44±1.38)μg·kg-1,普瑞邦];甲酸(分析纯,阿拉丁公司)。
1.2 实验方法
1.2.1 标准使用液配制
准确移取1 mL浓度为100 μg·mL-1的标准储备液,用甲醇定容至10 mL,配制浓度为10 μg·mL-1的标准储备液,再准确移取1 mL浓度为 10 μg·mL-1的标准储备液用甲醇定容至10 mL,配制浓度为1 μg·mL-1的标准中间液,分别吸取1 μL、2 μL、4 μL、6 μL、8 μL、10 μL和20 μL标准中间液于1 mL进样瓶中,并同时加入40 μL浓度为0.05 μg·mL-1的黄曲霉毒素B1内标液,用初始流动相定容至1 mL配制系列标准工作液浓度为1.0 ng·mL-1、2.0 ng·mL-1、4.0 ng·mL-1、6.0 ng·mL-1、8.0 ng·mL-1、10.0 ng·mL-1和20.0 ng·mL-1。
1.2.2 样品前处理
准确称取5 g试样于50 mL离心管中,加入
20 μL浓度为1 μg·mL-1的黄曲霉毒素B1标准品和200 μL浓度为0.05 μg·mL-1的黄曲霉毒素B1内标液,加入20 mL乙腈-水溶液(80+20),涡旋混匀,置于振荡器振荡20 min,离心,取上清液备用。准确移取4 mL上清液,加入46 mL 0.1%吐温-20 PBS溶液混匀,将待净化液转移至50 mL注射器筒内,以恒定流速流经已活化的免疫亲和柱,20 mL超纯水淋洗免疫亲和柱,真空泵抽干。2 mL甲醇洗脱黄曲霉毒素B1免疫亲和柱,真空泵抽干全部亲和柱,在水浴条件下将洗脱液浓缩至近干,初始流动相定容至
1 mL,过0.22 μm滤膜,滤入样品瓶上机测定。
1.2.3 仪器条件
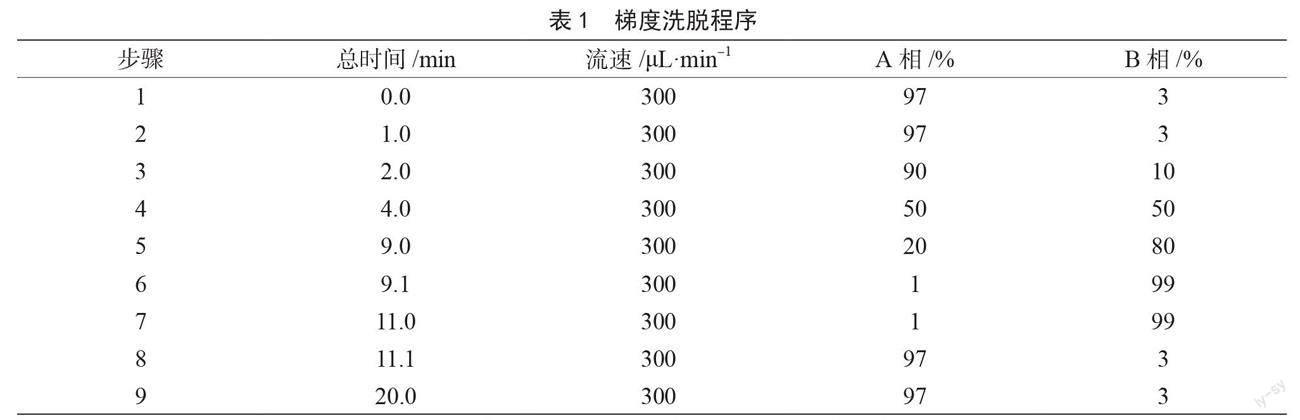
色谱条件:phenomenex Kinetex 2.6 μm Biphenyl-100A色谱柱(100 mm×3.0 mm,2.6 ?m),进样量10.0 μL;流动相A为乙腈,B为0.1%甲酸水溶液;柱温35 ℃,梯度洗脱程序见表1。
质谱条件:离子化模式ESI+,电子能量70 eV;离子源温度280 ℃;接口温度280 ℃;扫描方式多反应监测(Multiple Reaction Monitoring,MRM)。
2 结果与分析
2.1 仪器分析参数
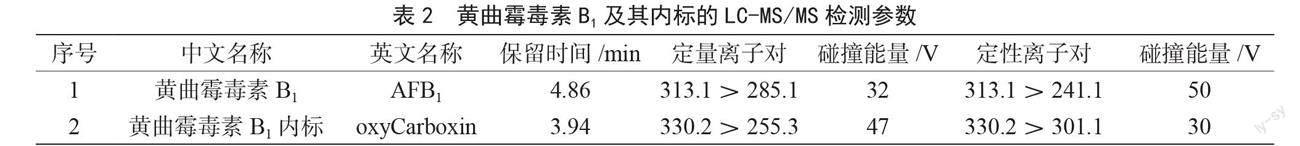
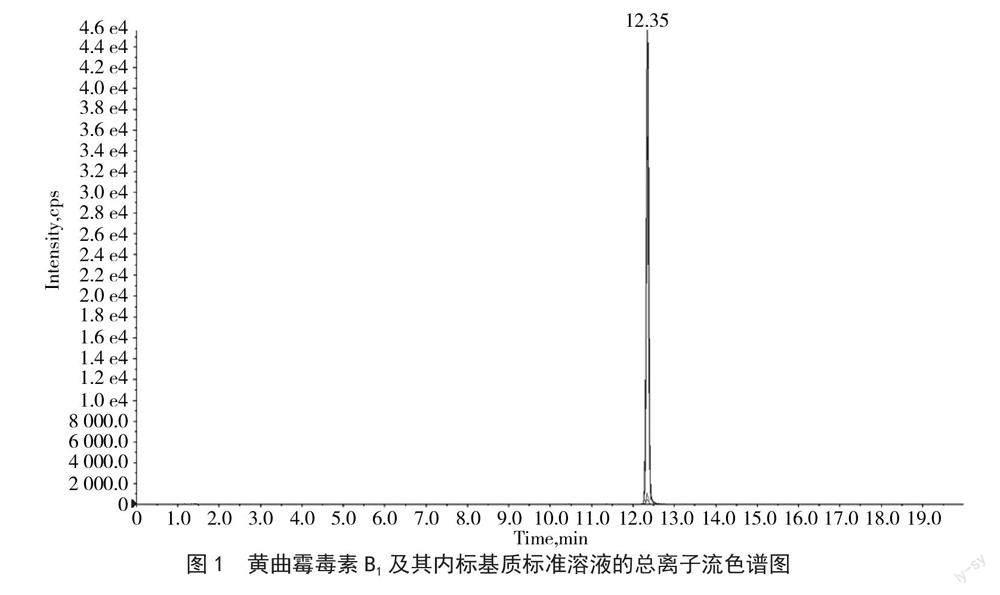
将体积浓度为1 μg·mL-1的黄曲霉毒素B1和内标单标分别通过质谱仪所配的外置进样泵进样,分别寻找其母离子和子离子并优化碰撞电压和去簇电压。黄曲霉毒素B1及其内标在串联质谱上的检测参数见表2,黄曲霉毒素B1及其内标基质标准溶液的总离子流色谱图见图1。
2.2 方法线性范围和检出限
在1.2.3仪器条件下,根据1.2.1配制的系列标准工作液:1 ng·mL-1、2 ng·mL-1、4 ng·mL-1、6 ng·mL-1、8 ng·mL-1、10 ng·mL-1和20.0 ng·mL-1进样分析;工作曲线横坐标为目标物质量浓度C(ng·mL-1);工作曲线纵坐标为黄曲霉毒素B1峰面积与内标峰面积之比。图2为黄曲霉毒素B1标准曲线所拟合的线性方程。由图2可知该检测方法在1~20 ng·mL-1的质量浓度内线性关系良好,相关系数R2为0.999 3。
2.3 方法的准确度和精密度
在花生油空白基質中分别加入3个水平的黄曲霉毒素B1标准品,混匀1 min,使花生油空白基质与所加入的标准品充分接触后,加入200 μL浓度为0.05 μg·mL-1的黄曲霉毒素B1内标液,按1.2.2中的方法充分提取和净化后检测。每个进行6次平行实验,计算其平均回收率和相对标准偏差(Relative Standard Deviation,RSD),以考察方法的准确度和精确度,结果见表3。
由表3可知,在不同加标水平下,黄曲霉毒素B1的回收率在94.1%~107.4%,相对偏差(RSD)为5.6%~9.3%,回收率满足《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)食品理化检验中回收率要求即加标量小于0.1 mg·kg-1时回收率为60%~120%,相对标准偏差小于15%。表明该方法的回收率和精密度满足花生油中黄曲霉毒素B1残留检测的要求。
2.4 质控样測定
将所购质控样采用该方法进行测定,测定结果为13.12 μg·kg-1,质控样质控值为(12.44±1.38)μg·kg-1,测定值在质控值范围内,表明该方法对花生油中黄曲霉毒素B1阳性样品的测定具有较高的准确性,适用于实验室中花生油中黄曲霉毒素B1的准确定量分析。
3 结论
本研究建立了花生油中黄曲霉毒素B1的LC-MS/MS测定方法,样品前处理采用免疫亲和柱技术,该方法无需进行衍生,简便快捷、灵敏度高,特异性强、准确度和精密度均满足定量分析的要求。在1~
20 ng·mL-1线性内呈良好线性关系(R2为0.999 3),在2.0 μg·kg-1、5.0 μg·kg-1、10.0 μg·kg-1的加标水平下,回收率在94.1%~107.4%,相对标准偏差(n=6)为5.6%~9.3%,采用该方法测定花生油中黄曲霉毒素质控样,检测结果在质控样质控值范围内。因此,该方法可用于花生油中黄曲霉毒素B1的快速检测。
参考文献
[1]STEPHENS A M,DEAN L L,DAVIS J P,et al.Peanuts, peanut oil, and fat free peanut flour reduced cardiovascular disease risk factors and the development of atherosclerosis in syrian golden Hamsters[J].Journal of Food Science,2010,75(4):116-122.
[2]SALES-CAMPOS H,PATRICIA R D S,CREMA PEGHINI B,et al.An overview of the modulatory effects of oleic acid in health and disease[J].Mini Reviews in Medicinal Chemistry,2013,13(2):201-210.
[3]VASSILIOU E K,GONZALEZ A,GARCIA C,et al.Oleic acid and peanut oil high in oleic acid reverse the inhibitory effect of insulin production of the inflammatory cytokine TNF-α both in vitro and in vivo systems[J].Lipids in Health and Disease,2009,8(1):25.
[4]BHAT R R,KASA R N.Challenges and issues concerning mycotoxins contamination in oil seeds and their edible oils: updates from last decade[J].Food Chemistry,2017,215(15):425-437.
[5]劳文艳,林素珍.黄曲霉毒素对食品的污染及危害[J].北京联合大学学报(自然科学版),2011,25(1):64-69.
[6]齐惠萍,吕建明,李常青.ELISA法检测食醋中黄曲霉毒素B1方法的改进[J].中国食品卫生杂志,2008,20(4):313-315.
[7]何景,杨丹.北京市地区小包装食用油中真菌毒素污染状况调查[J].中国油脂,2019,44(6):79-82.
[8]胡振,周芳华,韦波.2016—2017年广西食用植物油质量安全监测评价分析[J].中国油脂,2020,45(2):91-94.
[9]孙嘉笛,徐洪文,徐一达,等.食用植物油中黄曲霉毒素和赭曲霉毒素的污染状况及特征分析[J].中国油脂,2022,47(9):35-43.
[10]江涛,柳桢,郑佳,等.总黄曲霉毒素ELISA定量检测方法的研制[J].中国食品卫生杂志,2006,18(4):292-296.
[11]高秀芬,计融,李燕俊,等.高效液相色谱法测定玉米中的黄曲霉毒素[J].中国食品卫生杂志,2007,19(2):105-108.
[12]李优,盛永刚,伊雄海,等.固相萃取/液相色谱-串联质谱法测定果蔬中草铵膦的残留量[J].分析测试学报,2015,34(9):993-998.
[13]郭欣妍,王娜,郝利君,等.超高效液相色谱/串联质谱法同时测定水、土壤及粪便中25种抗生素[J].分析化学,2015,43(1):13-20.
[14]罗辉泰,黄晓兰,吴惠勤,等.分散固相萃取/高效液相色谱-串联质谱法快速测定饲料中87种药物残留[J].分析测试学报,2015,34(9):979-985.
[15]曾涛,罗晓燕,胡国媛,等.茶叶中黄曲霉毒素的碘柱后衍生化和光化学柱后衍生化-高效液相色谱法比较[J].中国卫生检验杂志,2016,26(3):323-325.
[16]邢天一.液相色谱串联质谱法检测食品中的黄曲霉毒素实践探讨[J].农民致富之友,2017(23):244.

