甜瓜抗链格孢侵染病程相关蛋白及苯丙烷代谢酶的变化
刘 阳,白羽嘉 ,张郑啸,楚晨俐,王甜甜,冯作山
(1.新疆农业大学食品科学与药学学院,乌鲁木齐 830052;2.新疆果品采后科学技术重点实验室,乌鲁木齐 830052)
0 引 言
【研究意义】甜瓜为葫芦科黄瓜属植物,是新疆优质的特色果品,其主要以新疆的吐鲁番、哈密、喀什等地为主要生产区,受到国内外消费者喜爱,每年大量出口到欧美等发达地区[1]。但甜瓜易感染病原微生物导致其不易储存,其中黑斑病是一种甜瓜易感的真菌病害之一,而链格孢是引起此病害的病原菌[2],甜瓜感染黑斑病早期时发病部位出现水渍并呈湿腐状,进一步的症状为感染部位果皮组织变软开始腐烂,病程后期甜瓜果实表面出现菌丝,菌丝产黑色孢子及分生孢子梗,果实表皮可见黑色霉斑[3-5]。每年甜瓜因感染黑斑病对瓜农造成巨大损失,严重制约新疆甜瓜产业协调发展[6]。因此研究甜瓜内源抗病性,病原微生物侵染甜瓜时产生病程相关蛋白及苯丙烷代谢酶的差异,为甜瓜果实的贮运和保鲜提供了理论依据。【前人研究进展】甜瓜果实受到病原微生物侵染会激发果实产生相关抗病蛋白和苯丙烷代谢酶,是甜瓜果实自发抵御病原微生物侵染保护自身的主要途径[7-8]。而病程相关蛋白是果实防卫体系的一个重要组成部分[9-10]。真菌的细胞壁骨架由几丁质和纤维素构成,真菌侵染甜瓜后,果实细胞会产生甜瓜几丁质酶(Chitinase,CHT)和β-1,3-葡聚糖酶(β-1,3-Glucan,GLU)等病程相关蛋白来分解真菌细胞壁骨架,进而实现植物细胞抵御病原微生物的侵袭[11-14]。而病程相关蛋白的活性和植物的抗病性呈正相关,因此通过测定病程相关蛋白的活性可以判断植物的抗病性强弱[15-17]。果实贮藏中,苯丙烷代谢途径产生的抗菌物质在抗病过程中具有重要作用[18-19]。【本研究切入点】抗病性的强弱可通过苯丙烷代谢相关酶的活性直观地反映[20-22]。目前相关的研究,大多是关于低温贮藏的甜瓜病程相关蛋白及苯丙烷代谢酶活变化规律[5,6],而常温贮藏下的酶活性变化更能直观的反映采后甜瓜在自然环境下应对病原微生物侵染时的内在抗病性,内源性抗病机制也体现得更直观,需测定常温贮藏下的染病甜瓜病程相关蛋白和苯丙烷代谢相关酶的活性,研究甜瓜的内在抗病性。【拟解决的关键问题】材料为伽师瓜和86-1甜瓜,通过损伤接种链格孢菌,研究常温贮藏时两种甜瓜外果皮、内果皮及果肉组织病程相关蛋白及苯丙烷代谢酶的变化规律,对比果皮和果肉的抗病性差异,了解抗病害的内在机制,完善采后甜瓜病害的知识体系,为甜瓜采后贮藏保鲜技术的突破创新构建良好的科学基础。
1 材料与方法
1.1 材 料
1.1.1 甜 瓜
伽师瓜、86-1甜瓜:均来自新疆伽师县,果实发育良好、未发病、无损伤、成熟度一致。伽师瓜质量(4.0±0.5) kg,86-1甜瓜质量(3.5±0.5) kg。
链格孢菌(Alternariaalternata):伽师瓜上分离(自然发病),马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)28℃培养,4℃保藏。
1.1.2 试 剂
ATP、CoA、PMSF、PVP、p-香豆酸、DTT、L-苯丙氨酸、亮抑酶肽、EDTA、β-巯基乙醇,生工生物工程(上海)股份有限公司;葡萄糖-6-磷酸二钠、几丁质、昆布多糖、Tris,美国西格玛奥德里奇公司;氢氧化钠、无水乙醇、无水乙酸钠、五水合四硼酸钾、无水亚硫酸钠、硫酸镁、3,5-二硝基水杨酸、丙酮、冰乙酸、结晶酚、酒石酸钾钠、L-抗坏血酸、浓盐酸、氯化镁、丙三醇、硼砂、硼酸,天津市福晨化学试剂;PDA培养基,北京奥博星生物技术有限责任公司。
1.1.3 仪器与设备
无菌操作台(NBCJ-B型)、恒温霉菌培养箱(MHP-250型):上海鸿都科技有限公司;立式压力蒸汽灭菌器(LDZX-50KBS型):上海申安医疗器械厂;显微镜(XSP-2C型):上海蔡康光学仪器有限公司;电子天平(FA2104N型):上海民桥精密仪器有限公司;pH计(FE20型):梅特勒-托利多仪器有限公司;高速分散器(XHF-DY型):宁波新芝生物科技有限公司;高速冷冻离心机(TGL-16G型):上海安亭科学仪器厂;紫外-可见分光光度计(TU-1810PC型):北京普析通用公司。
1.2 方 法
1.2.1 甜瓜预处理
外表皮的清洁:自来水冲洗,后用2%H2O2浸泡30 s,再次自来水冲洗3次。晾干贮于室内阴凉干燥处。
1.2.2 采后甜瓜损伤接种链格孢
损伤接种:甜瓜果实沿赤道穿透打孔,每孔直径3.5 mm、深度5 mm,每孔等距(相距7 cm),实验组:链格孢制备孢子悬浮液,每孔接20 μL,制备浓度1.0×106spores/mL[23](含0.01%吐温-20,按照体积分数计算);对照组接入无菌水,每孔接20 μL。
室温贮藏(25~28℃,空气相对湿度35%~40%)。
1.2.3 取 样
甜瓜损伤接种链格孢,分别于接种后的第0、2、4、6、8、10、12、14、16 d取样,共取样9次,每次随机选择试验组与对照组各9个甜瓜。取病斑周围5 mm处组织[外果皮厚度(1.0±0.3) mm、内果皮厚度(5.0±0.3) mm,果肉厚度(10.0±0.3) mm]。
1.2.4 测定指标
1.2.4.1 病斑直径
沿接种链格孢部位,将甜瓜果实纵向剖开,测定病斑及过敏反应组织,每次测定9个果实,计算平均值,即为病斑直径。
1.2.4.2 酶活性
CHT的活性测定参照曹建康[24]的方法,以每秒每克鲜重样品中酶分解胶状几丁质产生1×10-9molN-乙酰糖胺为一个几丁质酶活性单位(U),活性以U/(g·FW)表示。
GLU活性的测定参照曹建康[24]的方法,以每秒每克鲜重样品中酶分解昆布多糖产生1×10-9mol葡萄糖为一个β-1,3-葡聚糖酶活性单位(U),活性以U/(g·FW)表示。
PAL活性的测定参照曹建康[24]的方法并稍作修改,取2.0 g冷冻果肉组织,加入4 mL提取液(100 mmol/L硼酸缓冲液,含PVP0.04 g/mL、EDTA0.58 mg/mL、0.35 μL/mLβ-巯基乙醇),高速分散器打碎,4℃12 000 ×g离心30 min,上清液即粗酶液。试管中加入6 mL硼酸缓冲液(100 mmol/L),1 mL苯丙氨酸溶液(20 mmol/L),30℃保温30 min,加入1mL粗酶液,290 nm处测定吸光度,活性以U/(g·FW)表示。
C4H活性的测定参照曹建康[24]方法,活性以U/(g·FW)表示。
4CL活性的测定参照曹建康[24]的方法并稍作修改,取1.0 g冷冻果肉组织,加入5 mL提取液(0.2 mol/LTris-HCL缓冲液,含甘油250 mL/L、DTT15.425 g/L),高速分散器打碎,4℃12 000×g离心20 min,上清液即粗酶液。试管中加入0.45 mL P-香豆酸溶液(5 μmol/mL)、1.35 mL硫酸镁溶液(15 μmol/L)、0.45 mL辅酶A(1 μmol/mL)、0.45 mL ATP溶液(0uol/mL),1 mL粗酶液,4℃保温10 min。333 nm处测定吸光度活,活性以U/(g·FW)表示。
1.3 数据处理
数据分析处理:IBM SPSS Statistics 23.0,绘图:Origin2018,采用Duncan法进行差异显著性分析(P<0.05,差异显著)。
2 结果与分析
2.1 甜瓜品种及甜瓜不同部位的抗病性比较
研究表明,接种链格孢后,86-1甜瓜于第2 d出现病斑,伽师瓜于第4 d出现病斑,86-1甜瓜病斑出现时间早于伽师瓜。接种链格孢后在贮藏期间两类甜瓜病斑直径呈不断扩大的趋势。在贮藏期间,伽师瓜的病斑直径始终小于86-1甜瓜。侵染第16 d时,86-1甜瓜果肉组织的病斑直径是3.30 cm,伽师瓜果肉组织是2.40 cm,伽师瓜是86-1甜瓜的1.38倍;86-1甜瓜果皮组织病斑直径是3.10 cm,伽师瓜果皮组织病斑直径是2.00 cm,86-1甜瓜是伽师瓜的1.55倍,差异显著(P<0.05),两种甜瓜的果肉病斑增长速度大于果皮。伽师瓜病斑直径增长速度小于86-1甜瓜。伽师瓜抗病性优于86-1甜瓜。图1,图2

图1 链格孢侵染后甜瓜病斑直径的变化

图2 不同天数甜瓜病斑
2.2 链格孢侵染不同种类甜瓜果实后CHT活性变化
研究表明,在贮藏期内,CHT的活性先升高后下降,侵染初期上升较慢至中期急速上升达到顶峰后下降,实验组酶活性及增长速率均大于对照组;外果皮CHT活性大于内果皮大于果肉,差异显著(P<0.05);伽师瓜和86-1甜瓜的外果皮实验组分别在8 d和10 d达到酶活高峰,伽师瓜比86-1甜瓜先到达酶活高峰,伽师瓜酶活是49.53 U,86-1甜瓜的酶活是46.40 U,伽师瓜酶活是86-1甜瓜的1.07倍;伽师瓜和86-1甜瓜的内果皮试验组分别在10 d和8 d达到酶活高峰,伽师瓜酶活是42.71 U,86-1甜瓜的酶活是34.47 U,伽师瓜酶活是86-1甜瓜的1.24倍;伽师瓜与86-1甜瓜果肉试验组分别在8 d与10 d达到酶活高峰,伽师瓜酶活是40.31 U,86-1甜瓜的酶活是32.87 U,伽师瓜酶活是86-1甜瓜的1.23倍。图3~5

图3 链格孢侵染后甜瓜外果皮CHT变化

图4 链格孢侵染后甜瓜内果皮CHT变化
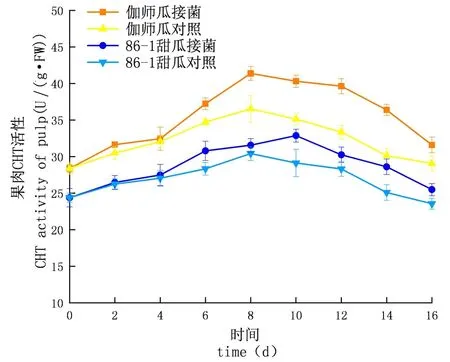
图5 链格孢侵染后甜瓜果肉CHT变化
2.3 链格孢侵染不同种类甜瓜果实GLU活性变化
研究表明,链格孢侵染甜瓜后,在贮藏期内,GLU的活性先升高后下降,侵染初期上升较慢至中期急速上升达到顶峰后下降,试验组酶活性及增长速率均大于对照组;外果皮试验组伽师瓜和86-1甜瓜在分别8和10 d达到酶活性高峰,伽师瓜酶活是35.53 U,86-1甜瓜的酶活是27.36 U,伽师瓜酶活性是86-1甜瓜的1.30倍;内果皮试验组伽师瓜和86-1甜瓜在8和10 d达到酶活性高峰,伽师瓜酶活是34.63 U,86-1甜瓜的酶活是28.13 U,伽师瓜酶活是86-1甜瓜的1.38倍;果肉试验组伽师瓜和86-1甜瓜在8 d和10 d达到酶活性高峰,伽师瓜酶活是31.38 U,86-1甜瓜的酶活是20.54 U,伽师瓜酶活是86-1甜瓜的1.53倍;GLU活性外果皮大于内果皮大于果肉,差异显著(P<0.05)。甜瓜接种链格孢后,GLU与CHT的活性变化趋势相同,两种酶在抵抗链格孢的过程中起到协同作用,甜瓜遭受链格孢侵染后,病程相关蛋白含量显著升高,伽师瓜果实的病程相关蛋白相较于86-1甜瓜,始终维持在较高水平(P<0.05)。图6~8
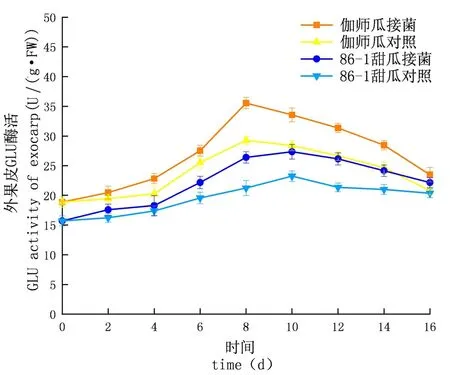
图6 链格孢侵染后甜瓜外果皮GLU变化

图7 链格孢侵染后甜瓜内果皮GLU变化
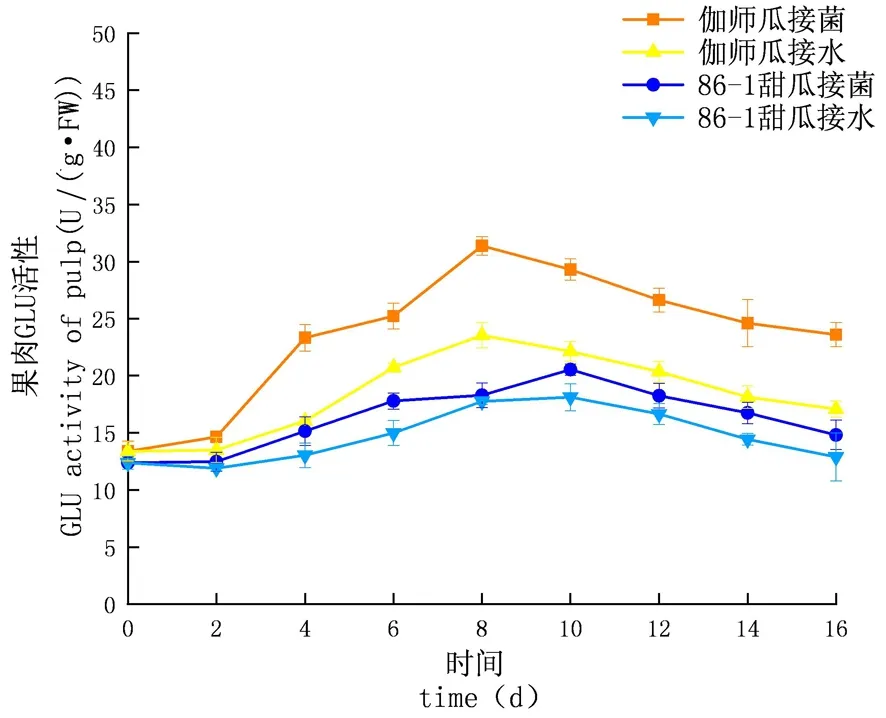
图8 链格孢侵染后甜瓜果肉GLU变化
2.4 链格孢侵染不同种类甜瓜果实后PAL活性变化
研究表明,链格孢侵染甜瓜后,在贮藏期间,PAL的活性先升高后下降,PAL酶活性试验组大于对照组,增长速率试验组大于对照组,PAL酶活性外果皮大于内果皮大于果肉,差异显著(P<0.05);外果皮试验组伽师瓜和86-1甜瓜分别在8和10 d达到酶活高峰,伽师瓜酶活是44.55 U,86-1甜瓜的酶活是35.39 U,伽师瓜酶活是86-1甜瓜的1.26倍;内果皮试验组伽师瓜和86-1甜瓜分别在8和10 d达到酶活高峰,伽师瓜酶活是41.63 U,86-1甜瓜的酶活是34.13 U,伽师瓜酶活是86-1甜瓜的1.22倍;果肉试验组伽师瓜和86-1甜瓜在8 d达到酶活性高峰,伽师瓜酶活是39.75 U,86-1甜瓜的酶活是30.54 U,伽师瓜酶活是86-1甜瓜的1.30倍。甜瓜损伤接种链格孢后果实PAL呈先升高后下降的趋势,甜瓜果实体内PAL活性因链格孢侵染而升高。图9~11
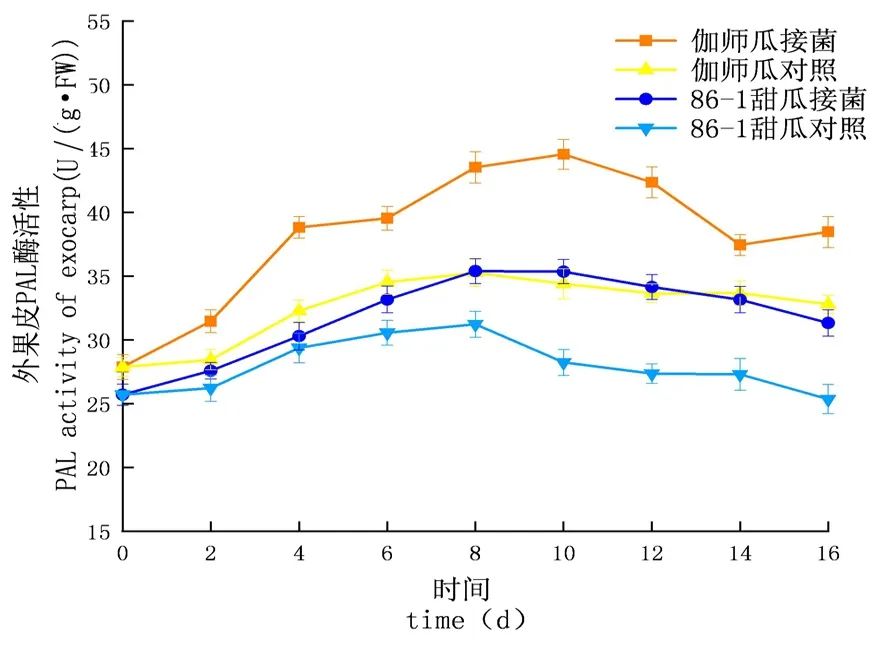
图9 链格孢侵染后甜瓜外果皮PAL变化
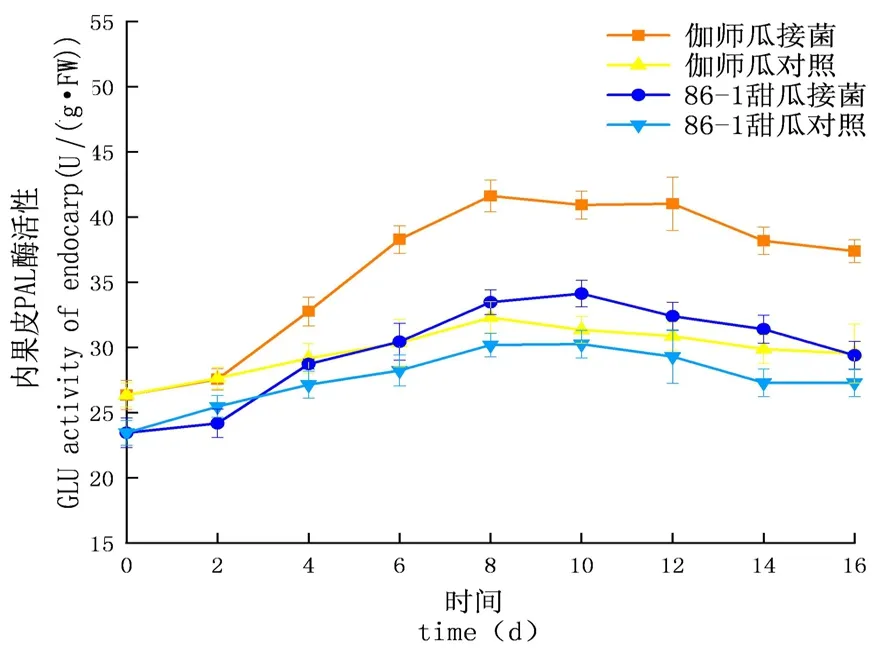
图10 链格孢侵染后甜瓜内果皮PAL变化

图11 链格孢侵染后甜瓜果肉PAL变化
2.5 链格孢侵染不同种类甜瓜果实后C4H活性变化
研究表明,链格孢侵染后,甜瓜在贮藏期间,C4H活性先升高后下降,C4H酶活性外果皮大于内果皮大于果肉,差异显著(P<0.05),试验组酶活性大于对照组且试验组的增长速率大于对照组;外果皮试验组伽师瓜和86-1甜瓜分别在8和10 d到达酶活性高峰,伽师瓜酶活是42.53 U,86-1甜瓜的酶活是35.36 U,伽师瓜酶活是86-1甜瓜的1.20倍;内果皮试验组伽师瓜和86-1甜瓜分别在8和10 d到达酶活高峰,伽师瓜酶活是40.62 U,86-1甜瓜的酶活是35.13 U,伽师瓜酶活性是86-1甜瓜的1.16倍;果肉试验组伽师瓜和86-1甜瓜分别在8和10 d到达酶活高峰,伽师瓜酶活是36.38 U,86-1甜瓜的酶活是30.29 U,伽师瓜酶活性是86-1甜瓜的1.20倍。图12~14

图12 链格孢侵染后甜瓜外果皮C4H变化

图13 链格孢侵染后甜瓜内果皮C4H变化
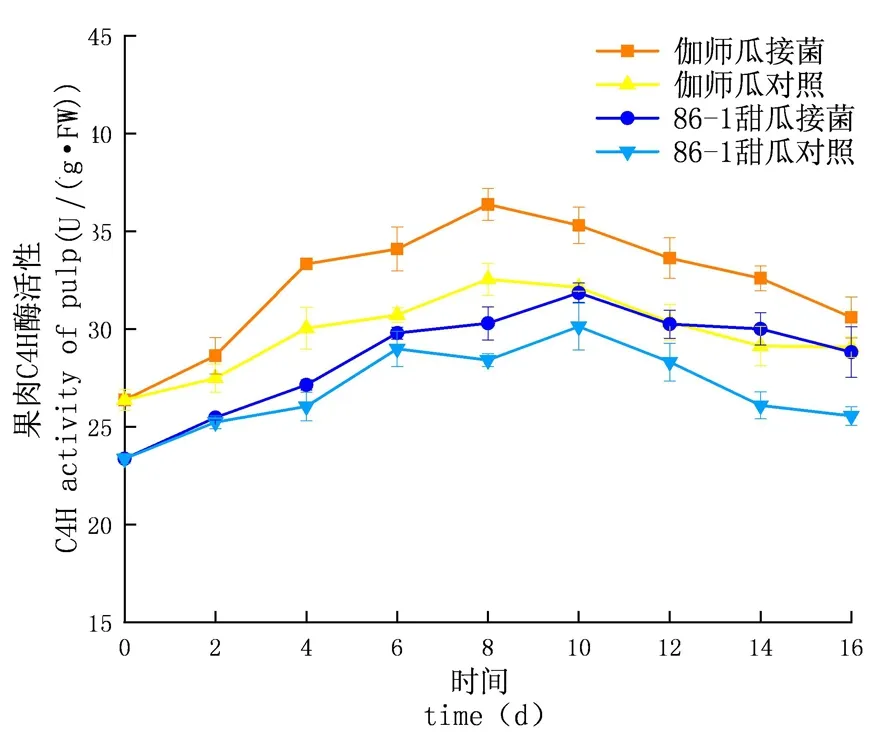
图14 链格孢侵染后甜瓜果肉C4H变化
2.6 链格孢侵染不同种类甜瓜果实后4CL活性变化
研究表明,链格孢侵染甜瓜后,在贮藏期内,4CL的活性先升高再下降,C4H酶活性外果皮大于内果皮大于果肉,差异显著(P<0.05),试验组酶活性大于对照组且试验组的增长速率大于对照组;外果皮试验组伽师瓜和86-1甜瓜分别在8和10 d到达酶活高峰,伽师瓜酶活是49.53 U,86-1甜瓜的酶活是46.40 U,伽师瓜酶活性是86-1甜瓜的1.29倍;内果皮试验组伽师瓜和,86-1甜瓜分别在8 d和10 d到达酶活高峰,伽师瓜酶活是49.53 U,86-1甜瓜的酶活是46.40 U,伽师瓜酶活性是86-1甜瓜的1.26倍;果肉试验组伽师瓜和86-1甜瓜分别在8和10 d到达酶活高峰,伽师瓜酶活是31.37 U,86-1甜瓜的酶活是26.69 U,果肉酶活性伽师瓜是86-1甜瓜的1.18倍。苯丙烷代谢的PAL、C4H和4CL 3种酶,在甜瓜应对链格孢侵染的过程中明显增多,与86-1甜瓜相比,伽师瓜更早地启动了苯丙烷代谢机制,伽师瓜苯丙烷代谢相关酶的活性大于86-1甜瓜。图15~17

图15 链格孢侵染后甜瓜外果皮4CL变化
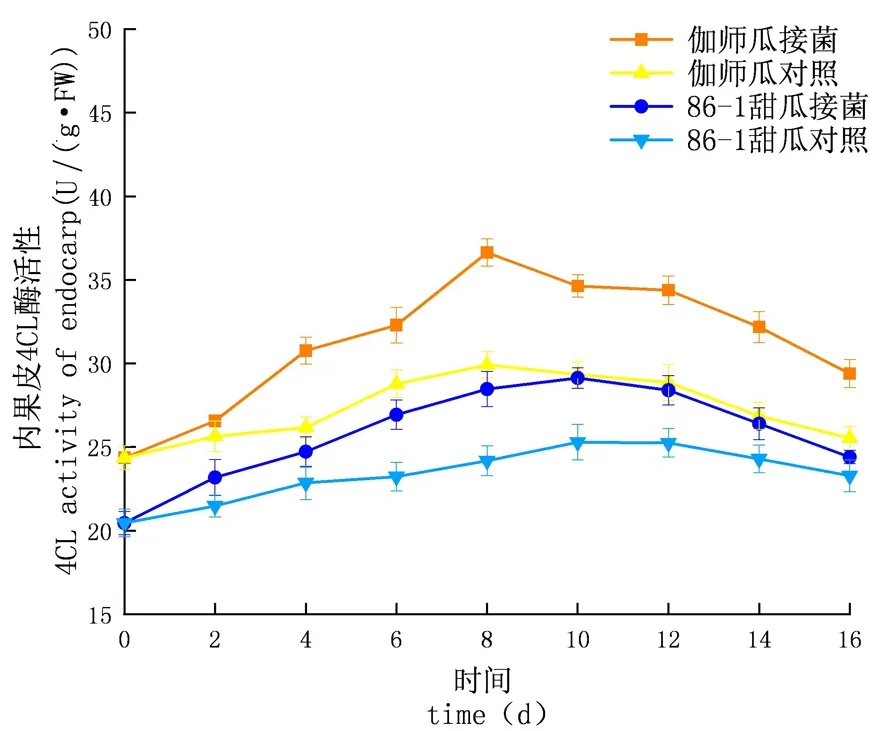
图16 链格孢侵染后甜瓜内果皮4CL变化
3 讨 论
李梦等[25]的研究表明接种链格孢后,7℃贮藏时,伽师瓜和86-1甜瓜的果肉病斑直径大于果皮,86-1甜瓜的病斑直径大于伽师瓜,与本研究结果一致,由此推论贮藏温度对甜瓜病斑直径的增长无明显影响。王瑾等[5]的研究结果低温贮藏时对照组的CHT活性先升高后降低的趋势不明显,而研究显示常温贮藏时对照组的CHT活性先升高后降低的趋势较为明显。玛尔哈巴等[9]研究了甜瓜损伤接种链格孢后低温贮藏时病程相关蛋白的变化规律,与研究甜瓜损伤接种链格孢后常温贮藏时的研究结果一致,低温和常温贮藏时,甜瓜抵抗链格孢侵染时病程相关蛋白含量均呈现先升高后下降的趋势。PAL的升高证实了链格孢的侵染可以诱导植物产生多种抗性,也增强了植物抵抗病原物的能力[13-22],研究测定链格孢侵染后的甜瓜果实PAL的酶活性趋势与张培岭[26]的研究结果一致。
蒋超男等[20]的研究结果表明,从寡雄腐霉中提取的具有信号传导作用的寡雄蛋白可以诱导马铃薯的C4H活性显著升高,C4H活性在寡熊蛋白诱导后呈现先升高后下降的趋势,与研究甜瓜被链格孢侵染后C4H的变化趋势一致,植物在受到真菌的侵染时会升高C4H活性来抵抗病原菌对其的破坏。张培岭等[28]的研究结果表明,甜瓜损伤接种链格孢后低温贮藏,果实4CL活性变化为先升高后下降,与实验研究结果一致,由此可见甜瓜果实在受到链格孢侵染后通过提高苯丙烷代谢相关酶的活性来抵抗链格孢的侵染,且温度对4CL的活性变化趋势无明显影响。
研究结果显示,不同种类甜瓜遭受链格孢侵染后,病程相关蛋白含量显著升高(P<0.05),其中伽师瓜在受链格孢侵染后病程相关蛋白在0~4 d迅速上升,相较于86-1甜瓜,其始终维持在较高水平(P<0.05),与病斑直径显著小于86-1甜瓜的试验结果一致,可见病程相关蛋白在甜瓜抗链格孢侵染的过程中起到了积极的作用。研究表明,苯丙烷代谢的PAL、C4H和4CL 3种酶,在甜瓜应对链格孢侵染的过程中明显增多(P<0.05),与86-1甜瓜相比,伽师瓜更早地启动了苯丙烷代谢机制,伽师瓜苯丙烷代谢相关酶的活性大于86-1甜瓜,印证了苯丙烷代谢在果实应对病原物的过程中起到了积极的应对作用。甜瓜不同组织应对链格孢侵染时,产生酶的速率也有所不同,链格孢侵染后,两种甜瓜外果皮产生抗病酶的速率最快,抗病酶活性迅速升高,内果皮次之,果肉产生抗病酶速率最慢,甜瓜抗病酶活性外果皮大于内果皮大于果肉。
目前链格孢侵染甜瓜相关研究的贮藏温度大都为低温,研究在前人的基础上,探究常温贮藏时不同甜瓜的病程相关蛋白和苯丙烷代谢相关酶的活性差异,对比损伤接种链格孢后甜瓜果实在低温贮藏时的研究[5,6,9,26],发现贮藏温度对甜瓜果实病程相关蛋白和苯丙烷代谢酶的变化趋势无明显影响,酶活呈现先升高后下降的趋势,不论是低温或常温贮藏,甜瓜均产生大量病程相关蛋白和苯丙烷代谢相关酶来抵御病原菌侵染。

图17 链格孢侵染后甜瓜果肉4CL变化
4 结 论
4.1链格孢侵染后贮藏16 d时,86-1甜瓜的果皮与果肉的病斑直径分别是3.10和3.30 cm;伽师瓜的果皮与果肉的病斑直径分别是2.0和2.4 cm;86-1甜瓜的果皮与果肉的病斑直径分别是伽师瓜的1.55倍和1.38倍。在贮藏期内,伽师瓜病斑直径始终小于86-1甜瓜,果皮病斑直径始终小于果肉病斑直径。
4.2甜瓜病程相关蛋白和苯丙烷代谢酶的活性与甜瓜的抗病性密切相关,两种甜瓜果实的病程相关蛋白和苯丙烷代谢酶在贮藏前期迅速升高,到达顶峰后逐渐下降,伽师瓜CHT、GLU、PAL、C4H、4CL 5种酶的活性均高于86-1甜瓜,伽师瓜酶活性升高速率大于86-1甜瓜。甜瓜不同组织的病程相关蛋白和苯丙烷代谢酶的活性也有所差异,外果皮的酶活性强于内果皮强于果肉,且在酶活生成速率上外果皮大于内果皮大于果肉,伽师瓜抗病性强于86-1甜瓜,果皮抗病性强于果肉。
——伽师瓜

