油莎豆水溶性糖提取工艺及生物转化低聚果糖的研究
李晨飞, 闫晓侠, 董舒月, 刁梦雪, 卢笑雨, 于亚莉, 张铁华
(吉林大学食品科学与工程学院,长春 130062)
油莎豆(Cyperusesculeutus,CE)作为绿色健康的多用途经济型油料作物,我国农户对其种植热情逐年高涨,油莎豆成为一种新型待开发食品原料[1-3]。随着油莎豆油的不断开发提取,大量的脱脂残留物副产品应运而生。目前,副产品主要用于动物饲料或直接被丢弃,是一种资源浪费和环境污染现象[4,5]。油莎豆碳水化合物含量丰富,陈星等[6]分析油莎豆成分,其中糖的质量分数为23.35%,Svitlana等[7]研究发现油莎豆块茎中碳水化合物只有蔗糖。
低聚果糖由于其双歧特性以及生物功能特性已被归类为益生元,是一种由酶促过程产生的低聚糖混合物[8,9]。低聚果糖按其结构可分为葡萄糖-果糖(GFn)型和果糖-果糖(Fn)型[10]。一般来说,Fn型FOSs主要是通过内切菊粉酶水解菊粉得到,而GFn型FOSs可以通过β-呋喃果糖苷酶或果糖基转移酶的转果糖基化反应,以蔗糖为底物得到[11]。果糖基转移酶催化果酰基向蔗糖分子或低聚果糖转移,果酰基链逐渐增长[12]。使用纯蔗糖作为底物来生产低聚果糖,对于牲畜饲料的应用,使用低成本的蔗糖源更为经济[11]。Khatun等[11]利用新型普鲁兰短梗霉从蔗糖和糖蜜中高效生产低聚果糖。Sheila等[13]从一种新的天然原料甜菊废渣中提取菊粉和低聚果糖。低聚果糖由于其较低甜度、低致癌性、低热量值、低血糖指数和促进双歧杆菌增殖的营养和健康相关特性,越来越多地被食品工业使用[14]。李瑶等[15]通过建立小鼠肥胖模型,并进行低聚果糖干预,结果显示低聚果糖可以一定程度上预防和控制肥胖。
超声波辅助提取技术基于其“空化效应”促进可溶性成分溶出[16],主要是通过提高现有过程的反应速度或引发新的反应[17]。膜分离技术是一种新型纯化技术,具备环境友好、分离效率高、成本低、操作简便等优点,是纯化多糖的理想选择[18,19]。
研究利用油莎豆粕中丰富的蔗糖为原料合成益生元低聚果糖,将油莎豆脱脂后副产物开发利用创新得到了高价值低聚糖,为油莎豆粕的开发利用提供了新思路。
1 材料与方法
1.1 材料与试剂
油莎豆粕、果糖基转移酶(5 000 U/mL)、BCA蛋白浓度测定试剂盒(增强型);其他常用试剂均为分析纯。
1.2 仪器与设备
高速多功能粉碎机,超声波破碎仪,SYWF-50水浴恒温振荡器,AvantiJ-E离心机,隔膜真空泵、微孔过滤膜(水系),Vivaflow 200即用型切向流膜包,BioTek Synergy HT多功能酶标仪,DF-101S集热式恒温加热磁力搅拌器,冷冻干燥机,S6000型高效液相色谱仪,ELSD-UM5800蒸发光散射检测器。
1.3 方法
1.3.1 水溶性糖制备工艺流程
将油莎豆粕粉碎,加入10倍质量冷水,超声,水浴恒温浸提得到油莎豆粕水溶性糖。
1.3.1.1 单因素实验
称取高速粉碎后的油莎豆粕粉末1 g,设定料液比1∶10,摇床速度100 r/min为固定条件,提取时间为1 h,提取温度为70 ℃,分别研究超声时间(0~30 min)对水溶性糖提取率的影响。设定超声时间为10 min,提取温度为70 ℃,分别研究提取时间(1~6 h)对水溶性糖提取率的影响。设定超声时间为10 min,提取时间为3 h,研究提取温度(40~90 ℃)对水溶性糖提取率的影响。
1.3.1.2 响应面实验
通过初步实验确定了提取率的最佳提取点范围,响应面实验设计用于评估3个因素的影响以及优化提取工艺参数,以水溶性糖提取率为响应值,以超声时间、提取时间、提取温度为3个单因素进行响应面优化设计,响应面设计因素与水平见表1,其中-1、0、1分别代表自变量的低、中、高3个水平。采用Design-Expert软件,应用Box-Behnken原理进行3因素3水平实验设计(共17 组),从而确定提取的最优条件。

表1 响应面设计因素与水平
1.3.2 水溶性糖提取率测定[20]
1.3.2.1 对照品溶液的制备
精密称取干燥至恒重的葡萄糖标准品2 mg,蒸馏水溶解,20 mL容量瓶定容,得100 μg/mL的葡萄糖标准溶液。
1.3.2.2 葡萄糖标准曲线的制备
蒸馏水作为空白对照,梯度吸取0、40、80、120、160、200 μL对照品溶液于2 mL离心管中,蒸馏水补至200 μL。依次加入200 μL质量分数5%苯酚溶液、700 μL浓硫酸后,迅速振荡摇匀,室温反应20 min后,分别吸取各梯度反应液200 μL加入96孔板中,每个浓度3个孔,采用酶标仪测定490 nm下吸光值,横坐标为葡萄糖浓度,纵坐标为OD490 nm值,得回归方程Y=0.006 2x+0.092 8,R2=0.998 8。葡萄糖标准曲线如图1所示。

图1 葡萄糖标准曲线
1.3.2.3 水溶性糖提取率
将水溶性糖提取液稀释到一定浓度,按照标准曲线步骤操作,根据公式计算水溶性糖提取率:

式中:C为水溶性糖质量浓度/μg/mL;V为提取液体积/mL;m为油莎豆粕粉质量/μg。
1.3.3 水溶性糖的纯化工艺
通过最优提取工艺得到油莎豆粕水溶性粗糖液,采用等电点沉淀法与膜分离技术相结合去除粗糖液中的蛋白质。
1.3.3.1 等电点沉淀法
滴加1 mol/L的盐酸将油莎豆粕粗糖液pH调整为4和5,常温放置4 h,12 000 r/min离心10 min,0.45 μm膜进行超滤,除去溶液中的絮状悬浮杂质,得到初步纯化后的水溶性糖。
1.3.3.2 等电点沉淀法-膜分离技术联用
滴加1 mol/L的盐酸将油莎豆粕粗糖液pH调整为4和5,常温放置4 h,12 000 r/min离心10 min,0.45 μm膜进行超滤后10 ku膜进行膜过滤,得到纯化后的水溶性糖。
1.3.4 蛋白含量测定
采用BCA法测定蛋白含量。
1.3.4.1 蛋白标准品的制备
蒸馏水溶解牛血清白蛋白,制备0.5 mg/mL蛋白标准品,储藏于-20 ℃。
1.3.4.2 蛋白浓度检测
梯度吸取不同体积的0.5 mg/mL蛋白标准品于96孔板中,蒸馏水补足到20 μL,使蛋白质量浓度为0~0.5 mg/mL,样品稀释至一定倍数取20 μL加入孔中,各孔再加入200 μL BCA工作液60 ℃放置30 min,在562 nm处检测吸光值,对应标准曲线线性回归方程和稀释倍数确定蛋白浓度。
1.3.5 蛋白脱除率、糖保留率计算公式
蛋白脱除率、糖保留率的计算参考了郭思维等[21]的方法:

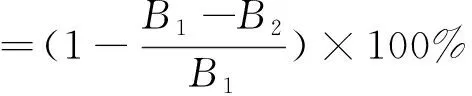
式中:A1为脱蛋白前蛋白吸光度;A2为脱蛋白后蛋白吸光度;B1为脱蛋白前糖吸光度;B2为脱蛋白后糖吸光度。
1.3.6 低聚果糖制备工艺
将除蛋白后的水溶性糖液进行旋转蒸发调整固形物质量分数为5%~7%后,添加不同比例的果糖基转移酶,在恒温水浴摇床中65 ℃,100 r/min 转化12 h,于85 ℃水浴条件下灭酶15 min,冷冻干燥即得低聚果糖粉末。
1.3.7 高效液相色谱检测
色谱柱:COSMOSIL Sugar-D(250 mm×4.6 mm,5 μm);流动相 ∶乙腈水=75 ∶25;流速:0.5 mL/min;柱温:35 ℃;蒸发光散射检测器漂移管温度:75 ℃,载气流速:2.5 mL/min。
1.3.8 低聚果糖含量计算公式
低聚果糖(FOS)含量=蔗果三糖(GF2)含量+蔗果四糖(GF3)含量+蔗果五糖(GF4)含量[22]。
1.4 数据统计分析
采取SPSS 19统计软件进行数据的处理与分析,采用Design-Expert 8.0.6软件进行响应面优化分析,使用Origin 9.0和GraphPad Prism 5软件作图。
2 结果与分析
2.1 单因素实验结果
提取因素对提取率的影响如图2所示,在超声处理时间延长至15 min的过程中提取率明显升高,超声波的同时作用促进了溶剂的水化破碎反应[23],可以较快地使油莎豆粕中的水溶性糖溶出,但是随着超声处理时间的继续加长,提取率提高趋于平缓,此时水溶性糖已经基本溶于水中,考虑到提高效率及节约能源,选取15 min为单因素实验最理想的超声时间。
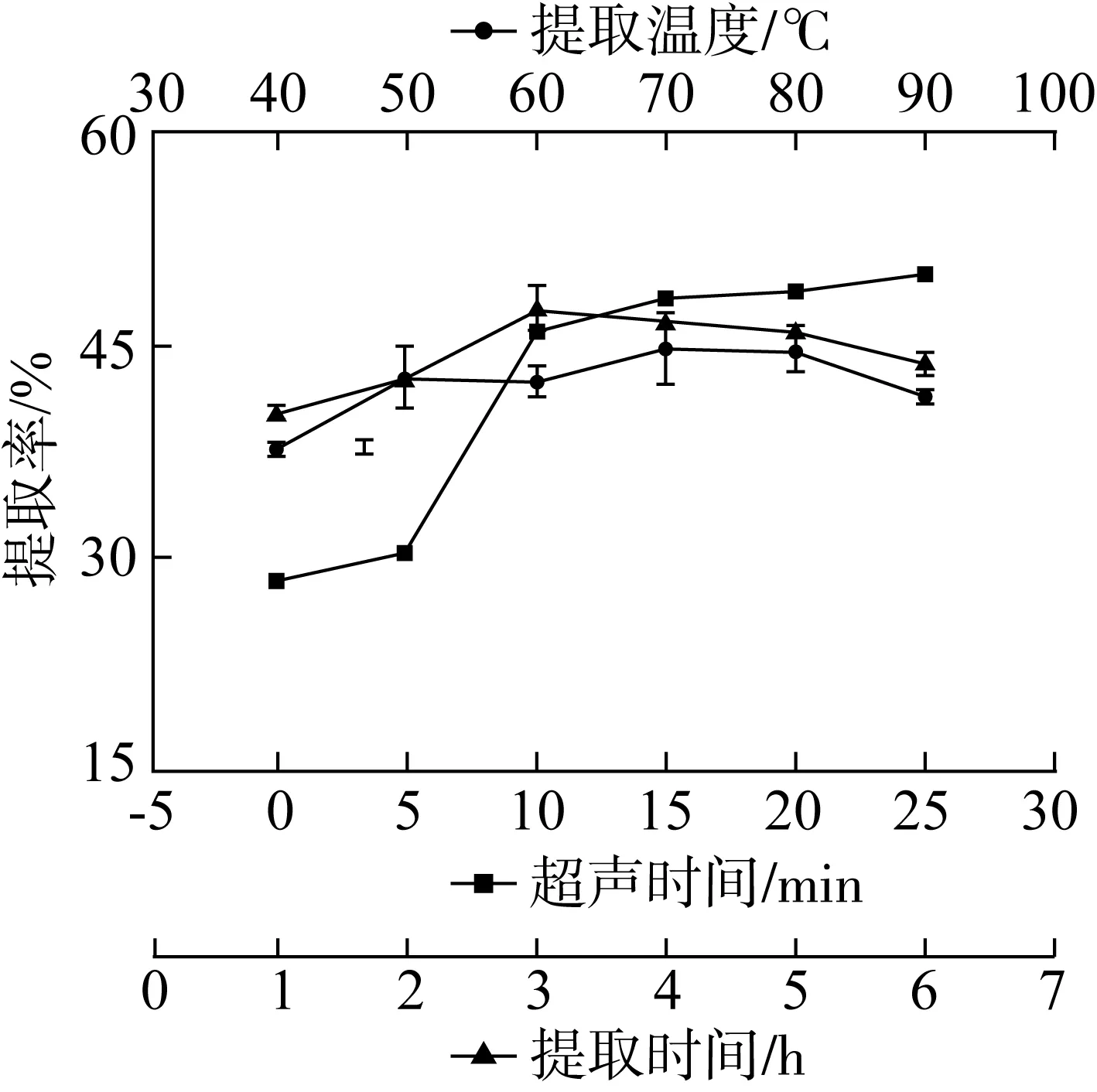
图2 提取因素对提取率的影响
从图2可以看出,随着提取时间的延长,提取率达到最大值后,提取时间超过3 h,提取率开始逐渐轻微下降。适当的提取时间会引起多糖的增溶作用,而过长的提取时间造成了水溶性糖的不稳定性[24]。因此选取3 h为单因素最理想的提取时间。
图2可见,当温度从40 ℃升高至70 ℃,提取率也明显升高,水溶性糖提取率到达峰值,当温度从70 ℃升高至90 ℃时,这一阶段在稳定的基础上略有下降。提取温度升高伴随着糖分子的剧烈运动,根据平衡浓度理论,升高温度可以加速糖的转移,因此升高提取温度有利于增加提取率[25,26]。但是,过高的温度也会导致一些只能在低温下才能活化的热敏多糖变性[26],还可能会导致多糖结构的破坏[24],因此,选择70 ℃为提取温度进行下一步实验。
2.2 响应面实验结果
2.2.1 响应面实验结果及方差分析
水溶性糖提取的响应面实验方差分析见表2。利用Design-Exepert 8.0.6软件,对响应值和各个因素进行二次多元回归拟合,得该模型对应的回归方程。建立的数学模型为:Y=-145.22+3.41A+39.01B+2.95C+0.22AB+0.02AC-0.21BC-0.18A2-4.39B2-0.02C2(R2=0.939 5)。
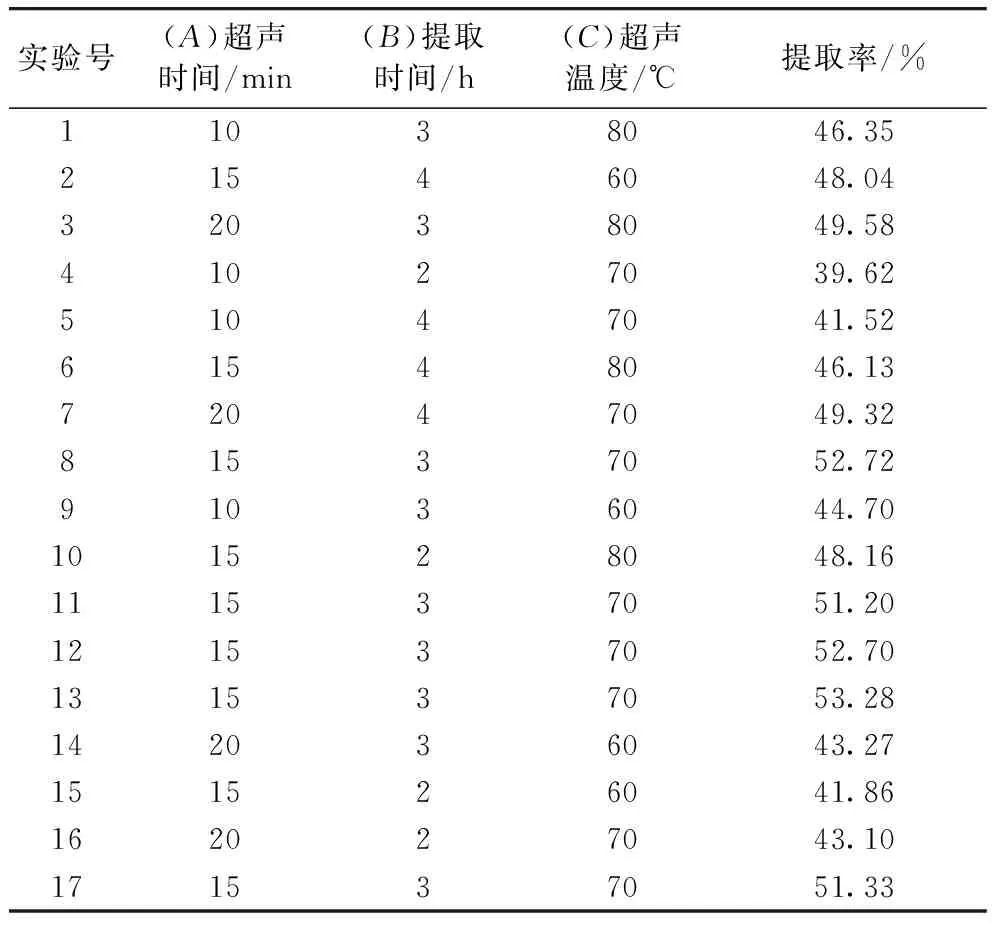
表2 水溶性糖提取的响应面试验方差分析
2.2.2 回归模型的方差分析

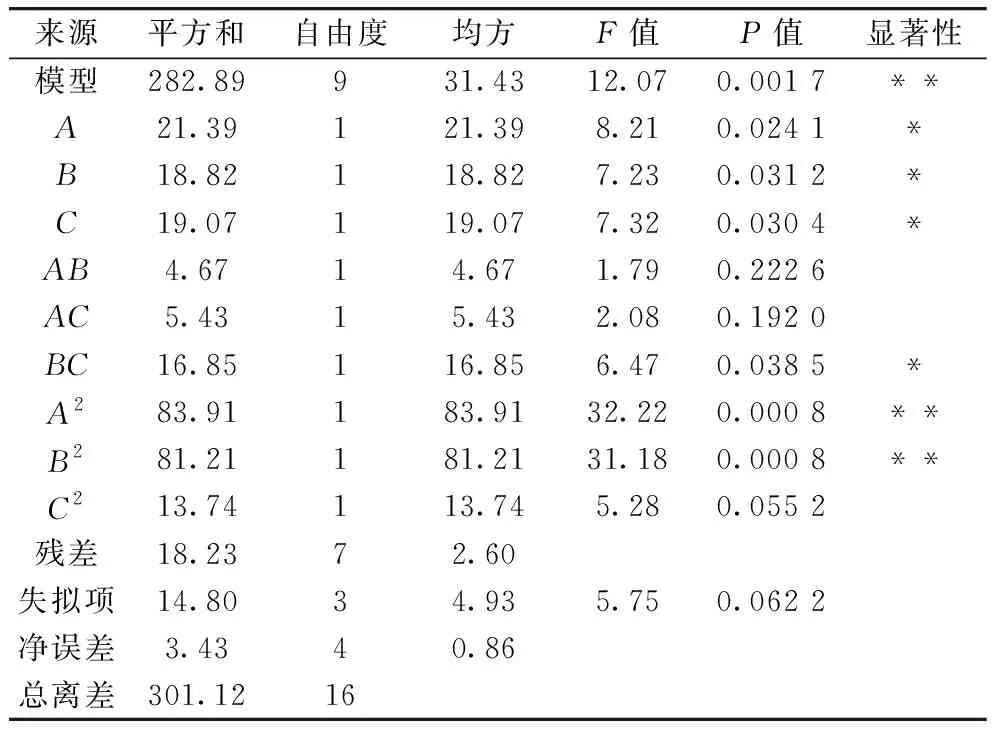
表3 回归模型方差分析
由表3可以看出,在一次项的预测中,3个单因素对水溶性糖提取率的影响(P<0.05)均达到显著水平;影响大小依次递减为超声时间、提取温度、提取时间。在二次项的预测中,超声时间和提取时间都达到了极显著水平(P<0.01),提取温度未达到显著水平。在交互项中,提取温度与提取时间的交互作用影响较显著,达到了显著水平(P<0.05),其他2组交互项均未达到显著水平。
2.2.3 模拟验证实验
Design-Expert 8.0.6软件对响应面实验结果进行分析,理想最优工艺参数:超声时间16.27 min、提取时间3.10 h、提取温度74.51 ℃,在此条件下,预测提取率为52.88%。考虑到实际操作、能耗及效率等因素,将理论最优条件调整为:超声时间为16 min、提取温度为75 ℃、提取时间为3 h。在调整后优化条件下进行3次平行实验,验证调整后的提取率,得到提取率为(52.61±0.51)%,差异不显著。
2.2.4 油莎豆粕水溶性糖的纯化工艺
不同方法除蛋白效果如图3所示,采用等电点沉淀法处理过后的水溶性糖液进行超滤后膜分离处理时效率更高。膜分离技术显著提高了蛋白质清除率,达到了更好的脱除蛋白效果。2种等电点沉淀法与膜分离技术联用的蛋白质清除率以及糖保留率差距不大,但是考虑后续实验中果糖基转移酶作用的最适pH为5。在保证实验效果的同时,出于精简实验步骤,提高实验效率,节约能源的综合考虑,油莎豆粕水溶性糖的纯化工艺采用实验组E法,在此基础上,继续后续实验。
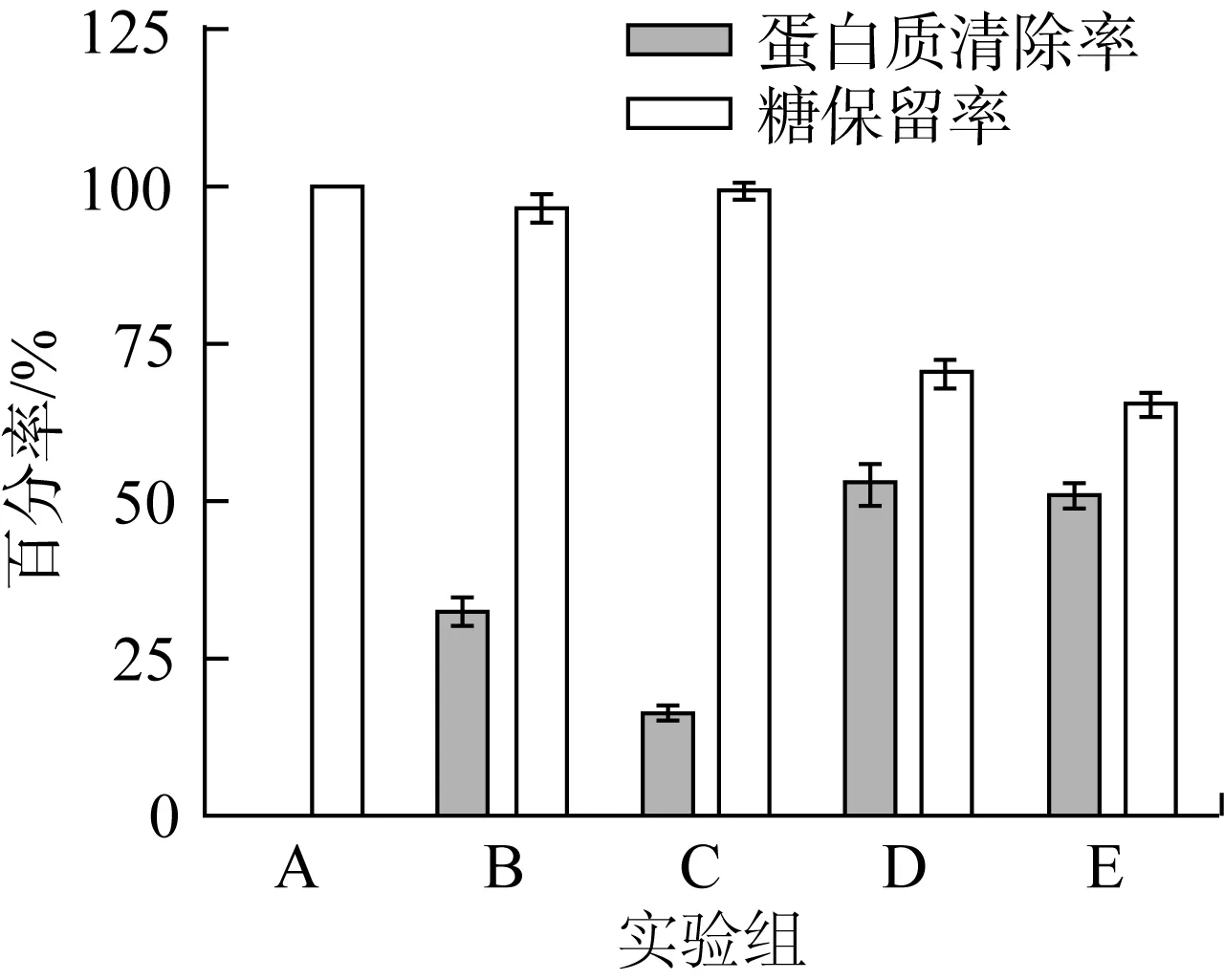
注:A为未处理组;B为等电点法pH=4;C为等电点法pH=5;D为等电点法pH=4-膜分离技术;E为等电点法pH=5-膜分离技术。图3 不同方法除蛋白效果
2.2.5 生物转化低聚果糖工艺优化
低聚果糖组分含量见表4。油莎豆粕水溶性糖中蔗糖质量分数高达97.80%,果糖与葡萄糖质量分数分别为0.64%以及1.40%,证明了油莎豆粕可以作为低成本的蔗糖源;随着果糖基转移酶添加比例的不断增大,蔗糖含量显著减少,果糖和葡萄糖持续增多,GF2和GF3含量呈现先升高后降低的趋势,GF4在酶比例为1∶100时才被检测到,FOS含量总体先升高后降低。当底物浓度远远高于酶的浓度时,酶的反应速度随酶浓度增加而增加,果糖基转移酶作用于蔗糖分子中的葡萄糖和果糖之间的β(2-1)糖苷键,使游离的果糖基连接到另一个蔗糖分子的果糖残基上形成GF2,并逐步形成GF3[27],但当底物与酶的活力中心结合饱和后,低聚果糖含量就不再增加,酶绝对过量时,GF2的一个果糖基会被转移到另一个GF2上生成蔗糖和GF3[28],说明当酶比例为1∶100时酶绝对过量。当酶比例为1∶1 000时,低聚果糖质量分数达到30.25%,主要为蔗果三糖与蔗果四糖,分别为27.53%和2.72%,此时转化率最高,FOS含量最高。

表4 低聚果糖组分质量分数/%
3 结论
以油莎豆粕为原料,浸提油莎豆粕中丰富的糖类,运用超声波辅助热水提取技术,建立了3种因素相互作用的响应面模型,得到了提取油莎豆粕水溶性糖的最优工艺;脱除蛋白进一步提高水溶性糖纯度,比较5种纯化工艺,确定了等电点沉淀法与膜分离技术联用脱除蛋白工艺,达到了有效脱除蛋白和保留糖含量的效果,为有效脱除蛋白提供了一条新思路;高效液相色谱检测发现,油莎豆粕中蔗糖含量丰富,可以作为低聚果糖生产低成本的蔗糖源,采用果糖基转移酶转化蔗糖为低聚果糖,合理有效地回收利用了农副产品资源,具有良好的工业应用前景。

