血清标志物联合检测对子痫前期的诊断价值*
孙秋瑾,杨现春,陆 逊,吴亚楠,王 敬
北京市朝阳区妇幼保健院检验科,北京 100021
子痫前期(PE)是以妊娠20周后出现以高血压和蛋白尿或其他脏器功能障碍为主要临床症状的一种妊娠期特有疾病,严重威胁孕产妇和胎儿健康,是导致孕产妇死亡和胎儿生长受限、死胎、早产的主要疾病之一。发展中国家PE发病率为1.8%~16.7%[1],我国人群PE发病率为4.2%[2]。高龄和有PE病史等为重要的危险因素。近年来,超重或肥胖也是造成PE发病率呈上升趋势的主要原因。有关PE发病机制的研究有多种理论,普遍认为是一种多因素、多机制、多通路致病的疾病。PE的病理生理可涉及母体、胎儿和胎盘因素。在妊娠早期胎盘血管发育异常可能导致胎盘相对灌注不足、缺血和缺氧,进而导致抗血管生成因子释放到母体血液循环中,从而改变母体内皮功能,导致高血压和其他疾病。本研究观察胎盘生长因子(PIGF)、可溶性fms样酪氨酸激酶-1(sFlt-1)、游离雌三醇(μE3)、甲胎蛋白(AFP)、β-人绒毛膜促性腺激素(β-HCG)、尿素氮(BUN)、肌酐(Cr)、尿酸(UA)、钙(Ca)、镁(Mg)、无机磷(P)在早、中、晚孕期PE患者与健康妊娠者中水平的差异,旨在寻找诊断效能较高的指标,现报道如下。
1 资料与方法
1.1一般资料 选取2020年9月至2021年12月本院38例早、中、晚孕期血清标本齐全的PE患者作为PE组,40例健康妊娠者作为对照组。PE组和对照组年龄比较,差异无统计学意义(P>0.05);PE组和对照组分娩孕周、孕期体质量指数(BMI)比较,差异均有统计学意义(P<0.05)。见表1。38例PE患者中有6例(15.8%)重度PE,其中包含2例(5.3%)HELLP综合征;有19例(50.0%)具有潜在的慢性病,包括甲状腺功能减退症或甲状腺功能亢进症4例(10.5%),妊娠期糖尿病13例(34.2%),前置胎盘2例(5.3%);有11例(28.9%)所怀胎儿具有潜在疾病,包括胎儿宫内窘迫7例(18.4%),生长受限4例(10.5%)。PE组纳入标准符合《妇产科学(第9版)》中PE的诊断标准。轻度PE:妊娠20周后出现收缩压≥140 mm Hg和(或)舒张压≥90 mm Hg,且伴有尿蛋白≥0.3 g/24 h,或尿蛋白/Cr≥0.3;无蛋白尿但伴有以下任何一种器官或系统受累(心、肺、肝、肾等,或血液系统、消化系统、神经系统异常改变,胎盘-胎儿受到累及等)中任意一项。重度PE:符合血压持续升高[收缩压≥160 mm Hg和(或)舒张压≥110 mm Hg]、持续性头痛、视觉障碍或其他中枢神经系统异常表现、持续性上腹部疼痛及肝包膜下血肿或肝破裂表现,丙氨酸氨基转移酶或天门冬氨酸氨基转移酶水平升高,肾功能受损[尿蛋白>2.0 g/24 h,少尿(24 h尿量<400 mL)或血Cr>106 μmol/L],低蛋白血症伴腹水、胸腔积液或心包积液,血小板计数<100×109/L,微血管内溶血(贫血、黄疸或乳酸脱氢酶水平升高),心功能衰竭,肺水肿,胎儿生长受限或羊水过少、胎盘早剥等任意一项即可诊断。对照组纳入标准:排除孕前基础疾病及孕期各种相关疾病的正常妊娠分娩女性,年龄小于35岁。排除收集标本血清量小于2.0 mL;溶血、脂血或乳糜血;早、中、晚孕期收集标本不全。所有研究对象均知情同意并签署知情同意书。本研究经本院医学伦理委员会审核批准。

表1 对照组和PE组一般资料比较[M(P25,P75)]
1.2仪器与试剂 使用罗氏全自动电化学发光免疫分析仪Roche 602 及其配套试剂检测PIGF、sFlt-1水平,试剂批号:50086201和54239201;使用贝克曼全自动化学发光免疫分析仪DXI 800及其配套试剂检测μE3、AFP、β-HCG水平,试剂批号:124539、124442和124444;使用日立7600-020全自动生化分析仪及日本和光WAKO试剂盒检测BUN、Cr、UA、Ca、Mg、P水平,试剂批号:DR394/DR395、DM419/DM420、DN140/KE009、EM383/EM384、DP889、EP880/EF883。
1.3检测方法 将收集的血清标本保存于-80 ℃冰箱中,集中检测前融化标本混匀后进行检测:PIGF、sFlt-1采用电化学发光免疫法检测;μE3、AFP、β-HCG采用化学发光免疫法检测;BUN采用尿素酶法检测;Cr采用肌酐酶法检测;UA采用尿酸酶法检测;Ca采用甲烷基二甲苯酚蓝法检测;Mg采用螯合剂法检测;P采用钼酸盐法检测。
1.4统计学处理 采用SPSS23.0统计软件进行数据分析处理。不符合正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验;计数资料以例数或百分率表示,组间比较采用χ2检验;采用受试者工作特征曲线(ROC曲线)评估各项指标单项及联合检测对PE的诊断效能。以P<0.05为差异有统计学意义。
2 结 果
2.1PE组和对照组6种血清标志物水平比较 PE组和对照组早孕期Cr、UA水平比较,差异均有统计学意义(P<0.05);PE组和对照组中孕期sFlt-1、μE3、Cr、UA水平比较,差异均有统计学意义(P<0.05);PE组和对照组晚孕期PIGF、sFlt-1、Cr、UA、Mg水平比较,差异均有统计学意义(P<0.05)。见表2。

表2 PE组和对照组各孕期血清PIGF、sFlt-1、μE3、Cr、UA、Mg水平比较[M(P25,P75)]
2.2早孕期Cr、UA对PE的诊断效能 ROC曲线分析结果显示,Cr、UA诊断PE的AUC分别为0.786、0.720;特异度分别为71.40%、92.86%;阳性预测值分别为77.80%、90.00%。见表3。

表3 早孕期Cr、UA对PE的诊断效能
2.3中孕期sFlt-1、Cr、UA对PE的诊断效能 ROC曲线分析结果显示,sFlt-1、Cr、UA诊断PE的AUC分别为0.718、0.720、0.714;UA诊断PE的灵敏度可达94.44%,阴性预测值可达85.71%。见表4。

表4 中孕期sFlt-1、Cr、UA对PE的诊断效能
2.4晚孕期PIGF、sFlt-1、Cr、UA、Mg对PE的诊断效能 ROC曲线分析结果显示,UA、sFlt-1、Cr、PIGF、Mg 5项血清标志物诊断PE的AUC分别为0.867、0.810、0.794、0.722、0.712。PIGF、sFlt-1、Cr、UA、Mg 5项指标联合检测诊断PE的灵敏度为83.33%,特异度为92.86%,AUC为0.917,阳性预测值为88.24%,阴性预测值为89.66%。见表5、图1。

图1 晚孕期PIGF、sFlt-1、Cr、UA、Mg诊断PE的ROC曲线

表5 晚孕期PIGF、sFlt-1、Cr、UA、Mg对PE的诊断效能
2.5sFlt-1、Cr、UA在各孕期相对危险度(RR)比较 sFlt-1、UA的RR随着孕期进展逐渐增高,尤其是UA,既有很好的早、中孕期诊断价值,又有很好的晚孕期诊断价值。见表6。
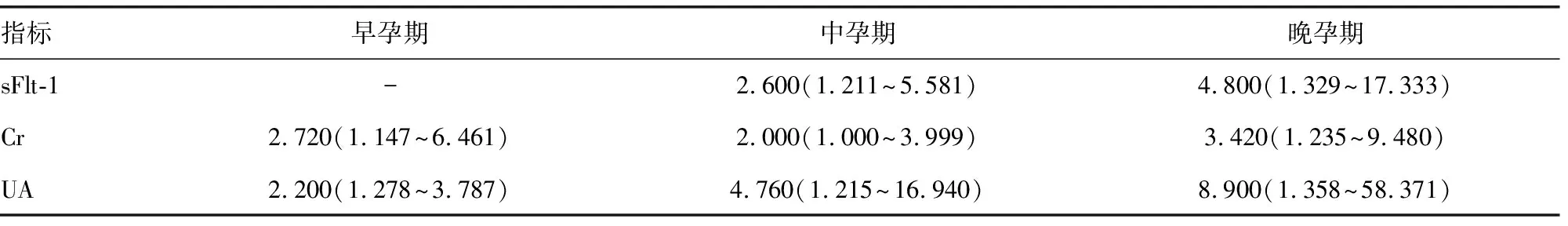
表6 sFlt-1、Cr、UA在各孕期诊断PE的RR(95%CI)
3 讨 论
PE是妊娠期高血压疾病之一,该类患者病情变化迅速,可出现全身多器官功能损伤,严重者可出现衰竭;PE还可诱发胎儿宫内窘迫、宫内生长受限、胎死宫内等严重围生期并发症[3],所有这些后果均严重危及母婴健康,是孕产妇和围生儿死亡的主要原因。因此,本研究探讨了发生PE的高危因素,寻找产前检查中的灵敏和特异性指标,对PE的预测、诊断和干预有重要临床价值和意义。
PE的发病机制目前仍在研究过程中,可涉及母体、胎儿和胎盘等,多种高危因素与PE的发生密切相关。庄彩霞等[2]对慢性高血压病史、既往PE病史、BMI、肾脏疾病等进行多因素Logistic回归分析,结果表明,中国人群中越来越普遍的超重或肥胖是发生PE的重要危险因素。本研究结果显示,PE组和对照组分娩孕周、孕期BMI比较,差异均有统计学意义(P<0.05),与刘丽丽等[4]的观点一致。本研究选取PIGF、sFlt-1、μE3、AFP、β-HCG、BUN、Cr、UA、Ca、Mg、P进行检测,以期寻找诊断效能较高的指标,这一全孕期研究尚少见相关文献报道。
PIGF为胎盘滋养细胞表达的一种多效细胞因子,可刺激血管内皮细胞生长、迁移及血管生成,能够维持胎盘血供及胎儿生长发育[5-6]。本研究结果显示,PE患者血清PIGF水平随着孕期递增逐渐升高,与HERRAIZ等[7]研究结论一致。PE组早、中、晚孕期PIGF水平均低于对照组,但只有晚孕期水平比较,差异有统计学意义(P<0.05)。sFlt-1作为可溶性酪氨酸激酶受体,是一种活性细胞因子,能与血管内皮生长因子和PIGF结合,并通过抑制其生物学活性导致血管内皮细胞损伤[8]。本研究结果显示,PE患者sFlt-1水平也是随着孕期递增逐渐升高,PE组中、晚孕期sFlt-1水平均高于对照组,差异均有统计学意义(P<0.05)。中孕期sFlt-1诊断PE的AUC为0.718,灵敏度和特异度分别为72.22%和78.57%。晚孕期诊断PE时,PIGF和sFlt-1均具有较高的诊断效能,AUC达0.722和0.810,尤其是sFlt-1,其阳性预测值和阴性预测值分别达80.00%和83.30%。因此,筛查PIGF和sFlt-1并进行干预,可降低PE发生率,并且有助于抑制病情发展,对改善患者预后具有积极意义[9]。
UA是人体内嘌呤,由细胞代谢分解的核酸和其他嘌呤类化合物,以及食物中的嘌呤代谢产生[10]。在嘌呤降解途径中,黄嘌呤氧化还原酶在生成UA的同时生成超氧自由基,参与氧化应激损伤。健康受试者服用可溶性尿酸后,体内活性氧(ROS)产生减少[11]。UA通过介导ROS产生,造成一氧化氮生成失衡、肾素-血管紧张素系统激活、胰岛素抵抗及脂肪堆积。高尿酸血症的动物模型可以逐渐发展出现高血压症状,并且氧化应激反应增加。有研究表明,UA水平升高与滋养细胞浸润能力下降及血管内皮细胞损伤相关[12]。早孕期升高的血清UA可抑制滋养细胞浸润和替代血管内皮细胞,造成子宫螺旋动脉重铸不足,导致胎盘缺血、缺氧,进一步由缺血、缺氧胎盘组织释放后随循环黏附于血管内皮细胞,参与氧化应激损伤,进而造成多器官功能障碍,以富集的肾脏和肝脏损伤较重。
PE组和对照组晚孕期Mg水平均低于早、中孕期,且PE组晚孕期Mg水平低于对照组,差异均有统计学意义(P<0.05),与马丽等[13]研究结论一致。PE患者Mg水平降低可能是由于饮食摄入减少、肾脏清除率增加、血液稀释及胎儿日益增加的矿物质消耗引起的[14]。近年来,在治疗先兆子痫中补充Mg已被证实可以抵抗Ca依赖性动脉收缩,并且可以拮抗细胞内Ca水平增加[15]。世界卫生组织提出,饮食中Ca和Mg摄入量低的孕妇患先兆子痫的风险较高,建议应及时补充。因此,PE高风险人群应定时监测血清Ca和Mg水平,及时补充对进行预防和干预十分必要。
综上所述,晚孕期联合检测UA、sFlt-1、Cr、PIGF、Mg,对PE具有良好的诊断价值;早孕期检测UA、Cr具有很好的预测价值,尤其是UA,诊断PE的特异度和阳性预测值均较高。

