酱香型白酒不同轮次发酵优势细菌与主要差异代谢产物关联分析
刘宏基,余有贵*,伍强,张旭,万勇,熊翔,杨志龙,谭文君
1(邵阳学院 食品与化学工程学院,湖南 邵阳,422000) 2(生态酿酒新技术与应用湖南省高校重点实验室,湖南 邵阳,422000)3(湖南湘窖酒业有限公司,湖南 邵阳,422000)
酱香型白酒是以高粱、小麦、水等为原料,经传统固态法发酵、蒸馏、贮存、勾兑而成的,未添加食用酒精及非白酒发酵产生的呈香呈味呈色物质,具有酱香风格的白酒[1]。酱香型白酒生产工艺独特,具有高温制曲、高温堆积、高温发酵、高温馏酒、生产周期长、贮存时间长、用曲量大、轮次多的“四高两长一大一多”工艺特点[2]。酱香型白酒发酵工艺包括堆积发酵和窖池发酵两部分。高温堆积发酵是一个好氧发酵过程,是大曲酱香白酒生产环节当中必不可少的一个关键工序,它既要满足糖化功能的形成,又要满足发酵力的生成,还要达到香味物质的形成条件,直接影响产品的质量与产量[3]。窖池发酵是封闭式无氧发酵,酱酒醅在窖池内发酵时的温度最高可达40~48 ℃[4],相比于浓香型白酒和清香型白酒的发酵温度要高出很多。窖池高温发酵是为酒精的生成和酱香物质的最后形成提供合适的发酵环境,发酵的作用是将糖转化成酒,并且使香气物质伴酒而生,形成大曲酱香酒特有的香味和风格。近年来,有关酱香酒发酵微生物与风味物质的报道很多,例如吴成等[5]对酱香型白酒四轮次堆积发酵进行风味物质与微生物群落的相关性分析发现,酵母菌主要与醇类物质呈正相关,细菌主要与酸类和酯类物质呈正相关;麻颖垚等[6]运用宏基因组学分析酱香型白酒窖内发酵优势菌与代谢功能的相关性发现发酵后与发酵前相比,醇、酸类物质含量明显增加,酯类物质种类丰富,判断窖内发酵阶段菌群的主要代谢功能为碳水化合物代谢和氨基酸代谢。
湖南邵阳四面环山,中间为丘陵盆地,森林覆盖率高,空气流动慢,资江自西南向东北流贯全境,雨热同季,独特的自然环境和气候条件造就了独特的微生物区系,在这个特定的环境下所酿造出的酱香型白酒口感特征明显,第三轮次酒醇甜,第五轮次酒带焦苦味。细菌产香,酵母产酒,探究湘产酱香型白酒不同轮次发酵优势细菌属与酵母代谢通路上具有风味特征的物质的相互关系,更能体现优势细菌属的功能所在,对揭示湘产酱香酒与贵州核心产区酱香酒相比口感有细微差异的原因更有帮助,具有明显的地方特色。
1 材料与方法
1.1 材料与试剂
1.1.1 酒醅样品
30个样品均采自湖南湘窖酒业有限公司酱酒车间二班组。堆积酒醅样品从堆积结束后取样,每个样品为平行堆子上、中、下层酒醅的混合样品,第三轮次5个样品分别记为DJ 3-1~DJ 3-5,归group 1;第四轮次5个样品分别记为DJ 4-1~DJ 4-5,归group 2;第五轮次5个样品分别记为DJ 5-1~DJ 5-5,归group 3。池内发酵酒醅样品从出窖后取样,每个样品为平行窖池上、中、下层酒醅的混合样品,第三轮次5个样品分别记为CJ 3-1~CJ 3-5,归group 4;第四轮次5个样品分别记为CJ 4-1~CJ 4-5,归group 5;第五轮次5个样品分别记为CJ 5-1~CJ 5-5,归group 6。将每个混合样品分成两份,-80 ℃保存,进行代谢组学分析和微生物组成分析。
1.1.2 试剂
水、甲醇、氯仿、甲氧胺盐酸盐吡啶、正己烷,德国CNW Technologies GmbH公司;辛酸甲酯(C8∶0)、壬酸甲酯(C9∶0)、癸酸甲酯(C10∶0)、十二烷酸甲酯/月桂酸甲酯(C12∶0)、十四烷酸甲酯/肉豆蔻酸甲酯(C14∶0)、十六烷酸甲酯/棕榈酸甲酯(C16∶0)、十八烷酸甲酯/硬脂酸甲酯(C18∶0)、二十烷酸甲酯/花生酸甲酯(C20∶0)、二十二烷酸甲酯/山俞酸甲酯(C22∶0)、二十四烷酸甲酯/木蜡酸甲酯(C24∶0)、二十六烷酸甲酯(C26∶0),瑞典Larodan生物公司;乙腈、L-2-氯苯丙氨酸,上海恒创生物;DNA抽提试剂盒、Qubit dsDNA检测试剂盒,德国凯杰生物公司;Agcourt AMPure XP纯化磁珠,美国Beckman生物公司。
1.2 仪器与设备
SB-5200DT超声波清洗机,宁波新芝生物科技有限公司;LNG-T98冷冻浓缩离心干燥器,太仓市华美生化仪器厂;TYXH-I漩涡振荡器,上海汗诺仪器有限公司;TGL-16MS高速冷冻离心机,上海卢湘仪仪器有限公司;THZ-82A气浴恒温振荡器,江苏环宇科学仪器厂;DZF-6021真空干燥箱,上海慧泰有限公司;7890B-5977A气相色谱-质谱联用仪、DB-5MS(30 m×0.25 mm×0.25 μm)色谱柱,美国安捷伦公司;NovaSeq 6000测序仪器,美国Illumina公司。
1.3 实验方法
1.3.1 代谢风味物质分析
前处理:称取60 mg样本,放入1.5 mL的离心管中;加入2颗小钢珠,加入600 μLV(甲醇)∶V(水)=1∶1(含2 μg/mLL-2-氯苯丙氨酸);在-40 ℃冰箱中预冷2 min后,放入研磨机中研磨(60 Hz,2 min);冰水浴超声提取30 min;加入150 μL的氯仿,涡旋仪中涡旋2 min;冰水浴超声提取30 min;-40 ℃静置30 min;低温离心10 min(13 000 r/min,4 ℃),取150 μL的上清液装入玻璃衍生小瓶中;用离心浓缩干燥器挥干样本;向玻璃衍生小瓶中加入80 μL的甲氧胺盐酸盐吡啶溶液(15 mg/mL),涡旋振荡2 min后,于37 ℃振荡培养箱中60 min,进行肟化反应;将样本取出后再加入50 μL的BSTFA衍生化试剂和20 μL的正己烷,加入10种内标(C8/C9/C10/C12/C14/C16/C18/C20/C22/C24,均为氯仿配制)10 μL,涡旋振荡2 min后,于70 ℃反应60 min;取出样本后,在室温放置30 min,进行GC-MS代谢组学分析。
色谱条件:DB-5MS毛细管柱,载气为高纯氦气(纯度≥99.999%),流速1.0 mL/min,进样口的温度为260 ℃。进样量1 μL,不分流进样,溶剂延迟6.2 min。柱温箱的初始温度为60 ℃,保持0.5 min;以8 ℃/min程序升温至125 ℃;8 ℃/min升温至210 ℃;15 ℃/min升温至270 ℃;20 ℃/min升温至305 ℃,保持5 min。质谱条件:电子轰击离子源(EI),离子源温度230 ℃,四极杆温度150 ℃,电子能量70 eV。扫描方式为全扫描模式(SCAN),质量扫描范围:m/z50~500。
1.3.2 微生物组成分析
采用DNA抽提试剂盒对样本的基因组DNA进行提取,利用琼脂糖凝胶电泳检测DNA的纯度和浓度。使用V3、V4前端引物343F(5′-TACGGRAGGCAGCAG-3′)和后端引物798R(5′-AGGGTATCTAATCCT-3′)扩增细菌的16S rRNA基因[7],使用真菌的前端引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和后端引物ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)扩增ITS区域[8]。PCR产物用Agcourt AMPure XP珠纯化,用Qubit dsDNA检测试剂盒定量,然后调整浓度进行测序。测序在Illumina NovaSeq 6000上进行,两个成对末端读取周期各250个碱基(Illumina公司,圣地亚哥,加州;OE生物科技公司;中国上海)。
原始数据为FASTQ格式。首先使用cutadapt软件,对raw data序列,剪切掉引物序列,然后使用DADA2,将上一步合格的双端raw data按照QIIME 2(2020.11)默认参数进行质量过滤,降噪,拼接及去嵌合体等质控分析[9-10],得到代表序列及扩增子序列变异(amplicon sequence variants,ASV)丰度表格。使用QIIME 2软件包挑选出各个ASV的代表序列后,并将所有代表序列与数据库进行比对注释,16S使用Silva(version138)数据库比对,ITS使用Unite数据库比对。物种比对注释使用q2-feature-classifier软件默认参数进行分析。
1.4 数据分析
根据属水平分类操作单元(operational taxonomic units,OTUs)的相对丰度计算微生物群落组成,采用pheatmap软件包进行相关性分析,并采用相关热图进行可视化,在属水平上显示代谢风味物质与微生物之间的关系。绘图利用R包实现。
2 结果与分析
2.1 微生物的群落结构组成
在属水平下,根据丰度排序Top15细菌属绘图如图1所示,堆积发酵的细菌属中,乳酸杆菌属(Lactobacillus)、克罗彭施泰特氏菌属(Kroppenstedtia)、鞘氨醇单胞菌属(Sphingomonas)、枝芽胞杆菌属(Virgibacillus)、罗尔斯通菌属(Ralstonia)、意大利小海员菌属(Nautella)和芽孢杆菌属(Bacillus)的相对丰度较高,与第四、五轮次相比,第三轮次堆积发酵酒醅中细菌区系差异更大,整体上不及第四、五轮次丰富,这与用曲量、酒醅酸度和环境温度有关,第三、四、五轮次投曲量是依次减少的,第三轮次酸度要低于第四、五轮次,第三轮次堆积发酵时环境温度也更低。第四、五轮次堆积酒醅细菌群系更丰富说明第四、五轮次堆积发酵更全面,细菌代谢物更丰富,为四、五轮次基酒风味更饱满、酒质更优创造了很好的前提条件。Lactobacillus在第四轮次堆积酒醅样品中相对丰度高达58%,有研究表明,Lactobacillus在贵州核心产区的堆积酒醅中和车间酿造环境中均比较丰富,作为有益菌群参与酱香酒的堆积发酵过程[10-11]。Kroppenstedtia在第四轮次堆积酒醅样品中占比最高,达39%,Kroppenstedtia属于嗜热菌属,在其他菌属无法正常生长的高温环境下,它依然可以保持较高的活性[12]。Virgibacillus在第三轮次堆积发酵酒醅中的相对丰度明显低于第四、五轮次,这与酒醅的酸度密切相关,Virgibacillus可利用麦芽糖、果糖、蔗糖、葡萄糖产酸,可为发酵产生物淀粉酶、蛋白酶。Bacillus能降解淀粉、蛋白质等大分子物质产生一些生物活性物质,它们是酱香酒风味物质的前体[13]。窖池发酵的细菌属中,Lactobacillus占比最大,是窖池发酵的绝对优势功能细菌属,Lactobacillus的生长代谢与发酵酒醅的温度密切相关,它的代谢消长可以直接影响整个细菌群落结构的演替[14]。极端严格好氧菌醋酸杆菌属(Acetobacter)能产生细菌纤维素,氧化葡萄糖和乙醇,转化成影响酱香酒风味的酯类物质[15],它在第三轮次~第五轮次发酵细菌属中的占比依次降低,在第五轮次堆积发酵酒醅样品中基本未检出,在出窖酒醅中相对丰度极低。WANG等[16]对北方酱香酒第五、六轮次酒醅发酵优势细菌研究发现,3个优势细菌属分别为Lactobacillus、大洋芽孢杆菌(Oceanobacillus)、Virgibacillus,与湖南地区优势细菌属基本相同,但由于气候环境的差异,各地优势菌群丰度有所不同。

图1 不同轮次发酵酒醅优势细菌属群落结构组成Fig.1 Dominant bacterial community structure of fermented grains collected from different fermentation cycle of soy sauce aroma style Baijiu
在属水平下,根据丰度排序Top15的真菌属组成如图2所示,在堆积发酵的真菌属中,红曲霉属(Monascus)、毕赤酵母属(Pichia)、丝依霉属(Byssochlamys)、酿酒酵母属(Saccharomyces)、假丝酵母属(Candida)、嗜热子囊菌属(Thermoascus)、拟青霉属(Paecilomyces)、近地伞属(Parasola)和嗜热丝孢菌属(Thermomyces)的相对丰度较高,其中Monascus的相对丰度最高达96%,在第四轮次堆积酒醅真菌属中占据绝对优势。Monascus具有较高的产淀粉酶和蛋白酶的能力,对于酱香酒风味物质的形成具有重要贡献[17],沈毅等[18]从四川郎酒的大曲、酒醅和窖泥中对比分析得知四川产区酱酒醅中Monascus的相对丰度也很高。Byssochlamys在第三轮次和第五轮次堆积酒醅中占比高,Byssochlamys能产生耐热的子囊孢子,在85 ℃以上的环境中都能存活,并且在低氧条件下也能保持较高的活力,它能产生果胶分解酶,有利于酒醅糖化[19]。窖池发酵的真菌属中,第三轮次Thermoascus占比最高,第四轮次Monascus占比最高,第五轮次Parasola占比最高。Thermoascus是一种耐热性较强的菌属,能长时间在45 ℃以上的高温环境中正常生长代谢,代谢产生耐热的纤维素酶和木聚糖酶[20]。有研究表明,Thermoascus为贵州核心产区酱香型大曲中的绝对优势真菌属[21],说明发酵酒醅中Thermoascus来源于高温大曲,其丰度表现与用曲量密切相关。从堆积发酵和窖池发酵一个完整的发酵轮次来看,第三、四、五轮次优势真菌属Saccharomyces的相对丰度表现很稳定,且每一轮次池内发酵Saccharomyces的丰度要高于同轮次堆积发酵。酿酒酵母是酱香型白酒酿造中最常见的产乙醇的真菌微生物,在发酵过程中它不仅可以产生大量的乙醇,还可以将原辅料中的氨基酸等物质转化成各种风味成分[22],对酱香酒的风味形成具有非常重要的作用。

图2 不同轮次发酵酒醅优势真菌属群落结构组成Fig.2 Dominant fungal community structure of fermented grains collected from different fermentation cycle of soy sauce aroma style Baijiu
2.2 差异代谢产物的筛选与鉴定
对30个发酵酒醅样品进行代谢组学鉴定,共鉴定出269个代谢物,按照发酵轮次进行分组共筛选出74个 差异代谢物,见附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.035367)。包括有机氧化合物24个,羧酸及衍生物8个,脂肪酰基类化合物7个,核苷酸类4个,甘油酯类2个,内酯类2个,有机氮化合物 2个,呋喃类1个,黄酮类1个,其他类23个。将主要差异代谢产物映射到KEGG数据库检索出7条显著的代谢通路[23],均与酿酒酵母相关,选择显著性富集pathway进行气泡图绘制,如图3所示。7条显著性代谢通路分别为ABC转运蛋白代谢、β-丙氨酸代谢、磷酸戊糖途径代谢、淀粉和蔗糖代谢、半乳糖代谢、戊糖和葡萄糖醛酸酯相互转化和丙酮酸代谢。
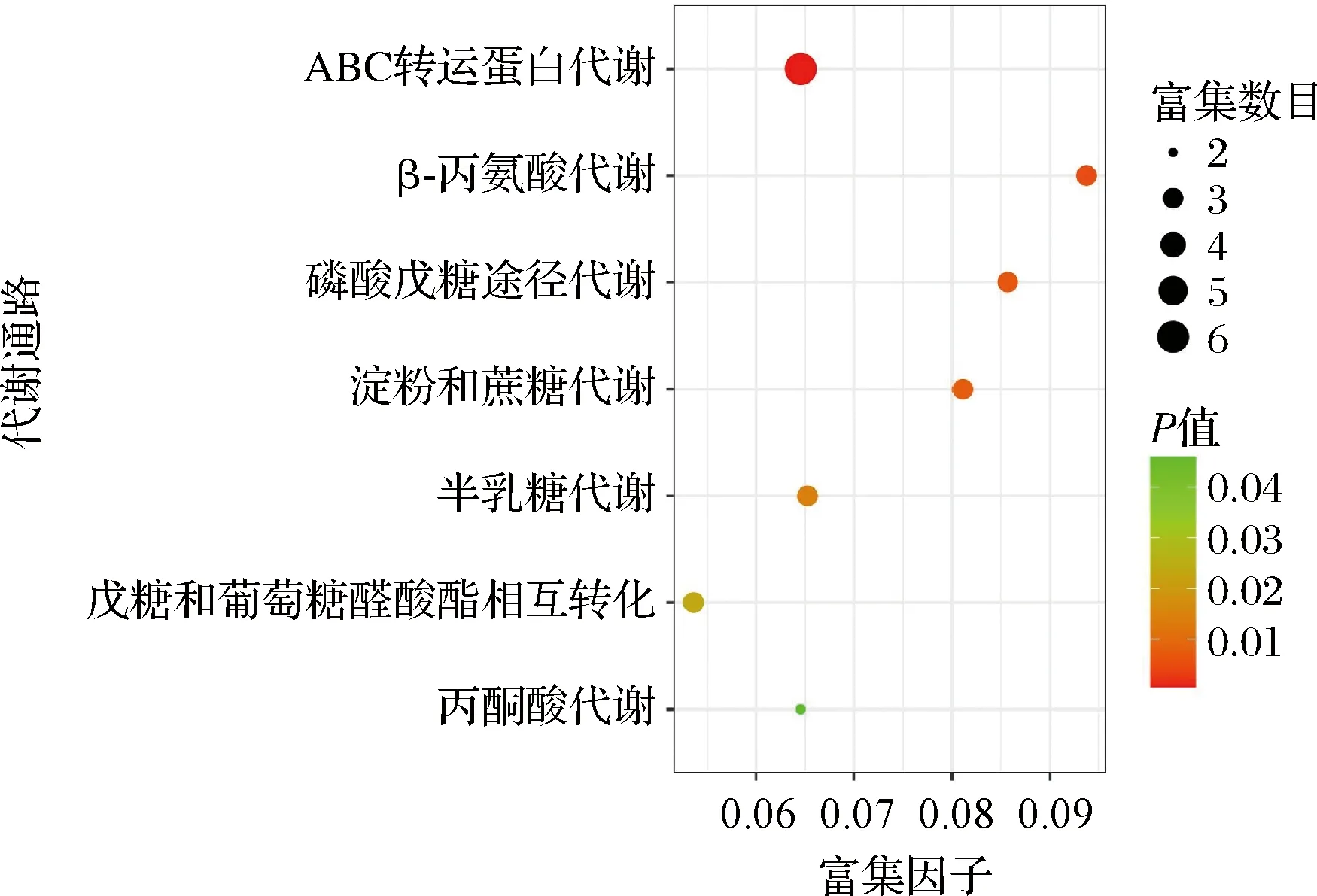
图3 代谢通路富集气泡图Fig.3 Enrichment bubble plot of metabolic pathway
附表1显示,所有差异代谢物中葡萄糖的相对表达量最高,第三轮次堆积发酵为4.250±0.465,窖池发酵为2.475±0.135,第四轮次堆积发酵为2.541±0.074,窖池发酵为1.073±0.201,第五轮次堆积发酵为2.520±0.441,窖池发酵为0.358±0.031,整体上表达量第三轮次高于第四、五轮次,葡萄糖与发酵前期霉菌及其所产酶对淀粉的糖化密切相关,它为活细胞提供营养,是糖酵解糖异生和蛋白质代谢的重要基础,是酱香酒发酵中最主要的糖,在发酵过程中被酵母充分利用产生酒精。L-谷氨酰胺是β-丙氨酸代谢的前体,在第三轮次堆积发酵酒醅样品中的相对表达量为1.744±0.049,第四轮次堆积发酵为0.390±0.751,第五轮次堆积发酵为0.018±0.001,呈明显依次下降的趋势,窖池发酵同样是第三轮次的相对表达量最高,表明在第三轮次发酵过程中葡萄糖和谷氨酰胺的代谢较为旺盛。D-甘露糖在第三轮次堆积发酵酒醅中的相对表达量为1.954±0.476,高于第四、五轮次,在第三轮次窖池发酵酒醅中的相对表达量为0.534±0.110,同样高于第四、五轮次。D-甘露糖是一种低热量的单糖,甜度分别是蔗糖和葡萄糖的60%和86%[24],它是酿酒酵母细胞壁的主要组成成分。D-甘露糖是合成甘露糖醇的前体,通过果糖和甘露糖代谢途径转化成D-甘露糖醇,D-甘露糖醇呈甜味,水溶液中甜味阈值达40.0 mmol/L,具有凉爽感[25],D-甘露糖醇可能是让第三轮次酒具有醇甜且尾爽净特点的重要风味物质之一。D-木酮糖是阿拉伯糖醇的前体物质,参与磷酸戊糖途径以及戊糖和葡萄糖醛酸酯相互转化,阿拉伯糖醇呈甜味,水溶液中甜味阈值达43.1 mmol/L[25]。D-木酮糖在第三轮次窖池发酵酒醅中的相对表达量为0.330±0.015,高于第四轮次和第五轮次,堆积发酵酒醅相对表达量同样也是第三轮次最高,D-木酮糖可能是让第三轮次酒具有醇甜口感的重要前体物质。海藻糖是酵母进行ABC转运蛋白代谢、淀粉与蔗糖代谢的产物,海藻糖稳定性强,能维持生物大分子的结构和功能,是评价酵母乙醇耐受性的重要指标[26]。海藻糖呈甜味,在第三轮次堆积发酵酒醅中的相对表达量为0.894±0.125,高于第四轮次和第五轮次,海藻糖可能是让第三轮次酒具有醇甜口感的重要前体物质。异麦芽糖在第三轮次堆积发酵酒醅中的相对表达量为1.563±0.144,窖池发酵酒醅中的相对表达量为0.558±0.056,整体上第四轮次和第五轮次与之相比要低很多,表明第三轮次发酵过程中淀粉酶分解淀粉以及葡萄糖焦糖化反应旺盛。亚麻酸呈焦苦味,带涩,水溶液中苦味阈值为0.6~1.2 mmol/L[25],参与酿酒酵母α-亚麻酸代谢过程。亚麻酸在第五轮次堆积发酵酒醅中的相对表达量为0.206±0.008,窖池发酵酒醅中的相对表达量为0.171±0.004,明显高于第三轮次和第四轮次,亚麻酸可能是造成第五轮次酒具有焦苦口感的重要风味物质。
2.3 优势细菌属与主要差异代谢物的关联分析
微生物的代谢产物种类含量的不同是造成第三、四、五轮次酒具有细微口感差别的关键原因,优势细菌与差异代谢物的关联更是体现其功能所在。基于相关性分析计算细菌和代谢物数据间的关联性,选取P<0.05的关系对绘制成网络图[27-28],见图4。黄色线代表正相关,蓝色线代表负相关,线的粗细代表相关性系数的高低。
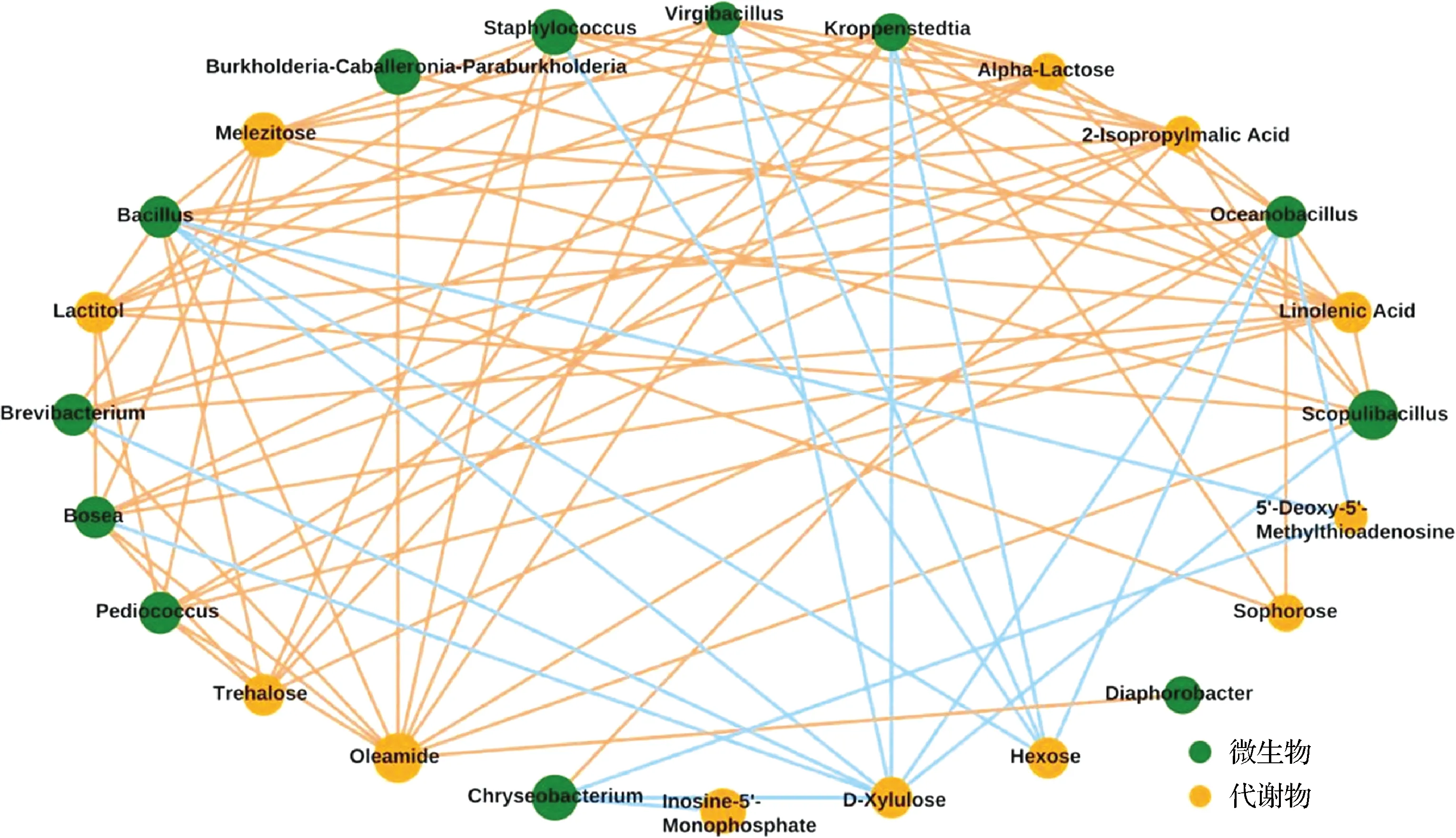
图4 优势细菌属与差异代谢物相关性网络图Fig.4 Network diagram of correlation between dominant bacterial genera and differential metabolites
差异代谢物与优势细菌的相关性分析表明,Kroppenstedtia与海藻糖和油酸酰胺呈正相关,与D-木酮糖和己糖呈负相关;Virgibacillus与海藻糖和油酸酰胺呈正相关,与D-木酮糖和己糖呈负相关;Oceanobacillus与松三糖、乳糖醇、海藻糖和油酸酰胺呈正相关,与D-木酮糖和己糖呈负相关;Bacillus与海藻糖和油酸酰胺呈正相关,与D-木酮糖和己糖呈负相关;Staphylococcus与海藻糖和油酸酰胺呈正相关,己糖呈负相关。Kroppenstedtia、Virgibacillus、Oceanobacillus、Bacillus和Staphylococcus均与海藻糖和油酸酰胺呈正相关,表明这5个细菌属对酿酒酵母进行ABC转运蛋白代谢和淀粉与蔗糖代谢起到了很好的协同作用,对脂肪酸的生物合成起到了很好的促进作用。Kroppenstedtia、Virgibacillus、Oceanobacillus、Bacillus和Staphylococcus均与D-木酮糖呈负相关,表明这5个细菌属共同参与了磷酸戊糖途径以及戊糖和葡萄糖醛酸酯相互转化,参与了阿拉伯糖醇的调控,对缩小不同轮次酱香型白酒醇甜口感差异具有重要作用。
3 结论与讨论
基于微生物多样性检测探究了不同轮次发酵酒醅中细菌和真菌的群落结构特征,基于GC-MS非靶向代谢组学分析了酱香酒不同轮次发酵酒醅代谢产物的差异,与微生物的联合分析表明,8个优势细菌属中有5个优势细菌属对酿酒酵母的关键代谢具有协同作用,这为人工改善酱香酒发酵微生态提供了理论支撑。另外,海藻糖、D-木酮糖、D-甘露糖等对第三轮次酒醇甜口感的影响、亚麻酸对第五轮次酒焦苦口感的影响还需进一步验证,这是研究酱香型白酒黄金轮次酒口感细微差异亟需解决的问题,对定向调控发酵酒醅特征代谢物的合成进程,提升酱香型白酒品质具有重要意义。

