脱糖预处理对荔枝渣果粉分散特性及营养品质的影响
王宇婷,安可婧,徐玉娟*,彭健,余元善,吴继军,肖更生
1(仲恺农业工程学院 轻工食品学院,广东 广州,510225)2(广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东 广州,510610)
荔枝(Litchichinensis)属于无患子科荔枝属常绿乔木[1],是我国最具特色的热带、亚热带水果之一,含有丰富的营养和独特的风味,深受消费者的喜爱。荔枝采收季节集中,其特殊的生理特征使得果实采摘后极易发生变色变质,严重影响了新鲜荔枝的销路,据统计每年荔枝因此而造成的损失率高达25%~30%[2]。因此,利用现代食品加工技术将相对过剩的荔枝进行深加工、实现资源充分利用是保障荔枝产业健康发展,提高荔枝附加值的重要途径。
目前荔枝的加工产品形式主要包括荔枝酒、荔枝醋、荔枝饮料等,在这些产品加工过程中会产生大量皮、核、渣等下脚料,占鲜果重量的40%~50%。这些副产物因含有较高的糖分、果胶等营养物质,极易被微生物利用而发生变质,造成环境的污染[3]。荔枝果渣具有荔枝特有的香气成分,富含膳食纤维、酚类和多糖等营养成分,但目前果渣主要被用于饲料行业,缺乏高附加值产品。荔枝果粉可作为食品基料用于面包、蛋糕、饮料、冰淇淋等食品中,因应用广泛、营养丰富、风味宜人而具有良好的经济价值和广阔的市场前景。梁世强[4]在传统米粉中加入了荔枝果粉,改善了米粉的风味,提高了米粉的营养价值;熊雄[5]使用荔枝果粉作为膳食补充物添加到面包中,提高面包营养价值,为功能性面包开发提供依据。
荔枝渣加工中存在的主要问题是由于荔枝渣中含有大量的果糖、葡萄糖、蔗糖,由果渣制成的果粉流动性差、容易结块,因此在粉剂加工前需要进行脱糖处理。目前常用的脱糖方法有醇沉法、酶法、水洗法和发酵法,醇沉法通常需要借助热水浸提和超声辅助提取,所需时间长,过程繁琐;酶法脱糖效率高,但成本较高;水洗法操作简单,成本较低;发酵法脱糖效率较高,品质保留好。刘金亮[6]通过对面粉进行二次水洗处理,有效分离了面粉中的淀粉多糖,大大提高了面粉的综合利用率;郭小宇等[7]采用酿酒酵母L610生产乙醇,发现该酵母对菊芋总糖的利用率最高可达86%。目前关于荔枝渣脱糖的内容尚未有研究报道,基于此,本研究选择水洗法和发酵法对荔枝果渣进行脱糖效果的比较,以及研究脱糖处理对荔枝果粉分散特性和营养品质的影响,旨在为工业化的脱糖处理技术提供理论依据。
1 材料与方法
1.1 材料与试剂
荔枝渣,广州顺昌源绿色食品有限公司。为淮枝去皮去核后果肉榨汁产生的果渣,储存于-20 ℃备用。
酿酒酵母RV002,安琪酵母股份有限公司;DPPH、Trolox、没食子酸、葡萄糖、Folin-Ciocalteu,上海源叶生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
WF-A2000榨汁机,美的有限公司;BJ-200高速多功能粉碎机,德清拜杰电器有限公司;ALC-210.4电子分析天平,德国ACCULAB公司;PB-10 pH计,赛多利斯公司;HWS24电热恒温水浴锅,上海一恒科学仪器有限公司;JW-1042低速离心机,安徽嘉文仪器装备有限公司;SU8000超高分辨场发射扫描电子显微镜,日立高新技术公司;UV1800紫外分光光度计,日本岛津公司;ST85B3-1真空冷冻干燥机,美国Milirock公司;XDW-6B低温粉碎机,济南达微机械有限公司。
1.3 实验方法
1.3.1 实验流程
(1)未脱糖处理:淮枝去皮去核后果肉榨汁产生的果渣。
(2)发酵脱糖处理:参考李依娜等[8]的方法。酵母粉于50 mL 37 ℃水中活化12 h;荔枝渣与水1∶1混合后,接入样品量0.02%(质量分数)的酵母粉,30 ℃下发酵24 h后过滤。
(2)水洗脱糖处理:参考刘金亮[6]的方法。称取一定量的荔枝果渣,加入2倍体积的蒸馏水,于室温下进行打浆处理,滤去蒸馏水,重复2次洗涤。
(3)冷冻干燥:将未处理、发酵和水洗后的荔枝渣置于-20 ℃冰箱中预冻,然后放入真空冷冻干燥机,冷阱温度为-0 ℃,真空度13 Pa,加热温度20 ℃,干燥至水分含量为5%。
(4)粗粉:冻干后的荔枝渣采用高速多功能粉碎机,在转数和功率分别为28 000 r/min和1 200 W条件下打粉30 s。
(5)超微粉碎:用粗粉进行超微粉碎处理,在转数和功率为910 r/min、3 500 W条件下进行不同时间的超微粉碎。
1.3.2 指标测定方法
1.3.2.1 总糖含量及脱糖率
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定总糖[9]。取0.1 g粗粉和超微粉于50 mL烧杯中加入2.5 mL(6 mol/L)的盐酸溶液,再加入25 mL蒸馏水摇匀,于70 ℃的水浴中加热20 min后加入2.5 mL(6 mol/L)的氢氧化钠溶液,并用蒸馏水定容至50 mL,取其中1 mL水解液与2 mL DNS溶液反应,沸水浴中加热显色反应3 min,于540 nm下测定吸光值。脱糖率计算如公式(1)所示:

(1)
式中:按干基计算,A,未去糖果渣中总糖含量,mg/g;B,去糖后果渣中总糖含量,mg/g。
1.3.2.2 休止角测定
休止角指在重力场中,粉料堆积体的自由表面处于平衡的极限状态时自由表面与水平面之间的角度。本文采用注入法测定,参考任亚梅等[10]的方法有所改动。将漏斗置于绘图纸上方一定距离,把物料颗粒加入到漏斗中,使物料颗粒从漏斗下口自由流出,纸与填充物出口的距离H为0.9 cm,直到粉末形成的圆锥尖端接触到填料的出口,测量每种粉末的锥形直径(2R)。休止角计算如公式(2)所示:

(2)
式中:H,漏斗尾端距平板的距离,cm;R,圆锥体半径,cm。
1.3.2.3 滑角测定
滑角指自然堆放在光滑平板上的粉料,随平板做倾斜运动时,粉料开始滑动时的平板倾斜角。滑角的测定常用倾斜法,参考任亚梅等[10]的方法。取3 g微粉置于玻璃平板上,然后将玻璃平板倾斜至约90%微粉移动,玻璃平板与水平面之间形成一夹角,该角即为微粉的滑角。滑角计算如公式(3)所示:
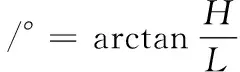
(3)
式中:H,平板的垂直距离,cm;L,平板所对应的水平距离,cm。
1.3.2.4 堆积密度测定
堆积密度是把粉尘或者粉料自由填充于某一容器中,在填充完成后所测得的单位体积质量。将粉料自然填满10 mL量筒,然后称量10 mL体积中的样品质量[11]。堆积密度计算如公式(4)所示:
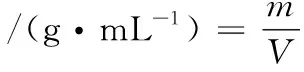
(4)
式中:m,样品的质量,g;V,样品的体积,mL。
1.3.2.5 样品的提取
准确称取5 g荔枝果粉置于25 mL离心管中,加入15 mL 80%(体积分数)甲醇溶液,超声波提取30 min 后进行离心(8 000 r/min,10 min),取上清液,再重复上述操作3次,合并上清液,最后用80%甲醇溶液定容至50 mL,-20 ℃条件下贮存, 备用。
1.3.2.6 总酚测定
采用Folin-Ciocalteu法[12]测定总酚含量。取适当稀释的样品1 mL,加入2 mL福林酚试剂,振荡摇匀(避光),加入2 mL 50 g/L碳酸钠溶液,避光反应1 h,于760 nm下测定吸光值。按干基计算,总酚含量以没食子酸当量表示,得到线性回归方程为y=0.021 8x+0.073 5(R2=0.994 7)。
1.3.2.7 抗氧化活性测定
(1)DPPH自由基清除率测定
参考GURSOY等[13]的方法。样品组:1 mL适当稀释后的样品加入5 mL DPPH溶液;空白组:1 mL水加入5 mL DPPH溶液;调零组:1 mL样品稀释液加入5 mL乙醇溶液,避光反应10 min,于517 nm下测吸光值。按干基计算,以Trolox为标准品,测定不同质量浓度下的清除率,得到线性回归方程为y=1.74x+1.432 2(R2=0.999 9)。
(2)ABTS阳离子自由基清除率测定
参考李斌等[14]的方法。取适当稀释后的样品0.1 mL,加入3.6 mL ABTS溶液,漩涡振荡30 s,室温下避光反应30 min,于734 nm波长下测吸光值。按干基计算,以Trolox为标准品,得到清除率的线性回归方程为y=-0.001 3x+0.576 1(R2=0.998 4)。
1.3.2.8 电镜扫描电子显微镜(scanning electron microscope,SEM)
将样品粉末黏在碳导电胶布上,放入离子溅射仪在15 mA下喷铂金35 s,喷好后放入电镜样品仓。抽真空后打开电压,加速电压为1.5 kV,观察样品形貌。
1.4 数据处理
数据采用Excel 2015进行处理分析,所有指标重复测定3次,实验结果表示为平均值±标准差,采用SPSS软件进行显著性分析,采用Origin 2018进行绘图。
2 结果与分析
2.1 总糖含量变化
如表1所示,未处理的荔枝渣总糖含量为155.61 mg/g,发酵预处理和水洗预处理后荔枝果粉总糖含量变为24.77~27.63 mg/g d.b和44.03~49.13 mg/g,糖分脱除率分别为81.89%~84.60%和68.3%~71.59%。说明发酵预处理和水洗预处理均能有效降低总糖含量,发酵预处理脱糖效果更显著。这是因为荔枝渣中的糖主要是蔗糖、果糖和葡萄糖,而酵母菌对果糖、葡萄糖、蔗糖的利用能力非常强, 几乎可以把这些糖全部代谢为二氧化碳和乙醇[15],此外,经前期研究发现,RV002酿酒酵母中的纤维素酶,利用不可溶性膳食纤维将其转化为葡萄糖后,再代谢为二氧化碳和乙醇;而水洗预处理则使可溶性糖溶解于水中,通过溶解过滤将荔枝渣中的可溶性糖脱除,只能脱除可溶性糖,很难将糖分完全脱除,并且需要消耗大量的水,所以从脱糖效率和成本角度考量,发酵脱糖预处理优于水洗脱糖预处理。此外,随着超微粉碎时间的延长,荔枝果粉总糖含量也逐渐增加,发酵预处理脱糖率由84.60%降低至81.89%;水洗预处理脱糖率由71.59%降低至68.3%(图1)。这是由于超微粉碎破坏了荔枝渣细胞结构,促进细胞内活性物质释放,故总糖含量增加[16]。

表1 不同预处理对荔枝果粉的总糖含量的影响Table 1 Effects of different pretreatments on the total sugar content of litchi fruit powder

图1 不同预处理对荔枝果粉脱糖率的影响Fig.1 Effect of different pretreatments on the desugar rate of litchi fruit powder注:不同小写字母表示显著性差异(P<0.05)(下同)
2.2 不同预处理对荔枝果粉休止角、滑角、堆积密度的影响
目前常用休止角和滑角表示粉体的流动性能,休止角和滑角越小,摩擦力越小,粉体流动性越好[17]。如表2所示,未处理的荔枝粗粉休止角和滑角分别为62.26°和38.29°,发酵预处理的荔枝粗粉休止角和滑角分别为55.01°和34.51°,水洗预处理的荔枝粗粉的休止角和滑角分别为57.66°和36.66°,说明发酵预处理比水洗预处理的荔枝粗粉的流动性好,这是因为未处理及水洗预处理的荔枝果粉粉体含糖量较高,会出现团聚现象,因此流动性变差。随着超微粉碎时间的延长,未脱糖处理的果粉及2种预处理粉剂的休止角与滑角都逐渐增大,未处理处理的荔枝果粉休止角由62.26°增大到68.01°,滑角由38.29°增大到52.54°;发酵预处理的荔枝果粉休止角由55.01°增大到62.77°,滑角由34.51°增大到45.64°;水洗预处理的荔枝果粉休止角由57.66°增大到63.61°,滑角由36.66°增大到49.83°。这是因为随着超微粉碎时间的延长,果渣细胞内部的糖分逐渐释放,粉体表面聚合力和黏着力相应增大,致使流动性变差。
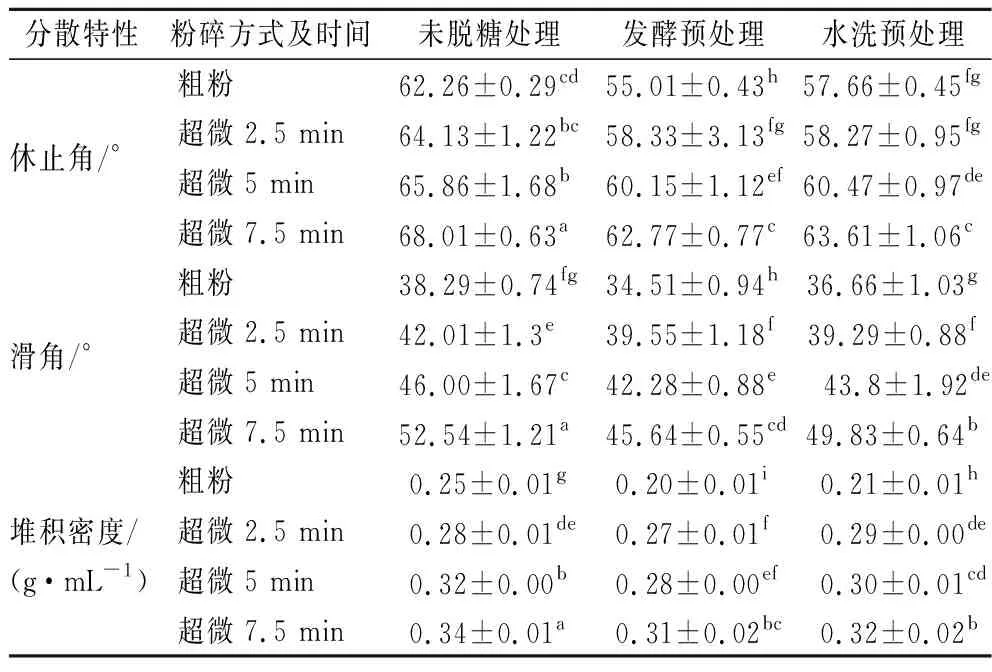
表2 不同预处理对荔枝果粉的分散特性的影响Table 2 Effect of different pretreatments on the dispersion characteristics of litchi fruit powder
堆积密度又称填充密度,堆积密度越高,粉体疏松性越差[18]。未处理的荔枝果粉堆积密度为0.25~0.34 g/mL,发酵预处理的荔枝果粉堆积密度为0.20~0.31 g/mL,水洗预处理的荔枝果粉堆积密度为0.21~0.32 g/mL,相同超微粉碎条件下,水洗脱糖预处理的荔枝果粉堆积密度高于发酵脱糖预处理,这是因为发酵预处理后粉体含糖量低,所得粉体质地疏松,颗粒间隙较大,所以堆积密度较小;水洗预处理含糖量较高、粉体颗粒有粘黏结块现象,所以堆积密度较高。此外,随着超微粉碎时间的延长,堆积密度增大,这是因为超微粉碎使粉体颗粒变小,空隙减小,堆积密度增大,并且随着含糖量增加,黏性增加,粉体的堆积密度进一步升高。
2.3 不同预处理对荔枝果粉总酚含量的影响
如图2所示,未处理的荔枝渣总酚含量为19.82 mg/g,经发酵和水洗预处理后荔枝果粉总酚含量分别为20.70、17.95 mg/g,说明发酵预处理的荔枝果粉总酚含量显著高于水洗预处理荔枝果粉,这可能是因为荔枝中含有苯丙氨酸解氨酶(L-phenylalanine ammonia-lyase,PAL),PAL与一些重要的次生物质如木质素、黄酮类物质的合成有关,为多种酚类及类黄酮终产物提供前体,酵母通过诱导PAL活性升高,促进酚类物质的生成[19];另一方面,酵母菌代谢产生的蛋白酶、纤维素酶和果胶酶可从不溶性基质中释放结合酚类化合物,并将其水解为游离形式,增加发酵产物中多酚含量[20];其次,在水洗脱糖处理的过程中,会造成营养物质流失,使总酚含量降低。因此,发酵预处理的荔枝果粉总酚含量高于水洗预处理的。此外,随着超微粉碎时间的延长,总酚含量逐渐增加,未经脱糖处理的荔枝果粉总酚含量由19.82 mg/g增加到23.81 mg/g,发酵预处理的荔枝果粉总酚含量由20.70 mg/g增加到25.59 mg/g,水洗预处理的荔枝果粉总酚含量由17.95 mg/g增加到19.04 mg/g,这是因为原料经超微粉碎后,细胞壁破碎,超微粉碎使大量酚类物质从细胞内释放出来,并且有一些结合酚在超微粉碎过程中转变为游离酚,更容易被检测[21]。

图2 不同预处理对荔枝果粉总酚含量的影响Fig.2 Effect of different pretreatment on the total phenolic content of litchi fruit powder
2.4 不同预处理对荔枝果粉抗氧化活性的影响
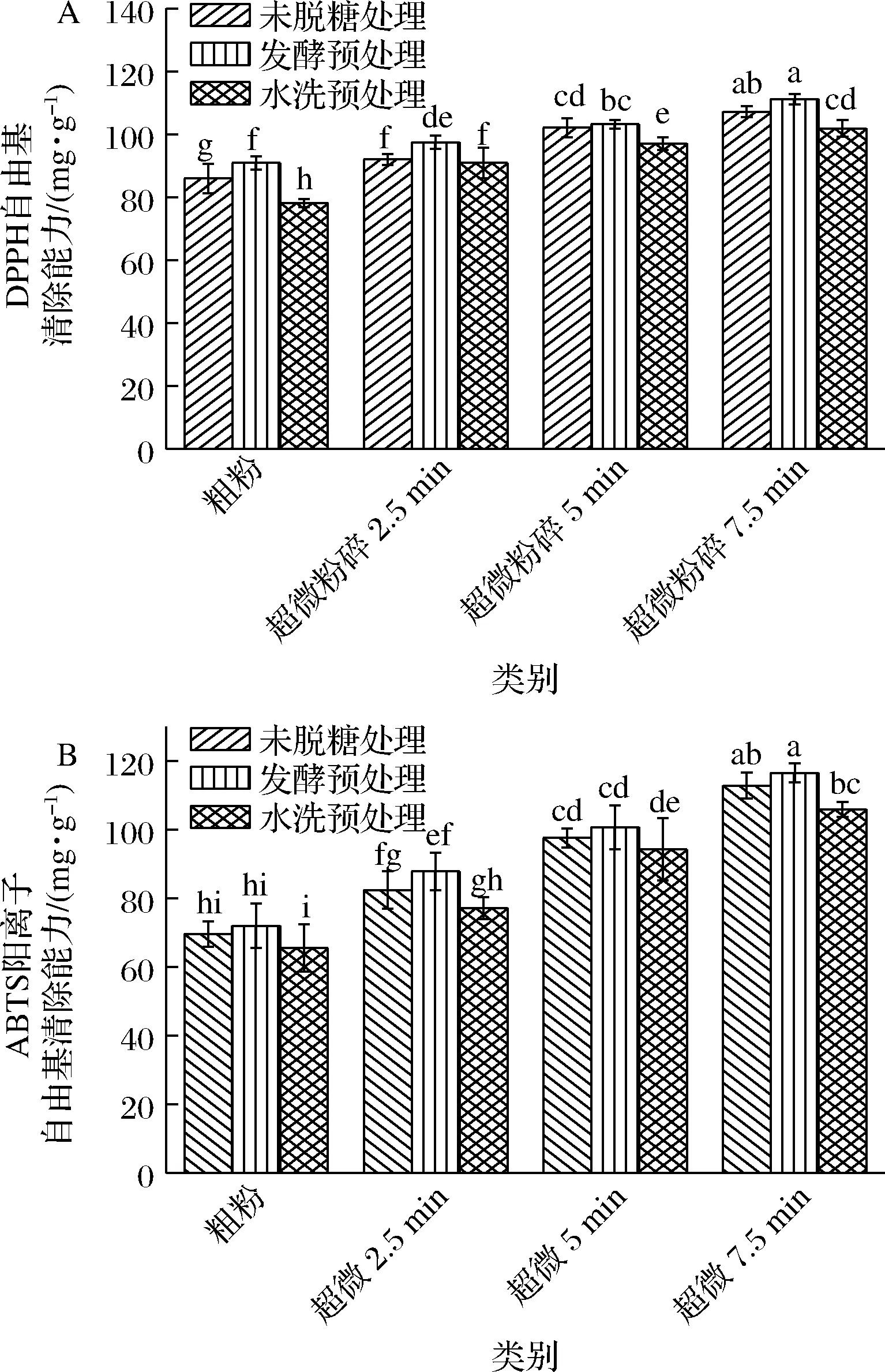
在本研究中采用DPPH和ABTS两种方法对荔枝果粉抗氧化能力做出评价。由图3可知,根据Trolox当量,发酵预处理的清除DPPH自由基的能力及清除ABTS阳离子自由基能力最强,其值分别为78.12 mg/g及72.03 mg/g。很多文献证实了酚类物质含量与抗氧化呈正相关性[22-23],因此,发酵脱糖处理使荔枝渣抗氧化活性提高的原因是由于微生物转化促进促进酚类物质的生成,以及微生物使结合酚转化为游离酚,增加了可被检测的酚类物质。
A-DPPH自由基清除能力;B-ABTS阳离子自由基消除能力图3 不同预处理对荔枝果粉抗氧化能力的影响Fig.3 Effect of different pretreatments on the antioxidant capacity of litchi fruit powder
此外,随着微粉化程度的增加,荔枝渣自由基清除能力与总酚含量变化趋势一致,未脱糖处理的清除DPPH自由基的能力由85.96 mg/g增至107.14 mg/g,发酵预处理清除DPPH自由基的能力由90.90 mg/g增加至111.17 mg/g,水洗预处理清除DPPH自由基的能力由78.12 mg/g增加至101.90 mg/g;未脱糖处理清除ABTS阳离子自由基能力由69.60 mg/g增加至112.83 mg/g;发酵预处理清除ABTS阳离子自由基能力由72.03 mg/g增加至116.49 mg/g;水洗预处理清除ABTS阳离子自由基能力由65.55 mg/g增加至108.92 mg/g,是因为随着荔枝微粉的粒径减小,多酚等抗氧化物质与提取溶剂的接触面积增大,粉体的抗氧化活性增高,其次超微粉碎处理使荔枝渣中的抗氧化活性成分更易于溶出,自由基清除率逐渐增加[24]。
2.5 不同预处理对荔枝果粉微观结构的影响
不同脱糖预处理的荔枝粗粉与超微粉的扫描电镜形态如图4所示,荔枝粗粉中,未处理的果粉大小不均、有粘黏现象;发酵预处理的果粉表面平整光滑,无明显褶皱收缩;水洗预处理的果粉表面有明显褶皱收缩,粉体表面凹凸不平,有许多孔隙。随着超微粉碎时间的延长,未处理的荔枝果粉,表面富集微小粉体,果粉之间黏附现象愈加明显;发酵预处理的荔枝果粉粉体逐渐变小,大小均匀;水洗预处理的荔枝果粉,随着超微粉碎时间的延长,颗粒大小不均一,粒径较小的颗粒间交互面积增加,说明粉体有团簇聚集结块的现象[25]。果粉的微观结构显示,发酵脱糖预处理的果粉颗粒大小更均匀、分散性更好,无明显结块现象,优于水洗脱糖预处理。

a-1为未处理粗粉;a-2为未处理超微2.5 min微粉;a-3为未处理超微5 min微粉;a-4未处理超微7.5 min微粉;b-1为发酵预处理粗粉;b-2为发酵预处理超微2.5 min微粉;b-3为发酵预处理超微5 min微粉;b-4为发酵预处理超微7.5 min微粉;c-1为水洗预处理粗粉;c-2为水洗预处理超微2.5 min微粉;c-3为水洗预处理超微5 min微粉;c-4水洗预处理超微7.5 min微粉图4 不同预处理荔枝粗粉与微粉的扫描电镜形态(1 000×)Fig.4 SEM morphology of different pretreatment litchi coarse and powder (1 000×)
3 结论与讨论
与未处理的荔枝粉相比,2种预处理方式均能显著降低荔枝果粉总糖含量,发酵预处理脱糖效率比水洗预处理更高。与未处理及水洗预处理的果粉相比,经过发酵预处理的荔枝果粉的堆积密度、滑角及休止角降低,说明发酵后的荔枝果粉具有更好的流动性,并且随着超微粉碎时间的延长,水洗预处理果粉出现团聚现象,流动性变差。在粉体营养品质方面,发酵预处理的荔枝果粉的总酚含量、抗氧化能力显著高于水洗处理的荔枝果粉。电镜结果显示发酵预处理的荔枝果粉表面光滑,水洗预处理的荔枝果粉表面有明显褶皱收缩,随着超微粉碎时间的延长,发酵处理的荔枝果粉的大小均匀,而水洗预处理的荔枝果粉有明显粘黏现象产生。综上,从脱糖效率、粉体分散性及营养品质方面考虑,发酵脱糖处理显著优于水洗脱糖处理,本研究可为工业化采用微生物转化脱糖技术的应用提供理论依据。

