基于RNA-Seq技术分析大肠埃希菌诱导阴道上皮细胞炎症反应分子机制
王冬纳?何淑明
【摘要】目的 研究大腸埃希菌感染诱导阴道上皮细胞炎症反应的分子机制。方法 制备大肠埃希菌刺激阴道上皮细胞炎症反应模型,采用RNA测序(RNA-Seq)获取对照组和大肠埃希菌刺激组间的差异表达基因谱,进而使用生物信息学分析差异表达基因的富集信号通路,实时荧光定量PCR(RT-qPCR)验证测序结果。结果 在对照组和大肠埃希菌刺激组间共发现4 899个差异表达基因,其中上调和下调基因分别为1 531和 3 368个。基因本体论(GO)分析显示,其功能富集在生物学行为控制模块的血小板衍生生长因子结合和辅助因子结合、细胞组成模块的内质网伴侣复合物,以及分子功能模块的内质网折叠蛋白方面。京都基因与基因组百科全书(KEGG)分析显示这些基因富集于39条信号通路,如核因子-κB(NF-κB)通路。RT-qPCR结果与RNA-Seq结果一致,证实大肠埃希菌刺激组细胞TNF-α表达上调(P < 0.05)。结论 TNF-α调控NF-κB信号通路可能是大肠埃希菌诱导阴道上皮细胞炎症反应关键分子机制。
【关键词】RNA测序;大肠埃希菌;需氧菌性阴道炎;炎症反应
Molecular mechanism of Escherichia coli-induced inflammatory response in vaginal epithelial cells using RNA-Seq analysisWang Dongna△, He Shuming. △The Second School of Clinical Medicine, Southern Medical University, Guangzhou 510280, China
Corresponding author, He Shuming, E-mail: 756497548@qq.com
【Abstract】Objective To investigate the molecular mechanism of inflammatory response in vaginal epithelial cells induced by Escherichia coli infection. Methods An inflammatory response model in vaginal epithelial cells stimulated by Escherichia coli was established. Then, differentially-expressed gene profiles between the control and Escherichia coli stimulation groups were obtained by RNA sequencing (RNA-Seq). The enrichment signaling pathways of differentially-expressed genes were identified by bioinformatic analysis. The sequencing results were validated by quantitative fluorescent real-time PCR (RT-qPCR). Results A total of 4899 differentially-expressed genes were found between the control and the Escherichia coli stimulation groups, including 1531 up-regulated genes and 3368 down-regulated genes. Gene Ontology (GO) showed that the functions of differentially-expressed genes were dominantly enriched in platelet-derived growth factor binding and co-receptor binding in the biological process term, endoplasmic reticulum chaperone complex in the cellular component term and protein folding in endoplasmic reticulum in the molecular functional term, respectively. Kyoto Encyclopedia of Genes and Genomes (KEGG) showed that these differentially-expressed genes were enriched in 39 signaling pathways, such as the NF-κB signaling pathway. The upregulation of differentially-expressed gene TNF-α was validated by RT-qPCR (P < 0.05), which was consistent with the RNA-Seq results. Conclusion TNF-α regulating the NF-κB signaling pathway is a critical molecular mechanism of Escherichia coli-induced inflammatory response in vaginal epithelial cells.
【Key words】RNA sequencing; Escherichia coli; Aerobic vaginitis; Inflammatory response
需氧菌性阴道炎与胎儿感染、性交困难和早产有关,是育龄妇女最常见的生殖道感染之一。目前,临床上对于需氧菌性阴道炎治疗主要采取抗菌治疗、益生菌以及局部雌激素治疗等,尚未达成最佳治疗方案共识,其发病分子机制及干预靶点有待进一步研究[1]。需氧菌性阴道炎的发生与阴道菌群失调有关。阴道失去以乳酸菌为主的菌群生态,出现异常阴道菌群,其中以大肠埃希菌最为常见,占比7.5%;其他菌群次之,如金黄色葡萄球菌占4.5%[2-3]。宋伶俐等[4]研究也表明,需氧菌性阴道炎中以大肠埃希菌为最多见的需氧菌。需氧菌性阴道炎表现为明显的阴道炎症和阴道上皮破坏。异常需氧菌明显增加与阴道炎症密切相关。研究表明,需氧菌性阴道炎患者阴道IL-1β和IL-10升高[5]。人阴道上皮细胞在大肠埃希菌刺激下,VK2/E6E7的Toll样受体2(TLR2)、TLR4和核因子-κB(NF-κB)表达上调,表明需氧菌性阴道炎常见致病菌可刺激阴道上皮细胞释放炎症因子[6]。然而,需氧菌性阴道炎的炎症反应分子机制尚未完全阐明。本研究采用RNA测序(RNA-Seq)技术,研究大肠埃希菌刺激阴道上皮细胞炎症反应的差异表达基因谱,并采用生物信息学手段分析差异表达基因功能和参与调控信号通路,为治疗需氧性阴道炎的非抗菌性措施提供潜在干预靶点。
材料与方法
一、细胞培养及处理
人阴道上皮细胞VK2/E6E7细胞由广州辉园苑医药科技有限公司提供。采用添加胎牛血清(FBS,Gibco公司,美国)和双抗(青霉素和链霉素,100 U/mL,天津市灏洋生物制品科技有限责任公司,中国)的Keratinocyte-sFM(Thermo Fisher公司,美国)在5% CO2培养箱中培养传代。取对数生长期细胞在细胞培养皿培养过夜后,随机分为对照组(Con组)和大肠埃希菌感染组(E. coli I组)。
E. coli I组加入大肠埃希菌(北京北纳创联生物技术研究院,中国)与细胞共孵育24 h,同时Con组加入等量生理盐水。大肠埃希菌的感染复数为100。
二、实时荧光定量PCR(RT-qPCR)检测
细胞处理结束后,采用高纯度总RNA快速提取试剂盒(BIOTEKE,中国)提取总RNA和HiScript Ⅱ Q RT SuperMix for qPCR试剂盒(Vazyme,中国)
进行RT-qPCR检测。然后采用HieffTM qPCRSYBR? Green Master Mix试剂盒[翊圣生物科技(上海)股份有限公司,中国]准备20 μL反应体系:ddH2O 7.4 ?L,
SYBR反应预混液10 ?L,模板DNA 1 ?L和引物
1.6 ?L。qPCR在荧光定量PCR仪(杭州博日科技有限公司,中国)上进行,反应参数为:预变性94 ℃,
1 min;40个循环(变性94 ℃ 15 s,退火60 ℃ 20 s,延伸72 ℃ 20 s)。引物序列为:IL-1β(产物长度为118 bp),正向5′-CCTATGTCTTGCCCGTGGAG-3′,反向5′-CACACACTAGCAGGTCGTCA-3′;IL-6(产物长度为
175 bp),正向5′-TGGAAATGAGAAAAGAGTTGTGC-3′, 反向5′-CGGAACTCCAGAAGACCAGA-3′;TNF-α(产物长度为144 bp),正向5′-CTGAACTTCGGGGTGATCGG-3′,反向5′-GTTTGCTACGACGTGGGCTA-3′;ACTB(产物长度为171 bp),正向5′-AAGATCAAGATCATTGCTCCTCCT-3′,反向5′-AGCTCAGTAACAGTCCGCCT-3′。
三、RNA-Seq
RNA-Seq由广州辉园苑医药科技有限公司完成。基本流程如下:采用RNeasy Mini Kit(QIAGEN,中国)提取对照组和大肠埃希菌感染组细胞的总RNA。在确定RNA总量和完整性符合标准后,采用磁珠富集mRNA并对mRNA片段化。然后采用VAHTS mRNA-Seq V3 Library Prep Kit for Illumina(Vazyme,中国)构建转录组文库。经过纯化和PCR扩增后,在Illunima Novaseq 6000 高通量測序仪进行PE150测序,下机得到样本的Fastq格式的碱基序列。
四、生物信息学分析
完成上述RNA-Seq后,将所获取的原始测序数据采用Fsatp软件过滤。过滤处理后,采用FastQC(v0.11.5)去除低质量和拼头序列,获得清洁reads,采用bowtir2软件(v2.2.9)去除残留核糖体RNA(rRNA)和转运RNA(tRNA)序列;过滤后的reads采用HIASAT2软件(2.2.1)比对该物种的参考基因组,定位每条reads的位置;采用StringTie软件(v2.1.5)对每个reads所在基因位置计数并将所有样本结果合并。使用DESeq2软件(1.30.1)进行组件差异分析,获取差异表达基因谱,并对差异表达基因进行基因本体论(GO)和京都基因与基因组百科全书(KEGG)信号通路富集分析。
五、统计学处理
使用SPSS 22.0分析研究数据。经Shapiro-Wilk正态性检验,定量资料均符合正态分布,以表示,组间比较采用t检验,P < 0.05为差异有统计学意义。
结果
一、大肠埃希菌刺激引导阴道上皮细胞炎症反应
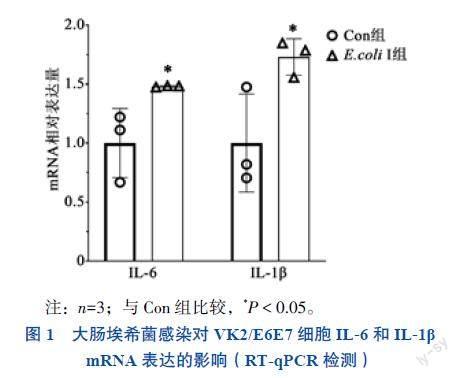
大肠埃希菌刺激24 h后,Con组和E. coli I组VK2/E6E7细胞中炎症因子(IL-6和IL-1β)mRNA相对表达量比较差异均有统计学意义(P均< 0.05),提示大肠埃希菌诱导了阴道上皮细胞炎症反应。见图1。
二、测序质量评价
样品经高通量测序后,Con组样本1和样本2得到读序(reads总数分别为5.713×107条和5.451×107条),采用Fsatp软件过滤后,得到高质量的干净reads分别为5.675×107条和5.41×107条。E. coli I组样本1和样本2得到reads总数分别为5.342×107条和5.607×107条,过滤后分别得到5.308×107条和5.574×107条。所有样品过滤后碱基总数占过滤前碱基总数的百分比均在98%以上。所有样品过滤前和过滤后的质量值20(Q20)和质量值30(Q30)均大于90%。将过滤后reads进行核糖体和基因组比对。去除rRNA和tRNA的reads数后得到最终reads,所有样品的最终reads占干净reads百分比均大于99%,而基因组比对匹配reads的百分比均在97%以上。以上结果表明本研究获取了高质量测序数据,为后续RNA-Seq分析提供保障。
三、差异表达基因分析
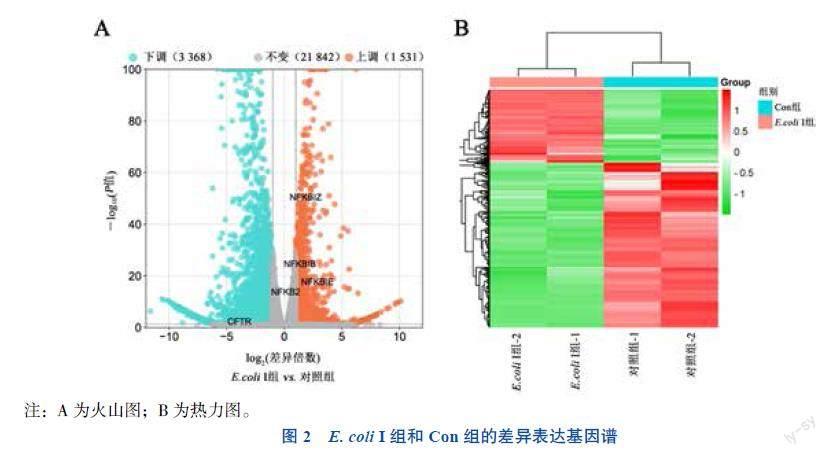
Con组和E. coli I组间共有4 899个差异表达基因。其中,上调基因1 531个(包括NF-κB信号通路相关基因),下调基因3 368个(包括囊性纤维化调节因子CFTR)。差异表达基因的火山图和热力图见图2A、B。
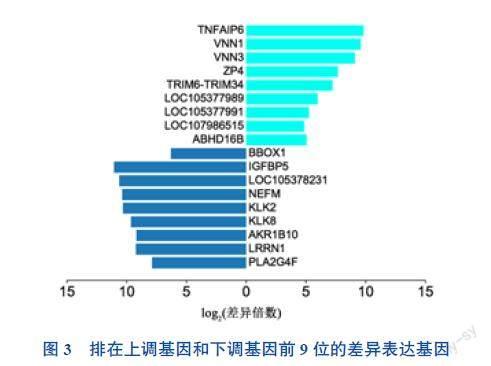
排在上调基因的前9位依次为TNF-α诱导蛋白6(TNFIP6)、蛇毒素1(VNN1)、蛇毒素3(VNN3)、卵透明带糖蛋白(ZP4)、TRIM6-TRIM34、LOC105377989、LOC105377991、LOC107986515和水解酶结构域16B(ABHD16B),而Top10的下调基因分别为Gamma-丁基甜菜碱羟化酶1(BBOX1)、胰岛素样生长因子结合蛋白5(IGFBP5)、LOC105378231、Neurofilament Medium Chain(NEFM)、激肽素相关肽酶2(KLK2)、激肽素相关肽酶8(KLK8)、醛酮还原酶家族1成员B10(AKR1B10)、富亮氨酸重复神经元1(LRRN1)和磷脂酶A2 四类(ⅣF,即PLA2G4F)。见图3。
四、差异表达基因的GO和KEGG富集分析
1. GO富集分析
GO功能性富集分析结果见图4A,該结果显示差异表达基因在生物行为调控(BP)板块主要富集在血小板衍生生长因子结合和辅助因子结合等;在细胞组成(CC)模块主要富集在内质网伴侣复合体和寡糖转移酶复合体等;而在分子功能(MF)模块则主要富集在内质网折叠蛋白和前列腺芽形成等。
2. KEGG富集分析
KEGG富集分析显示差异表达基因富集的信号通路共计39条,前25条包括氮代谢、内质网蛋白加工、蛋白输出、鞘磷脂生物合成——乳酸和新乳酸系列、PI3K-Akt信号通路、转化生长因子-β信号通路、NF-κB信号通路和p53信号通路。NF-κB信号通路与炎症反应密切相关。见图4B。28个差异表达基因参与调控NF-κB信号通路。上调差异表达基因TNF-α在NF-κB信号通路的上游,通过信号级联激活NF-κB信号通路,进一步促进TNF-α和其他炎症因子释放,如IL-1β,从而促进炎症反应。
五、大肠埃希菌刺激对人阴道上皮细胞TNF-α mRNA表达的影响
RT-qPCR检测结果显示,大肠埃希菌刺激人阴道上皮细胞后,TNF-α mRNA相对表达量上调,进一步验证了RNA-Seq测序结果。见图5。
讨论
RNA-Seq技术能全面获取生物样本几乎全部转录本序列信息,为筛选疾病相关候选基因的重要手段。本研究首次通过RNA-Seq技术分析大肠埃希菌诱导人阴道细胞炎症反应的基因表达谱,结合生物信息学分析揭示差异表达基因的潜在生物学功能及其参与的信号通路。测序结果显示,E. coli I组和Con组阴道上皮细胞间共有4 899个差异表达基因,其中下调基因占多数(3 368个),上调基因为1 531个。GO和KEGG分析显示这些差异表达基因主要富集于39条信号通路,与多个细胞生物行为调控、细胞组成和分子功能密切相关。
炎症反应是需氧菌性阴道炎的主要特征之一。NF-κB信号通路与炎症反应密切相关[7]。研究表明,细菌性阴道炎大鼠阴道组织中TNF-α升高,NF-κB信号通路被激活,抑制该通路可改善阴道炎症状[8-9]。本研究显示总计28个差异表达基因参与调控NF-κB信号通路,其中绝大部分为上调。KEGG信号通路图可见TNF-α在NF-κB信号通路中发挥重要作用,它为该信号通路的关键上游基因之一,通过激活NF-κB而进一步促进TNF-α释放,形成恶性循环,加重炎症反应。本研究通过RT-qPCR验证了测序结果,即大肠埃希菌刺激上皮细胞炎症促进TNF-α基因表达。李会阳[6]研究也表明,大肠埃希菌刺激促进VK2/E6E7细胞的IL-1β、IL-6和TNF-α表达,激活NF-κB信号通路。因此,NF-κB信号通路可能为治疗大肠埃希菌相关需氧菌性阴道炎提供治疗靶点。
在排名前9位的上调基因当中,TNFIP6在蛋白酶网络中发挥重要作用,与α间抑制蛋白(I alpha I)形成稳定复合物,增强I alpha I的蛋白酶抑制活性。TNF-α和IL-1等炎症因子可诱导TNFIP6表达,与骨关节炎和类风湿关节炎发生密切相关[10-11]。本研究显示,差异表达基因富集于类风湿关节炎信号通路,进一步提示TNF-α在大肠埃希菌诱导人阴道上皮细胞炎症反应扮演重要角色。目前尚未有研究表明TNFIP6是否参与需氧菌性阴道炎的炎症反应,有待深入研究探讨。
研究显示,毛滴虫感染下调人阴道内皮细胞CFTR表达,促进细胞内氯离子聚集,与滴虫诱发阴道炎症和免疫反应密切相关[12]。本研究显示,CFTR为下调差异表达基因之一。CFTR通过增强TNF 1型相关死亡结构域蛋白(TRADD),从而抑制TNF-α介导NF-κB信号通路激活[13]。CFTR是否能成为干预需氧菌性阴道炎的靶点有待进一步研究揭示。
本研究通过RNA-Seq高通量测序,阐明大肠埃希菌刺激人阴道上皮细胞炎症反应与对照细胞的差异表达基因谱及其潜在生物学功能与参与调控的信号通路,为进一步阐明大肠埃希菌介导的需氧菌性阴道炎的分子机制提供初步实验依据。研究结果初步揭示CFTR及TNF-α等多个环节调控NF-κB信号通路是大肠埃希菌诱导阴道上皮细胞炎症反应关键分子机制。其他差异表达基因及相应信号通路在需氧菌性阴道炎中的作用有待今后研究进一步阐明。
参 考 文 献
[1] 程薇, 周新娥. 需氧菌性阴道炎的病因、诊断及治疗进展. 海南医学, 2020, 31(4): 523-528.
[2] 李文娟, 周宇麒, 冯定云, 等. 成人肠杆菌科菌血症病原菌的临床分布及耐药性分析. 新医学, 2020, 51(1):42-47.
[3] Prasad D, Parween S, Kumari K, et al. Prevalence, etiology, and associated symptoms of vaginal discharge during pregnancy in women seen in a tertiary care hospital in Bihar. Cureus, 2021, 13(1): e12700.
[4] 宋伶俐, 张丽丽, 吴海波, 等. 需氧性阴道炎的菌群分布和耐药性分析. 北华大学学报(自然科学版), 2021, 22(1): 93-96.
[5] Budilovskaya O V, Shipitsina E V, Spasibova E V, et al. Differential expression of local immune response genes in the vagina: implication for the diagnosis of vaginal infections. Bull Exp Biol Med, 2020, 168(5): 646-650.
[6] 李会阳. TLR2/4/NF-κB信号通路及下游细胞因子在需氧菌性阴道炎致病中的作用研究. 天津: 天津医科大学, 2019.
[7] 王嘉睿, 吴永祥, 刘金来. AMPK/SIRT1/NF-κB通路在糖尿病心肌病中的作用. 新医学, 2017, 48(10): 677-682.
[8] 蒋丽, 叶世芸, 郑立肯,等. 基于Nrf-2/HO-1/NF-κB通路探讨苦参膜对混合细菌性阴道炎大鼠的治疗作用. 中药药理与临床, 2022, 38(3): 127-134.
[9] Kim D E, Kim J K, Han S K, et al. Lactobacillus plantarum NK3 and Bifidobacterium longum NK49 alleviate bacterial vaginosis and osteoporosis in mice by suppressing NF-κB-linked TNF-α expression. J Med Food, 2019, 22(10): 1022-1031.
[10] Fu?lo?p C, Sza?nto? S, Mukhopadhyay D, et al. Impaired cumulus mucification and female sterility in tumor necrosis factor-induced protein-6 deficient mice. Development, 2003, 130(10): 2253-2261.
[11] Sza?nto? S, Bárdos T, Gál I, et al. Enhanced neutrophil extravasation and rapid progression of proteoglycan-induced arthritis in TSG-6-knockout mice. Arthritis Rheum, 2004, 50(9): 3012-3022.
[12] Xu J B, Lu S J, Ke L J, et al. Trichomonas vaginalis infection impairs anion secretion in vaginal epithelium. PLoS Negl Trop Dis, 2021, 15(4): e0009319.
[13] Wang H, Cebotaru L, Lee H W, et al. CFTR controls the activity of NF-κB by enhancing the degradation of TRADD. Cell Physiol Biochem, 2016, 40(5): 1063-1078.
(收稿日期:2023-05-08)
(本文編辑:林燕薇)

