复合保温措施对结直肠癌手术患者苏醒期躁动及体温的影响
陈丽丽, 马文涓, 李 丽
(新疆医科大学1护理学院, 第一附属医院2麻醉科, 3中心手术室, 乌鲁木齐 830054)
结直肠癌是临床较为常见的恶性肿瘤疾病,在全球范围内结直肠癌患病率仅次于肺癌和乳腺癌,居世界第三位,其死亡率居恶性肿瘤疾病第二位[1-2]。据全球癌症统计显示,2020年世界结直肠癌新增病例约190万,其中死亡患者高达90万,分别占恶性肿瘤新发病例和死亡病例的10%和9.4%[3]。我国结直肠癌患病率和死亡率也呈增高趋势,2015年我国直肠癌患者约38.76万,死亡患者高达18.71万;2020年我国新增患者达55.5万,死亡患者达28.6万,这对我国居民健康造成了巨大威胁[4]。
现阶段针对结直肠癌患者多给予手术干预,虽然具有较好的治疗效果,但因直肠癌患者手术部位特殊,术中冲洗、输液等操作不仅会导致患者出现应激反应,也可导致机体热量大量消耗,继而促使部分患者苏醒期躁动发生风险增加,且术后更易出现低体温现象[5-6]。低体温主要是指手术期间出现非控制性体温下降现象,可增加患者围术期失血量,诱发凝血功能异常,延缓术后康复[7-8]。由此可见,手术期间为患者提供有效的保温措施尤为重要[9]。然而传统的保温干预仅能让患者体温每小时增加0.1~0.3℃,低体温预防效果不佳,而复合保温措施可为患者提供更为全面的保温干预,可兼顾患者体表温度与外界环境的共同管理,也可在手术过程对患者体温与生命体征实施动态监测[10]。基于此,本研究将复合保温措施用于结直肠癌手术患者中,观察其对结直肠癌患者苏醒期躁动及体温的影响,以期为临床工作提供参考。
1 资料与方法
1.1 一般资料选择2021年10月至2022年3月在新疆医科大学第一附属医院接受手术治疗的100例结直肠癌患者为研究对象。采用随机数字表法将100例结直肠癌患者随机分为对照组(n=50)和观察组(n=50)。其中对照组男性28例,女性22例;年龄30~76岁,平均(44.5±7.6)岁;居住地:农村29例,城镇21例;肿瘤类型:直肠肿瘤27例,结肠肿瘤23例;平均体质指数(23.57±4.51) kg/m2。观察组男性26例,女性24例;年龄28~78岁,平均(45.1±7.3)岁;居住地:农村26例,城镇24例;肿瘤类型:直肠肿瘤26例,结肠肿瘤24例;平均体质指数(23.81±4.42) kg/m2。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究已通过本院伦理委员会批准同意。
1.2 纳入与排除标准纳入标准:(1)符合结直肠癌手术指征,无严重脏器功能障碍者;(2)术前体温正常者;(3)符合术前评估美国麻醉医师协会(ASA)麻醉分级 Ⅱ~Ⅲ级者;(4)年龄≥18周岁患者;(4)通过病理检查确诊者。排除标准:(1)近期存在感染或发热史者;(2)伴有凝血功能障碍者;(3)伴有精神类疾病,无法与医务人员沟通交流者。
1.3 方法
1.3.1 对照组 给予常规保温干预:(1)手术期间将室内温度设定为23~25℃,室内湿度设定为43%;(2)冲洗液及输血输液等均在室温下使用,核对后给予输注;(3)给予患者下肢部位盖一条毛毯,非手术区域使用消毒铺巾进行铺盖;(4)手术期间注意观察患者的体温、寒战等情况,若患者出现寒战情况持续时间大于5 min,则给予患者加用毛毯。
1.3.2 观察组 给予复合保温干预:(1)调节手术室温度:患者在入手术室前半小时将温度设定为23~25℃,室内湿度设定为55%,对患者行皮肤消毒和麻醉期间将室内温度调至25~28℃,手术开始前将室内温度调整为22~24℃;(2)体表加温:患者行手术前先在手术床上铺设无菌单,再于无菌单上铺设38℃的循环水毯,随后给予患者铺盖充气式保温毯,使用加热至40℃的消毒液为患者进行局部消毒处理。手术进行期间根据室内温度注意对患者外露部位采取保暖措施,如患者头部、肩部、上肢以及下肢等部位,均需给予保暖手术巾包裹。此外,在为患者皮肤消毒期间需将手术室温度调整至26℃,并尽量缩短患者消毒时间;(3)体温监测:手术期间对患者进行体温监测,术中注意观察患者体温及生命体征变化,体腔内给予加温干预,包括冲洗液加温、输入液加温,采用加温器对输入液体进行加温,温度设置为39~41℃,加热后的输入液体需2 h内输入完毕,手术使用的冲洗液温度需控制在37~40℃,冲洗时冲洗液需在胸腔内保留5~8 min;(4)复苏期保温:术后患者调整为平卧位,并为患者加盖棉被,转送过程中注意患者体温及生命体征变化情况,苏醒期严密监测患者体温恢复情况及患者反应。
1.4 观察指标(1)记录患者麻醉前、麻醉后、手术前、手术1 h以及手术完成后各时段核心体温变化情况;(2)观察患者术中收缩压、舒张压、心率等指标变化情况;(3)采用多功能酶标仪检测患者血清肾上腺素(epinephrine,E)、去甲肾上腺素(norepinephrine, NE)及皮质醇(Cor)表达水平,操作步骤严格按照说明书进行;(4)记录患者术后躁动、寒战、低体温以及切口感染等并发症发生情况。

2 结果
2.1 两组患者各时段核心体温变化情况对比两组患者麻醉前核心体温对比差异无统计学意义(P>0.05);观察组麻醉后、手术前、手术1 h以及手术完成后各时段核心体温明显高于对照组(P<0.05);核心体温组间与时点交互效应具有统计学意义(P<0.05)。见表1。
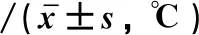
表1 两组患者各时段核心体温变化情况对比
2.2 两组患者术中相关指标变化情况对比观察组患者收缩压、舒张压、心率等指标明显低于对照组,而空腹血糖水平高于对照组(P<0.05)。见表2。
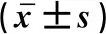
表2 两组患者术中相关指标变化情况对比
2.3 两组患者血清指标变化情况对比两组患者干预前E、NE以及Cor血清表达水平差异无统计学意义(P>0.05);干预后,两组患者血清E、NE以及Cor水平明显升高,但观察组各指标水平升高程度低于对照组(P<0.05)。见表3。

表3 两组患者血清指标变化情况对比
2.4 两组患者并发症发生情况对比观察组术后躁动、寒战、低体温以及切口感染等并发症发生率稍低于对照组,但组间差异无统计学意义(P>0.05)。见表4。
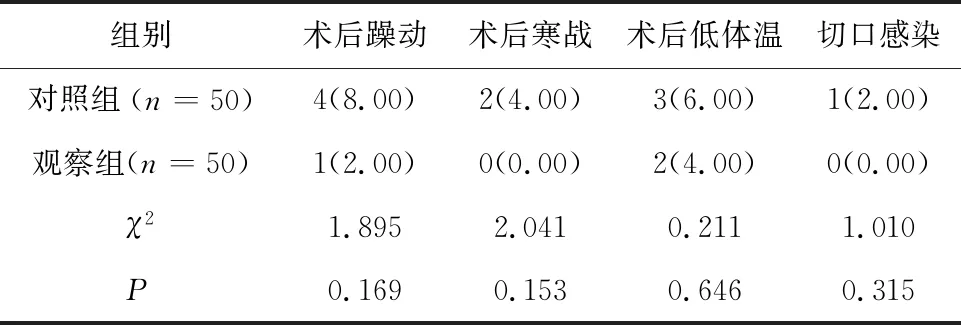
表4 两组患者并发症发生情况对比/例(%)
3 讨论
结直肠癌为一种常见的消化道恶性肿瘤疾病,约85.76%的结直肠癌患者均是可切除的局部进展期类型[11-12]。围术期低体温为结直肠癌手术的常见问题,约70%的手术患者均会出现体温过低现象[13]。体温过低可分为轻度、中度以及重度,即分别为32~35℃、28~32℃及<28℃[14]。而围术期低体温对结直肠癌患者而言,不仅会加重机体应激反应,影响生理指标稳定及术后康复,亦可增加患者凝血功能异常、代谢性酸中毒、免疫力下降、苏醒期躁动以及术后并发症的发生风险[15-16]。因此,有效的保温干预措施尤为重要。
本研究结果显示,两组患者麻醉前核心体温对比无明显差异,至麻醉诱导后两组患者核心体温呈下降趋势,相较于对照组,观察组患者麻醉后、手术前、手术1 h以及手术完成后各时段核心体温下降程度并不明显,同时观察组收缩压、舒张压、心率低于对照组,血糖水平高于对照组,提示复合保温措施在结直肠癌手术患者中可有效减少围术期体温下降程度,减少不良应激刺激,有助于患者生命体征稳定。相较于对照组采用手术大巾、毛毯等术中常规保温手段,观察组在进入手术前就已将室内温度调节至合适温度,并预热手术床,继而有效避免了麻醉诱导前因传导、辐射以及对流等原因所致的热量丢失;手术时输注的液体与室内温度接近,冲洗液也经过加热处理,而低温液可吸收体内热量,导致体温降低。观察组在保温毯的基础上给予保暖措施,并将术中所需输注的液体放置于恒温箱,减少热量丢失,避免因低体温过低导致患者小气道收缩痉挛,进而稳定了呼吸频率及脉率。
血清E、NE以及Cor等均属于应激损伤指标,当机体出现创伤、炎症时,其表达呈增高趋势,当炎症、创伤逐渐恢复时其表达可逐渐下降至正常水平[17-18]。本研究结果显示,两组干预前血清E、NE以及Cor水平无明显差异;干预后,两组上述指标表达明显升高,但观察组明显低于对照组。提示复合保温措施可有效减少结直肠癌手术患者机体应激反应。复合保温措施通过手术室温度控制、体温检测、体表加温等方式有效减少了机体应激损伤,促进机体代谢。有研究表明,结直肠癌患者术后切口感染发生率可达5%~40%[19];加之手术期间体温过低可使患者心输出量降低,心肌收缩力下降,循环障碍,促使组织缺氧,继而增加患者术后寒战、术后低体温以及术后躁动等并发症发生风险。本研究结果显示,对照组与观察组术后躁动、寒战、低体温以及切口感染等并发症发生率差异无统计学意义(P>0.05)。对照组通过手术大巾、毛毯等被动保暖措施的保温效果与患者铺盖的接触面积密切相关,因而在手术操作期间保暖效果欠佳,而观察组患者通过复合保温措施采用的输液管理有效避免了术中冷液体输注导致体温降低,同时充气式保温毯亦有效增加了患者的机体热容量,可减少手术期间经皮肤散失的热量。
综上所述,复合保温措施在结直肠癌手术患者中可保持围术期各时段核心体温及生命体征稳定,降低应激损伤,有助于促进患者快速康复。但本研究存在样本量小等不足,因此,相关结论仍需在今后的研究中加以验证。

