6起副溶血性弧菌食源性疾病聚集事件分离株病原学特征分析
李东迅,舒高林,王维钧,张 阳,谷 田,牛桓彩
(北京市昌平区疾病预防控制中心,北京 102206)
副溶血性弧菌主要存在于海产品、盐渍食品中,感染后会引起腹泻、呕吐、发烧、血便等急性胃肠炎症状,是引起水产类食物中毒的主要病原菌[1-3]。近年来,海产品消费大众化,内陆地区由副溶血性弧菌引起的食物中毒呈上升趋势[3-4]。北京市昌平区近年的腹泻病原菌监测结果显示,副溶血性弧菌腹泻病例也呈上升趋势[5]。本研究对2018—2019年北京市昌平区发生的6起食源性疾病聚集事件中分离到的23株副溶血性弧菌,进行脉冲场凝胶电泳(Pulsed Field Gel Electrophoresis,FPGE)、耐药和毒力基因检测,分析菌株PFGE型别、耐药性及毒力基因携带情况,为本地区副溶血性弧菌食源性疾病的预防和控制提供数据支撑。
1 材料与方法
1.1 菌株
2018—2019年北京市昌平区6起食源性疾病聚集事件中分离到的23株副溶血性弧菌(事件1:5株;事件2:1株;事件3:3株;事件4:9株;事件5:2株;事件6:3株),其中20株来源于患者,1株(事件4)来源于厨师(带菌者),2株(事件4)来源于食品。药敏质控菌株为大肠埃希氏菌ATCC25922。
1.2 试剂及仪器
副溶血性弧菌分型血清(日本生研);革兰阴性需氧菌药敏检测A3板和A4板(上海星佰);副溶血性弧菌tlh/tdh/trh三重实时荧光PCR检测试剂盒(北京卓诚惠生);Seakem Gold 琼脂糖(瑞士LONZA);限制性内切酶XbaI、SfiI(美国NEB);蛋白酶K(德国Merck);荧光定量PCR仪(瑞士Roche LightCycler 480);凝胶成像系统(美国Bio-Rad);脉冲场凝胶电泳(美国Bio-Rad)。
1.3 方法
1.3.1 血清分型
血清分型严格按照副溶血性弧菌血清抗体产品说明书对菌株进行,K抗原不可分型计为KUT。
1.3.2 毒力基因
采用水煮法进行基因组DNA提取:挑取适量新鲜培养的菌苔于200 μL无菌水中,涡轮振荡混匀,100 ℃金属浴10 min,12 000 r·min-1离心2 min,取上清液待用。耐热直接溶血毒素基因(tdh)、耐热相关溶血毒素基因(trh)和不耐热溶血毒素基因(tlh)3种毒力基因的检测方法详见试剂盒说明书。
1.3.3 药敏实验
选用17种抗生素进行药敏实验,即氨苄西林、氨苄西林-舒巴坦、阿莫西林-克拉维酸、复方磺胺甲恶唑、四环素、氯霉素、头孢唑林、头孢噻肟、头孢他啶、头孢西丁、头孢吡肟、庆大霉素、亚胺培南、阿米卡星、美罗培南、环丙沙星和左氧氟沙星,17种抗生素相应的浓度详见说明书。药敏实验操作和结果判读严格按照说明书进行。质控菌株肠埃希氏菌ATCC25922。
1.3.4 PFGE分型
参照国家致病菌识别网的副溶血性弧菌的脉冲场凝胶电泳标准[6],选用限制性内切酶SfiⅠ对副溶血性弧菌进行酶切,沙门菌标准株H9812选用限制性内切酶XbaI进行酶切。用BioNumerics软件对PFGE图谱进行处理分析,采用算术平均值加权配对组合法构建聚类树状图。按照Tenover原则判断菌株间关系,即酶切后图谱完全一致定为同一菌株型;图谱有条带不同者1~3条,可认为菌株间关系较密切;图谱有3条以上条带不同者认为菌株间关系不密切[6]。
2 结果与分析
2.1 血清分型
6起事件中有5起的副溶血性弧菌血清型为O3:K6型,事件3为O4:K8型,事件4为O3:K6、O8:K20型两种血清型,事件1为O3:K6、O4:K8、O4:KUT 3种血清型(表1)。
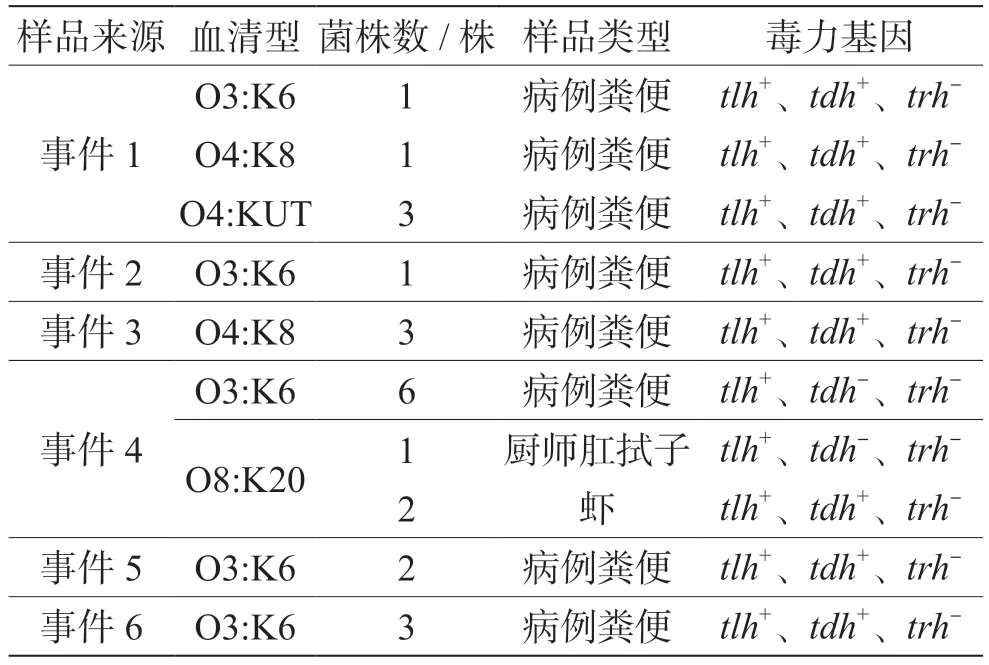
表1 6起事件的副溶血性弧菌血清型及毒力基因
2.2 毒力基因检测
6起事件中的21株人源分离株毒力基因均为tlh+、tdh+、trh-,2株食品分离株毒力基因为tlh+、tdh-、trh-(表1)。
2.3 药敏结果
6起事件中的副溶血性弧菌对氨苄西林,除事件1中有1株菌(4.35%)中介外,其他菌株均敏感;对头孢唑林,事件1的5株菌(21.74%)全部耐药,6株菌(事件5、事件6中各2株,事件2、事件4中各1株;26.09%)中介,其余菌株敏感;6起事件中的副溶血性弧菌对其他15种抗生素完全敏感,实验中未出现多重耐药菌株(表2)。
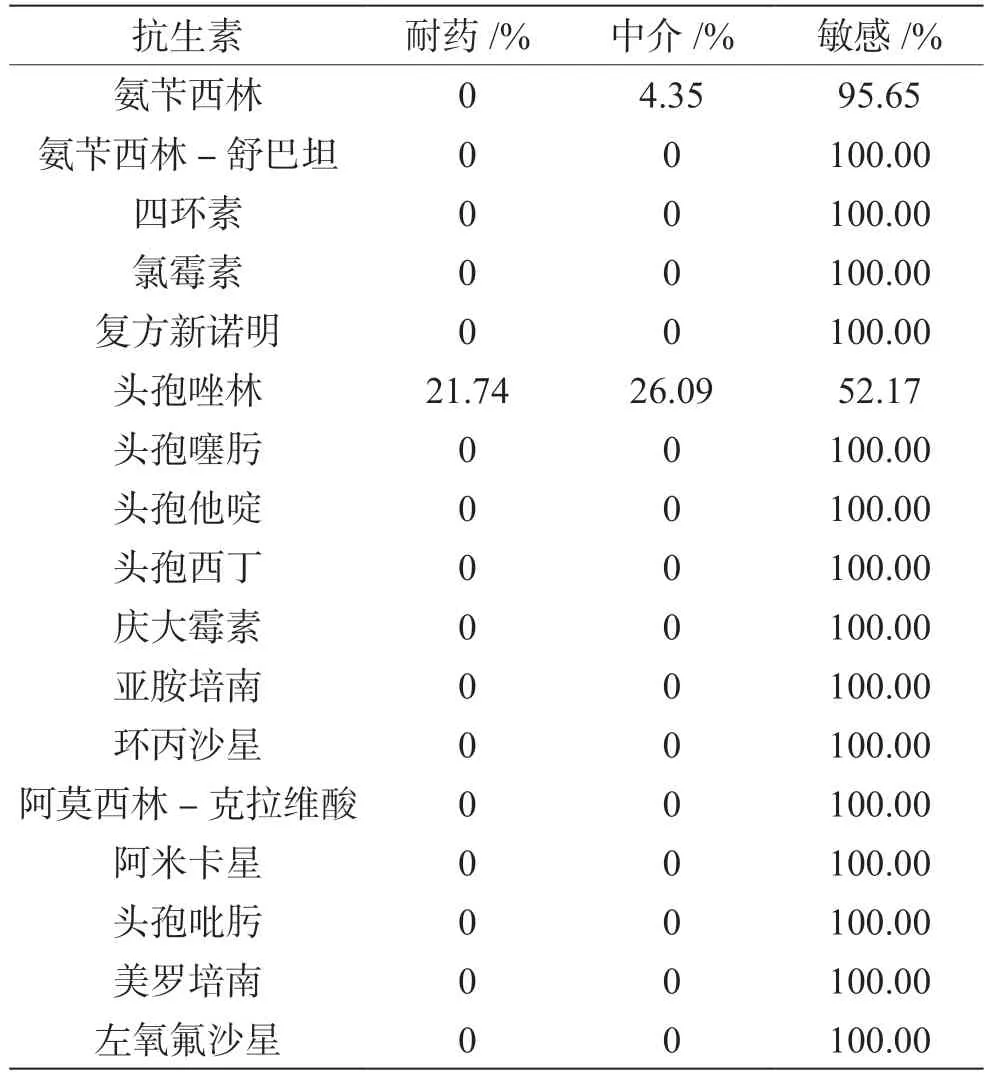
表2 副溶血性弧菌的抗生素敏感性
2.4 PFGE分型
由图1可知,事件1的5株菌分为4种PFGE带型,即PT01~PT04;事件2、事件3、事件5和事件6的菌株只有1种PFGE带型;事件4的人源分离株均为PT06,食品分离株均为PT08。图中监测来源属于散发病例,发现带型PT02、PT03、PT06和PT09在散发病例菌株中也有出现,PT01、PT04分别与散发病例菌株PFGE带型PT10、PT05相差1个条带,PT07与散发病例菌株带型PT03相差2个条带。
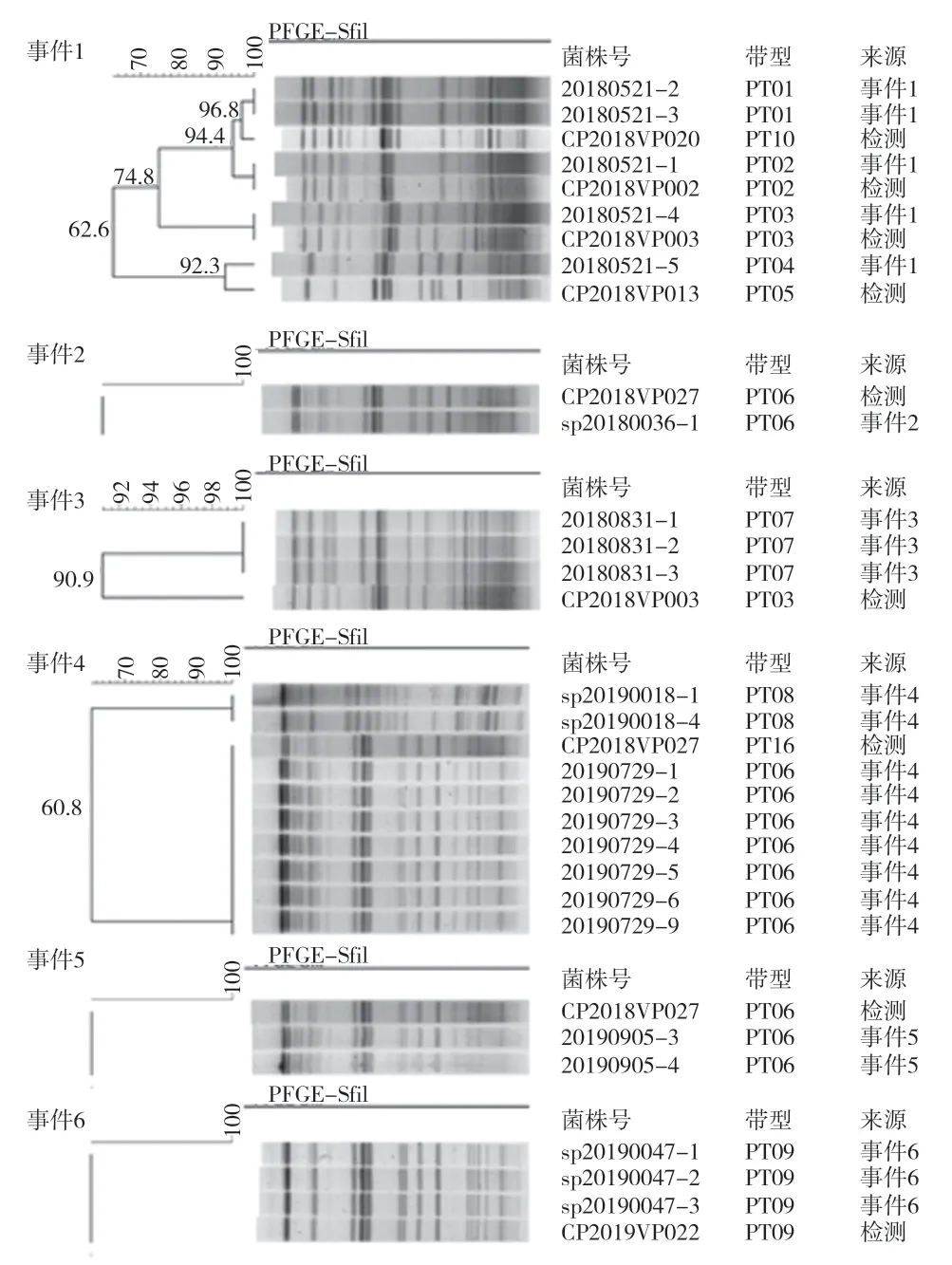
图1 6起副溶血性弧菌聚集事件分离菌株PFGE聚类分析
3 结论与讨论
食用被副溶血性弧菌污染的食物可引起副溶血性弧菌食物中毒,主要为海产品,多发生在沿海地区,夏秋季(6—10月)居多,具有明显的高温季节高发特征[7]。在食源性疾病的主动监测中,北京地区由副溶血性弧菌引发食源性疾病事件逐年上升,以O3:K6型和O4:K8型最常见,食物中毒事件中又以O3:K6为主[4-5,8-9]。本研究中有5起事件的副溶血性弧菌血清型为O3:K6型(13株菌)。本研究还出现2株食品分离株为O8:K20型,该血清型比较少见,应引起关注。
急性胃肠道症状主要由不耐热溶血毒素(Thermolabile Hemomysin,TLH)、耐热直接溶血毒素(Thermotolerant Direct Hemolysin,TDH)和耐热相关溶血毒素(Thyrotropin-Releasing Hormone,TRH)引起,基因编码分别为tlh、tdh、trh。毒力基因tdh和trh是副溶血性弧菌最主要的毒力基因,tlh基因则有种属特异性[10-11]。以往研究结果显示[10],临床分离株大多含有tdh基因,含trh基因菌株较少;食品分离株或环境分离株大多不含tdh和trh基因。本研究中,6起事件中的人源(病例和厨师)分离株毒力基因均为tlh+、tdh+、trh-,而食品分离株毒力基因为tlh+、tdh-、trh-。
近年来,随着物流、快递行业的迅速发展,海产品在内陆地区销量增加,进一步推动了海产品的大量养殖,副溶血性弧菌污染也成为海产品养殖业的主要威胁之一。同时,抗生素的不规范使用使得副溶血性弧菌耐药性日益严重。有研究显示,北京市副溶血性弧菌人源分离株对头孢唑啉、链霉素和氨苄西林的耐药性较高[11]。本研究中的副溶血性弧菌除头孢唑啉外,对其他抗生素都比较敏感,与本区散发病例分离株耐药性一致[5,12]。虽然本研究的副溶血性弧菌对多数抗生素敏感且无多重耐药菌株出现,也应引起重视,临床治疗过程中应合理用药,减少耐药副溶血性弧菌的产生[11]。
PFGE常用于病原菌的分子流行病学研究,可以从分子层面分析菌株关系,对菌株进行溯源分析[6]。本研究中,6起事件中菌株的PFGE带型与本地区散发病例株带型相同或相差1~2个条带,有3起事件由食源性疾病主动监测中的优势带型(PT06)引起。根据Tenover判定原则,带型相差1或2个条带的菌株来源于同一克隆源,由此可推测另3起事件菌株与本地区散发病例菌株亲缘关系密切。事件4的厨师分离株与病例株带型相同,推测此次事件可能由带菌厨师传染引起,应加强厨师等食品从业人员的专业培训,对其进行食品安全知识的宣传教育,提高此类从业人员的食品安全意识。相应监管部门应加强餐馆等食品行业的监督,减少食源性疾病事件的发生。除事件4外,其余5起事件无法溯源,需要进一步提高流调人员的流行病学调查能力和实验室的检测水平,进而提高问题食品的溯源能力。

