不同喀斯特小生境下普定杜鹃花土壤酶活性变异特征
袁丛军 王浩东 杨秀威 杨瑞 戴晓勇 丁访军 吴华丽

摘要:【目的】研究典型喀斯特不同小生境下土壤酶活性及其變异特征,为喀斯特地区植被恢复提供科学依据。【方法】以贵州喀斯特区(镇宁县、晴隆县、望谟县)的圆果化香树+普定杜鹃花(Rhododendron pudingense)群落为对象,通过测定3种小生境(土面、石沟、石面)中土壤胞内酶(脲酶、蔗糖酶、纤维素酶、蛋白酶)和胞外酶[(酸性磷酸酶(AP)、过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)]活性,分析其在不同小生境中的变异特征及其与环境因子的相互关系。【结果】3种小生境下胞内酶和胞外酶均呈现出土面>石沟>石面,且胞内酶活性均小于胞外酶,胞外酶约占总体酶活性的93%;不同小生境下土壤酶活性差异显著(P<0.05),除晴隆的群落土壤脲酶、POD和SOD活性表现为土面>石面>石沟外,其余的土壤酶活性均为土面>石沟>石面;土壤酶活性受到群落中植物物种多样性影响,晴隆的群落中植物生长最旺盛,土壤酶活性相较于镇宁和望谟更高;小生境间的差异性影响土壤酶活性变化,尤其是水分、温度、腐殖质含量及土壤厚度等影响较大,而生境间差异导致地上植物多样性丰度不均,对底物供应也具有一定影响;喀斯特土面小生境条件最优,最适合植物生长,石沟小生境次之,石面小生境条件最差。【结论】喀斯特生境土壤酶活性受小生境类型影响,土面小生境土壤的酶活性普遍高于石沟和石面,土壤酶活性变化一定程度解释特有种普定杜鹃花生长在喀斯特小生境。
关键词:喀斯特;小生境;普定杜鹃花;土壤酶活性;环境因子;胞外酶
中图分类号:S718.5 文献标志码:A 文章编号:2095-1191(2023)02-0525-10
Abstract:【Objective】To investigate soil enzyme activity and its variation characteristics in different microhabitats of typical karst areas, and to provide scientific basis for vegetation restoration in karst regions. 【Method】Platycarya longipes+Rhododendron pudingense communities in karst regions of Guizhou(Zhenning County, Qinglong County and Wangmo County) were taken as research object. Activities of soil intracellular enzymes (urease, sucrase, cellulase and protease) and extracellular enzymes [acid phosphatase(AP), peroxidase(POD), catalase(CAT) and superoxide dismutase(SOD)] in 3 microhabitats [soil surface(SS), rock gully(RG), rock surface(RS)] were determined to analyze variation characteri-stics of enzymes activity in different microhabitats and their relationships with environmental factors. 【Result】In 3 microhabitats, activity of intracellular and extracellular enzymes was as SS>RS>RG, and activities of all intracellular enzymes were lower than activities of extracellular enzymes which accounted for 93% of total enzymes activity;significant differen-ce in soil enzyme activity was found among different microhabitats(P<0.05). Except for that the urease, POD, and SOD activities in Qinglongs community showed a trend of SS>RS>RG, activity of the rest soil enzymes followed a trend of SS>RG>RS; soil enzyme activity was influenced by plant species diversity in the community, and as plants grew the most vigorously in the community of Qinglong, soil enzyme activity in Qinglong was higher than that in Zhenning and Wangmo.Differences among microhabitats(especially differences in moisture, temperature, humus content, and soil thickness) greatly affected soil enzyme activity, and differences among microhabitats led to uneven abundance of above-ground plant diversity, thereby influencing substrate supply, which imposed a certain impact; in karst region, SS boosted the best microhabitat condition, which was the most suitable for plant growth, followed by RG, and RS had the poorest condition. 【Conclusion】Soil enzyme activity in karst habitats is influenced by microhabitat type and soil enzyme activity in microhabitat of soil surface is usually higher than that of rock gully and rock surface. Variation of soil enzyme activity explains the growth of endemic R. pudingense in karst microhabitats to a certain degree.
Key words: karst; microhabitat; Rhododendron pudingense; soil enzyme activity; environmental factor; extracellular enzyme
Foundation items:National Natural Science Foundation of China(32060244);Guizhou Science and Technology Foundation Project(QKHJC-ZK〔2021〕Yiban 097);Guizhou Science and Technology Conditions and Service Capacity Construction Project(QKHFQ〔2020〕4010)
0 引言
【研究意义】土壤酶(Soil enzyme)是土壤有机体的代谢动力和生物催化剂,在土壤系统的物质循环和能量转化过程中起着重要作用(王理德等,2016),土壤中酶主要通过土壤微生物活动、植物根系分泌物和动植物残体腐解过程释放。土壤酶还能促进土壤有机质的合成与降解,植物生长所需无机养分的释放、氮的固定、硝化、反硝化及外来生物的解毒等过程均与之相关(Alkorta et al.,2003;Burns et al.,2013)。土壤酶活性对土壤肥力具有一定指示作用,可反映土壤养分转化的强弱(Utobo and Tewari,2015)。同时,温度、pH、微地形及土壤水分含量等多种因素在不同程度上影响着土壤的酶活性及稳定性(刘捷豹等,2017)。研究喀斯特地區不同小生境土壤酶活性的变异规律,对剖析喀斯特小生境类型多样性和高异质性特征具有重要意义。杜鹃花属(Rhododendron)植物因观赏价值颇高而全球闻名,其原生种类大多喜深厚的酸性土,喀斯特山地分布种类极为罕见。自普定杜鹃花(Rhododendron pudingense)新种确定(Dai et al.,2020)以来,研究发现其仅分布于喀斯特石质山地,生境极其特殊,为喀斯特适生分布的特有杜鹃花种类,研究其生境土壤酶活性可为揭示其独特适宜性提供理论依据。【前人研究进展】喀斯特地区是世界主要生态脆弱带之一(袁道先,2001;陈洪松等,2013),贵州是世界三大岩溶集中连片区面积最大、岩溶发育最强烈的典型区域中心区(宋同清等,2015),小生境类型多样和异质性高是喀斯特生境典型特征(喻理飞等,2002)。生境限制是退化喀斯特生态恢复治理的基础(严令斌,2020)。根据成因和外部形态特征将小生境划分为石沟、石面、石槽、土面、石缝及石洞等6种类型(朱守谦,2003;刘方等,2008)。目前针对喀斯特土壤酶研究相继报道(李丹等,2008;邹军等,2010;崔晓晓等,2011;符裕红等,2017;潘复静等,2020)。邹军等(2010)研究花江峡谷4个退化喀斯特植被恢复阶段中土壤脲酶、淀粉酶和多酚氧化酶(Polyphenol oxidase)活性特征表明,3种土壤酶活性均随植被恢复过程逐渐提高;崔晓晓等(2011)研究喀斯特峡谷区退化森林不同恢复阶段中过氧化氢酶(Catalase,CAT)、碱性磷酸酶(Alkaline phosphatase,ALP)、脲酶和蔗糖酶活性变异;薛飞等(2020)探究喀斯特森林凋落物对土壤CAT、ALP、脲酶和蔗糖酶的影响;廖全兰等(2021)分析不同地形土壤酶活性与植物多样性的关系,发现土壤酶活性与植物多样性间的相关性因酶的种类不同而呈现差异性。前人研究多集中在土壤酶活性对地形、植被类型、恢复阶段、石漠化程度等环境因子响应,且研究地点单一,并未揭示小气候和小生境对土壤多种酶活性影响。普定杜鹃花是杜鹃花科(Ericaceae)杜鹃花属(Rhododendron)的典型适生喀斯特石质山地的常绿灌木新种(Dai et al.,2020)之一,为贵州特有种,目前仅发现分布于镇宁、普定、晴隆、望谟等地的喀斯特石灰岩山地,小生境类型多样。杜鹃花属植物多喜土层深厚的酸性黄壤或黄棕壤,该种植物生态适应研究对喀斯特石质山地的特有杜鹃花属植物种类开发利用极具研究价值。【本研究切入点】普定杜鹃花生长的小生境种类颇为丰富,而针对普定杜鹃花在不同喀斯特小生境下土壤酶活性变异特征研究尚属空白。【拟解决的关键问题】以普定杜鹃花不同小生境土壤为对象,测定分析土壤主要酶活性特征,阐明不同气候和小生境类型(土面、石沟和石面)的土壤酶活性的差异,探讨土壤酶活性的变异规律及其对不同环境因子的响应特征,揭示喀斯特特有乡土植物生态适应机制,为喀斯特地区植被恢复提供科学依据。
1 材料与方法
1. 1 研究区概况
试验区域为贵州省镇宁县大山镇新发村(简称镇宁)、晴隆县东观街道哈马村(简称晴隆)和望谟县乐旺镇黑洞(简称望谟)。镇宁采样点2009—2019年平均温度14 ℃,8月平均温度22.7 ℃及平均降水量159 mm;晴隆采样点平均温度14 ℃,8月平均温度21.4 ℃及平均降水量216 mm;望谟采样点平均温度19.5 ℃,8月平均温度26.5 ℃及平均降水量188 mm。3个采样点地貌均属喀斯特石质山地、小生境类型丰富,群落均为圆果化香树(Platycarya longipes)+普定杜鹃花群落。所选的3个采样点为前期调查发现普定杜鹃花现有分布点中生长状态最好、生境类型最典型的地点。群落特征如表1所示。
1. 2 试验方法
1. 2. 1 喀斯特小生境类型划分 根据安明态(2019)的观点划分小生境类型,并结合实际情况适当修改,小生境划分标准如下:(1)土面(Soil surface,SS)小生境。存在2种情况:连片土体覆盖面积>1 m2以土体为主,基岩裸露率<50%,表面较为平缓的小生境。(2)石沟(Rock gully,RG)小生境。存在以下4种情况:基岩裸露率>50%,连片土体覆盖面积<1 m2,形成的岩石凹槽(凹沟)深度>30 cm;虽形成的岩石凹槽(凹沟)深度<30 cm,但土层厚度超过30 cm;以土体为主,基岩裸露率<50%,且形成了岩石凹槽(凹沟)深度超过30 cm的小生境;虽然可能沟槽底部土被浅薄或仅有枯枝落叶,但沟槽相对较深。(3)石面(Rock surface,RS)小生境。基岩裸露率>50%,连片土体覆盖面积<1 m2,形成的岩石凹槽(凹沟)深度<30 cm,且土层厚度<30 cm。
1. 2. 2 土壤样品采集方法 于2022年7月27日—8月1日在3个采样点各设1个具有典型代表性样地,样地面积20 m×10 m,记录坐标、海拔、坡度和坡向等信息。在样地内选择生长状况良好、地径大小相近的普定杜鹃花植株,记录植株地径、株高和地表覆盖物等信息并挂牌标记,按照土面、石沟、石面3种小生境(生境间间隔5 m以上),去除表层枯落物及腐殖质层等杂质,分别收集植株东、西、南、北4个方向的根际和根围(1∶1)土壤,混合后约20 g,每种小生境取样3次重复,共计27份样品,每个采样点的采样工作于1 d内收集完,用无菌袋密封、放入装有冰袋泡沫箱,放入就近冰箱4 ℃冷藏。待采样完成后统一带回实验室,用干冰保存立即送检。
1. 2. 3 土壤酶活性测定及计算 选择的土壤胞外酶[CAT、酸性磷酸酶(Acid phosphatase,AP)、POD和SOD]及胞内酶(蛋白酶、脲酶、纤维素酶和蔗糖酶)活性均采用上海沪鼎生物科技有限公司试剂盒检测,运用酶联免疫吸附实验——双抗体夹心法测定。具体方法:用纯化的目标酶抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入所测的目标酶,再与辣根过氧化物酶(HRP)标记的目标酶抗体结合,形成抗体—抗原—酶标抗体复合物,经过彻底洗涤后加底物3,3',5,5'-四甲基联苯胺(TMB)显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。样品中的目标酶与黄色的深浅呈正相关。用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中目标酶活性浓度。本研究中总体酶活性即胞内酶与胞外酶活性之和。
1. 3 统计分析
采用Excel 2016将数据整合后,利用SPSS 26.0进行统计与分析。不同小生境类型下土壤胞内酶、胞外酶和总体酶显著性差异利用单因素方差分析;对3个地点不同小生境酶活性进行双因素方差分析;对27个土壤样品酶活性与7个环境(海拔、坡度、坡向、年均温度、年均降水量、月均温度和月均降水量)因子进行Pearson相关分析。使用Origin 2021绘图。
2 结果与分析
2. 1 不同小生境土壤酶活性总体特征
如图1所示,胞内酶、胞外酶和总体酶活性在3个采样点间差异未达显著水平(P>0.05,下同),在不同小生境间差异达极显著水平(P<0.01,下同),地点与生境间存在交互作用,差异达极显著水平。土壤胞外酶活性远大于胞内酶活性。镇宁和望谟采样点的3种小生境下土壤胞内酶、胞外酶和总体酶活性均呈现土面>石沟>石面,而晴隆采样点呈现出土面>石面>石沟。
不同小生境类型下土壤酶活性变异特征如图2所示,土壤胞内酶、胞外酶及总体酶的活性均表現为土面>石沟>石面;土壤胞内酶、胞外酶及总体酶的活性在石沟与石面小生境间均差异显著(P<0.05,下同),土面与石沟和石面小生境间均差异极显著。
2. 2 不同小生境土壤胞内酶和胞外酶活性特征
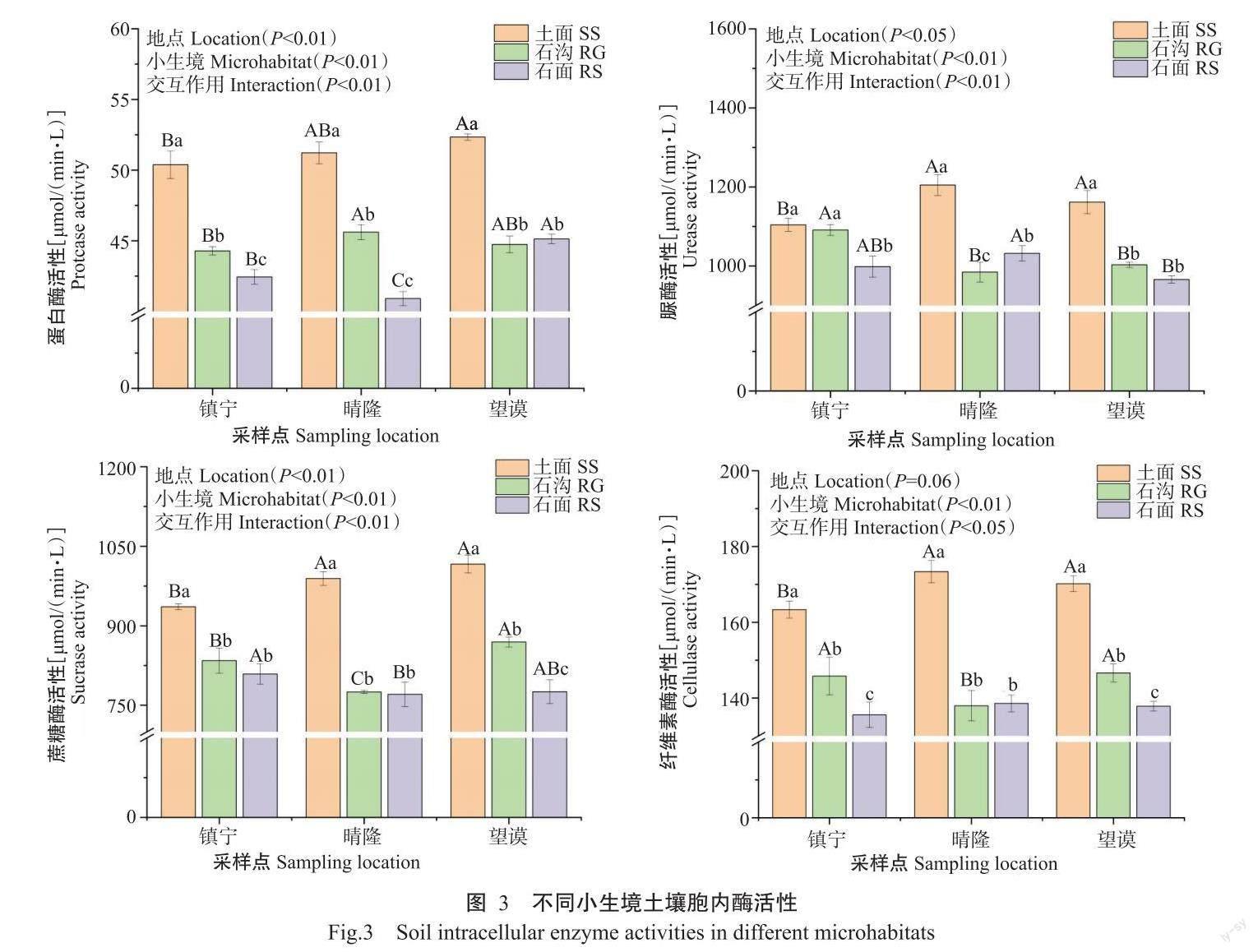
2. 2. 1 土壤胞内酶活性特征 如图3所示,与土面相比,石沟和石面小生境土壤的脲酶平均值分别低11.0%和13.6%,蔗糖酶分别低15.6%和19.8%,纤维素酶分别低15.0%和18.7%,蛋白酶分别低12.5%和16.6%。晴隆采样点的土壤脲酶和纤维素酶表现为土面>石面>石沟,其余2个采样点的胞内酶活性均表现为土面>石沟>石面。总体上,土面小生境土壤的各类酶活性均高于石沟和石面。其中,镇宁的土面和石沟土壤脲酶与石面差异显著;对于镇宁的蔗糖酶、晴隆的蔗糖酶和纤维素酶及望谟的蛋白酶,土面与石沟和石面这2种石质生境间差异显著;镇宁的纤维素酶和蛋白酶、晴隆的脲酶和蛋白酶及望谟的蔗糖酶和纤维素酶在3种小生境间呈显著差异。双因素方差分析结果表明,除纤维素酶未受地点的显著影响,脲酶、蔗糖酶和蛋白酶受地点和小生境的显著影响,且4种胞内酶受到地点与小生境的交互作用影响。
2. 2. 2 胞外酶活性特征 如图4所示,与土面相比,石沟和石面的土壤AP平均值分别低7.5%和11.6%,土壤POD活性分别低11.8%和13.8%,CAT分别低9.6%和11.0%,土壤SOD分别低12.5%和15.3%。晴隆的POD和CAT活性表现为土面>石面>石沟,其余2个采样点的胞外酶活性均表现为土面>石沟>石面。总体上,土面小生境的各类土壤酶活性均高于石沟和石面。其中,镇宁土面和石沟的土壤AP和CAT与石面差异显著,晴隆土面和石沟的土壤AP与石面差异显著;晴隆的POD及望谟的POD和SOD,上述酶的活性在土面与2种石质生境间差异显著;镇宁的POD和SOD,晴隆的CAT,以及望谟的AP、CAT和SOD活性在3种小生境间差异显著。双因素方差分析结果表明,除AP未受到地点的显著影响,POD、CAT和SOD受到地点和小生境的显著影响,且4种胞外酶受到地点与小生境的交互作用影响。
2. 3 不同小生境土壤酶活性对环境因子的响应
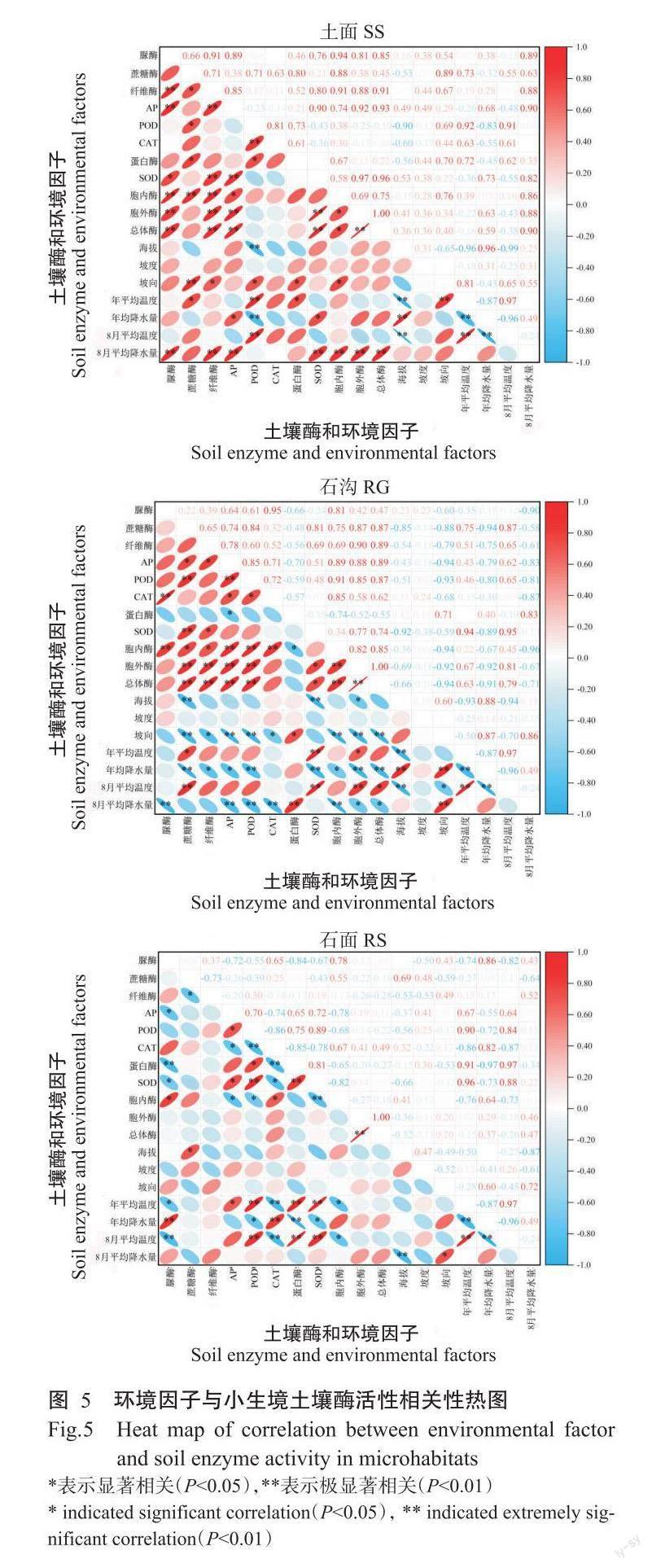
2. 3. 1 土面小生境酶活性 对土面小生境酶活性与环境因子进行相关分析,结果(图5)显示,土面小生境中,POD活性与海拔呈极显著负相关,AP活性与坡度呈显著正相关,蔗糖酶、纤维素酶、蛋白酶、POD和胞内酶活性与坡向有关,POD、蔗糖酶和蛋白酶与与温度关系密切,POD、蔗糖酶和蛋白酶活性与年平均降水量呈显著负相关,脲酶、纤维素酶、AP活性、胞内酶和胞外酶与总体酶活性与8月平均降水量呈极显著正相关。
2. 3. 2 石沟小生境酶活性 对石沟小生境酶活性与环境因子进行相关分析,结果(图5)显示,蔗糖酶和SOD活性与海拔呈极显著负相关,蔗糖酶、AP、POD、胞内酶和胞外酶与总体酶活性与坡向呈极显著负相关,纤维素酶和CAT与坡向呈显著负相关,蛋白酶活性与坡向呈显著正相关,SOD、蔗糖酶和胞外酶活性与年平均温度关系密切,AP、蔗糖酶和胞外酶活性受降水量抑制作用,蔗糖酶、SOD、胞外酶活性和总体酶活性与8月平均温度两两正相关。
2. 3. 3 石面小生境酶活性 对石面小生境酶活性与环境因子进行相关分析,结果(图5)显示,CAT和蔗糖酶活性与海拔两两正相关,蛋白酶和POD与海拔呈显著负相关,CAT、脲酶和胞内酶与年平均温度呈显著负相关,AP和SOD活性与年平均温度成显著正相关,POD、蛋白酶活性与年平均温度呈极显著正相关,脲酶活性和胞内酶与年平均降水量呈显著正相关,CAT与年平均降水量呈极显著正相关,SOD活性与年平均降水量成显著负相关,POD和蛋白酶活性与年平均降水量呈极显著负相关,脲酶和CAT与8月平均温度成极显著负相关,胞内酶活性与8月平均温度成显著负相关,POD和蛋白酶活性与8月平均温度成极显著正相关。
3 讨论
3. 1 喀斯特小生境类型对土壤酶活性的影响
生境生态有效性取决于小生境类型和结构特征,形成喀斯特典型的生境异质性特征,表现为地面温度、光照强度、气温及相对湿度等差异(喻理飞等,2002;李安定等,2010)。土壤酶是有机质分解和矿化的主要生物催化剂,影响着土壤中碳氮磷的循环(曹慧等,2003),在一定程度上表征土壤的肥力情况。本研究中不同小生境下土壤酶活性差异显著,其中土面小生境土壤的各类酶活性最高,石沟小生境较石面小生境的酶活性高,说明土壤酶活性受到小生境类型(汤茜等,2020)或岩性条件差异(符裕红等,2017)的影响。酶催化土壤中生物的化学过程是在特殊的微环境中进行,pH、温度及水分等变化会引起土壤酶活性变化(林娜等,2010)。喀斯特生境异质性高(朱守谦,2003),保水能力、储存养分能力等存在差异。土壤含水率与土层深度存在显著正相关(李安定等,2008)。本研究中不同小生境的土层厚度表现为土面>石沟>石面,土面小生境由于土层较厚,保水能力较强,含水率高,植物根系生长旺盛,土壤微生物数量增加,土壤酶活性也较高;石沟小生境在遇到雨水冲刷时,沟能贮存更多的水分和养分。底物的供应也会影响酶的活性(魏翠翠等,2018)。土面灌木较为茂盛,枯落物较多,丛生灌木还可利用地上部分聚集大量枯落物,底物的供应充足;而石沟小生境两边的基岩凸起,中间沟壑状结构对枯落叶起到聚集的作用;石面小生境较为平缓,易受到风的影响,表面很难堆积枯落物,酶活性也较低。
生境土壤的理化特性也会对单一酶的活性产生影响。脲酶的活性与土壤腐殖质含量存在正相关(马洁怡等,2020),其活性能在一定程度上反映供氮能力。去除土面表层枯落物后,土壤上层含有较多腐殖质,结果显示土面小生境土壤的脲酶活性显著高于石沟和石面,这是由于腐殖质的结构会提升土壤保水能力、养分供应能力,进而提高酶活性。基岩裸露导致土面与石沟、石面产生温度差异,土面温度变化较小,石面、石沟散热块(俞国松等,2011;Yan et al.,2019),土面小生境温度较石沟高(李安定等,2010),温度高将提高脲酶、AP的活性。本研究中土面小生境土壤的各类酶活性均比石沟和石面高,这与土面上植物多样性丰富、枯落物多、根系发达及分泌物复杂等因素有关,使得CAT、蔗糖酶、AP、脲酶、蛋白酶和POD等的酶活性较高(杨万勤和王开运,2004)。在高钙高镁低磷的喀斯特山地中,土面小生境地上植被茂盛,地下根系发达,能分泌更多磷酸酶,更好的促进植物吸收有机磷。综上,土面最适植物生长,石沟次之,石面小生境条件最差。
3. 2 环境因子对土壤酶活性的影响
森林类型和群落结构影响土壤酶活性(邹军等,2010),本研究显示望谟和镇宁采样点的土壤酶活性均表现为土面>石沟>石面,而晴隆的土壤脲酶、纤维素酶、CAT、POD及胞内酶、胞外酶和总体酶活性表现为土面>石面>石沟,这与晴隆采样点森林群落郁闭度高、乔木层树种密度大相关(符裕红等,2012)。晴隆的圆果化香树在生长过程中,利用树种特有的生物学特点改变林下温度、湿度和枯落物等微环境条件,改善了石面小生境的恶劣水热条件等,增加了土壤酶活性,表明喀斯特小生境中土壤酶活性受地上植被影响。土层浅薄不连续、生境异质性是喀斯特石质山地典型特征。喀斯特表层土(0~10 cm)的土壤酶活性大于下层土(>10 cm),这是由于地上凋落物和腐殖质主要集中在土壤表层,有机质含量高于土壤下层,上层透气性及水热条件更好,导致土壤酶活性高(兰雪等,2009,汤茜等,2020;严令斌,2020)。考虑土面、石沟和石面小生境的土层厚度及其对土壤酶活性影响规律,本研究仅选择表层土进行采样最为科学合理。
3个地点的海拔、坡度等地形因子和年平均温、降水量等气候因子存在一定差异,相关分析结果显示,不同小生境下酶活性受到环境因子的影响,影响程度各不相同。海拔对POD、蔗糖酶和SOD具有抑制作用,原因在于高海拔地区温度下降等因素降低了酶活性;坡度对酶活性影响较弱,土面和石沟酶活性受坡向影响,这与坡向不同致使阴坡阳坡阳光照射量不同有關,进而影响其他环境因子对酶活性的影响(张威巍等,2009);降雨有利于碳酸盐岩中的水循环,提高了碳酸盐岩的物质迁移速度和强度,水可增强底物与酶的扩散(Steinweg et al.,2013)。本研究中,年均降水量与土面小生境土壤的蔗糖酶和POD活性,石沟的蔗糖酶和SOD活性,以及石面小生境土壤的POD、蛋白酶和SOD活性具有显著负相关。石沟小生境的土壤CAT与8月降水量呈显著负相关,可能由于石沟汇集雨水后提升了土壤含水量,但超过了一定阈值,抑制了CAT(孙慧等,2016)。而石面小生境的土壤CAT活性与年均降水量显著正相关,这可能与石面土层浅,水分蒸发快有关。通常情况下,酶活性会随着温度升高而增加。本研究中,蔗糖酶、POD、蛋白酶和SOD酶活性与温度存在正相关,即受到温度升高的影响其酶活性的到增强;石面和石沟小生境下脲酶和CAT与温度负相关或显著负相关,与常态地貌研究(McDaniel et al.,2013)的结果不一致,可能与喀斯特石质生境的吸、散热能力等与常态地貌不同有关,其内在机制有待进一步研究。
3. 3 普定杜鹃花与生境土壤互作关系
普定杜鹃花是杜鹃花属植物极少分布于喀斯特石质山地的特异类群,揭示该种的石质生境适应机制对其种质资源创新利用具有深远意义。土面、石沟和石面是喀斯特小生境的典型类型,在土层厚度、水分、养分和温度等梯度的差异明显(严令斌,2020),研究3类小生境的土壤酶活性特征可为区域植被恢复和生境利用提供基础。SOD作为动植物细胞和微生物体内重要的抗氧化物酶,能有效清除生长过程新陈代谢产生的过氧化物及自由基,从而维持机体正常的生理平衡。本研究尝试测定SOD等胞外酶活性,为探讨其在土壤中的去向和特性提供参考。以土壤胞外酶活力的矢量特征表征的喀斯特区域土壤微生物代谢限制情况已有一定研究基础(孙彩丽等,2021),然而喀斯特小生境类型间的微生物代谢限制报道较少,从生态化学计量视角相互验证与揭示不同小生境内部和生境间的植物(叶片、枝条等)—枯落物(未分解、半分解与分解层)—土壤(酶、微生物)系统的氮磷限制有待深入。本研究选择典型喀斯特石质山地的圆果化香树+普定杜鹃花森林群落,初步论述了喀斯特小生境类型对土壤酶活性的影响特征,但未将土壤养分、pH和微生物等进行系统分析,未来有待深入研究。此外,实地调查发现基岩裸露(石沟、石面)生境地表覆盖少量的枯落物和苔藓层,基岩不裸露(土面)的生境地表覆盖大量的枯落物,其对不同生境的土壤养分、酶活性和微生物代谢有积极作用,可能是由于苔藓结皮延缓石质生境(石面、石沟)的土壤水分蒸散,并增加了土壤固持作用,通过生物岩溶作用改善裸岩生境,为草本—灌木—乔木物种的生长提供物质基础。苔藓植物岩溶作用已成为岩溶生态学研究的热点,但对苔藓植物岩溶作用对生境的改造(增加土壤酶活性、降低氮磷限制)等内在机制未被揭示。
4 结论
喀斯特生境土壤酶活性受小生境类型影响,土面小生境土壤的酶活性普遍高于石沟和石面。土壤酶活性变化一定程度解释特有种普定杜鹃花生长的喀斯特小生境异质性,研究结果为喀斯特乡土植物生态适应性和喀斯特植被恢复提供科学依据。
参考文献:
安明态. 2019. 喀斯特森林土壤水分和养分格局及其植物物种多样性维持机制研究[D]. 贵阳:贵州大学. [An M T. 2019. Studies on maintenance mechanism of plant species diversity and soil moisture and nutrient pattern in karst forest[D]. Guiyang: Guizhou University.]
曹慧,孙辉,杨浩,孙波,赵其国. 2003. 土壤酶活性及其对土壤质量的指示研究进展[J]. 应用与环境生物学报,9(1):105-109. [Cao H, Sun H, Yang H, Sun B, Zhao Q G. 2003. A review soil enzyme activity and its indication for soil quality[J]. Chinese Journal of Applied and Environmental Biology,9(1):105-109.] doi:10.3321/j.issn:1006-687X.2003.01.025.
陈洪松,聂云鹏,王克林. 2013. 岩溶山区水分时空异质性及植物适应机理研究进展[J]. 生态学报,33(2):317-326. [Chen H S,Nie Y P, Wang K L. 2013. Spatio-temporal heterogeneity of water and plant adaptation mechanisms in karst regions: A review[J]. Acta Ecologica Sinica,33(2):317-326.] doi:10.5846/stxb201112011836.
崔晓晓,王纪杰,罗惠宁,俞元春,梁关锋,周垂帆,王圳,张金池. 2011. 喀斯特峡谷区植被恢复过程中土壤酶活性的变化[J]. 南京林业大学学报(自然科学版),35(2):103-107. [Cui X X, Wang J J, Luo H N, Yu Y C, Liang G F, Zhou C F, Wang Z, Zhang J C. 2011. Variation of soil enzyme activities under different vegetation restoration stages in Karst gorge district[J]. Journal of Nanjing Forestry University(Natural Sciences Edition),35(2):103-107.] doi:10.3969/j.issn.1000-2006.2011.02.022.
符裕红, 黄宗胜, 喻理飞. 2012. 岩溶区典型根系地下生境类型中土壤酶活性研究[J]. 土壤學报,49(6):1202-1209. [Fu Y H, Huang Z S, Yu L F. 2012. Soil enzyme activities in type of root underground habitat typical of karst areas[J]. Acta Pedologica Sinica,49(6):1202-1209.]
符裕红,彭琴,李安定,黄宗胜. 2017. 黔中地区土壤酶活性对岩性的响应[J]. 湖北农业科学, 56(16): 3070-3073. [Fu Y H, Peng Q, Li A D, Huang Z S. 2017. Response of the soil enzyme activities to lithology in central area of Guizhou[J]. Hubei Agricultural Sciences,56(16):3070-3073.] doi:10.14088/j.cnki.issn0439-8114.2017. 16.017.
兰雪,戴全厚,喻理飞,杨智. 2009. 喀斯特退化森林不同恢复阶段土壤酶活性研究[J]. 农业现代化研究,30(5):620-624. [Lan X, Dai Q H, Yu L F, Yang Z. 2009. Soil enzyme activity of different restoration stages in karst degenerative forest[J]. Research of Agricultural Moderni-zation,30(5):620-624.] doi:10.3969/j.issn.1000-0275. 2009.05.025.
李安定,贾申,喻理飞. 2010. 贵州花江喀斯特峡谷区不同小生境的小气候环境[J]. 浙江林学院学报,27(3):374-378. [Li A D, Jia S, Yu L F. 2010. Microclimates of different microhabitats in Huajiang karst area[J]. Journal of Zhejiang A&F University,27(3):374-378.] doi:10.3969/j.issn.2095-0756.2010.03.009.
李安定,盧永飞,韦小丽,喻理飞. 2008. 花江喀斯特峡谷地区不同小生境土壤水分的动态研究[J]. 中国岩溶,27(1):56-62. [Li A D, Lu Y F, Wei X L, Yu L F. 2008. Studies on the regime of soil moisture under different microhabitats in Huajiang karst valley[J]. Carsologica Sinica,27(1):56-62.] doi:10.3969/j.issn.1001-4810.2008.01.010.
李丹,何腾兵,刘丛强,涂成龙,李广枝. 2008. 喀斯特山区土壤酶活性研究回顾与展望[J]. 贵州农业科学, 36(2): 87-90. [Li D, He T B, Liu C Q, Tu C L, Li G Z. 2008. Review and prospect on soil enzyme activity in karst mountain area[J]. Guizhou Agricultural Sciences, 36(2):87-90.] doi:10.3969/j.issn.1001-3601.2008.02.032.
廖全兰,龙翠玲,薛飞,熊玲. 2021. 茂兰喀斯特森林不同地形土壤酶与植物多样性的关系[J]. 东北林业大学学报,49(10):117-121. [Liao Q L, Long C L, Xue F, Xiong L. 2021. Effect of different terrains in Maolan karst forest on soil enzyme activity and plant diversity[J]. Journal of Northeast Forestry University,49(10):117-121.] doi:10.3969/j.issn.1000-5382.2021.10.020.
林娜,刘勇,李国雷,于海群. 2010. 森林土壤酶研究进展[J]. 世界林业研究,23(4):21-25. [Lin N, Liu Y, Li G L, Yu H Q. 2010. Research progress on forest soil enzyme[J]. World Forestry Research,23(4):21-25.] doi:10. 13348/j.cnki.sjlyyj.2010.04.003.
刘方,王世杰,罗海波,刘元生,刘鸿雁. 2008. 喀斯特森林生态系统的小生境及其土壤异质性[J]. 土壤学报,45(6):1055-1062. [Liu F, Wang S J, Luo H B, Liu Y S, Liu H Y. 2008. Micro-habitats in karst forest ecosystem and varibility of soils[J]. Acta Pedologica Sinica,45(6):1055-1062.] doi:10.3321/j.issn:0564-3929.2008.06.007.
刘捷豹,陈光水,郭剑芬,杨智杰,李一清,林成芳,杨玉盛. 2017. 森林土壤酶对环境变化的响应研究进展[J]. 生态学报,37(1):110-117. [Liu J B,Chen G S,Guo J F, Yang Z J, Li Y Q, Lin C F, Yang Y S. 2017. Advances in research on the responses of forest soil enzymes to environmental change[J]. Acta Ecologica Sinica,37(1):110-117.] doi:10.5846/stxb201608011581.
马洁怡,赵友朋,张金池,孟苗婧,刘胜龙. 2020. 凤阳山不同林分土壤腐殖质特征及影响因素[J]. 东北林业大学学报,48(1):62-67. [Ma J Y, Zhao Y P, Zhang J C, Meng M J, Liu S L. 2020. Soil humus characteristics and influencing factors of different stands in Fengyang Mountain[J]. Journal of Northeast Forestry University,48(1):62-67.] doi:10.13759/j.cnki.dlxb.2020.01.011.
潘复静,王克林,张伟,梁月明,靳振江,李臻. 2020. 喀斯特不同恢復阶段植物根际土养分和酶活性的季节性变化和根际效应[J]. 桂林理工大学学报,40(1):209-217. [Pan F J, Wang K L, Zhang W, Liang Y M, Jin Z J, Li Z. 2020. Seasonal changes and rhizosphere effects of soil nutrients and enzymatic activities in two vegetation successions of karst ecosystem[J]. Journal of Guilin University of Technology,40(1):209-217.] doi:10.3969/j.issn. 1674-9057.2020.01.027.
宋同清,王克林,曾馥平,彭晚霞,杜虎. 2015. 西南喀斯特植物与环境[M]. 北京:科学出版社. [Song T Q, Wang K L, Zeng F P, Peng W X, Du H. 2015. Plants and environment in karst areas of southwest China[M]. Beijing: Science Press.]
孙彩丽,王艺伟,王从军,黎庆菊,吴志红,袁东昇,张建利. 2021. 喀斯特山区土地利用方式转变对土壤酶活性及其化学计量特征的影响[J]. 生态学报,41(10):4140-4149. [Sun C L, Wang Y W, Wang C J, Li Q J,Wu Z H,Yuan D S,Zhang J L. 2021. Effects of land use conversion on soil extracellular enzyme activity and its stoichiometric characteristics in karst mountainous areas[J]. Acta Ecolo-gica Sinica,41(10):4140-4149.] doi:10.5846/stxb2020 07161864.
孙慧,张建锋,胡颖,王雷,陈光才. 2016. 土壤过氧化氢酶对不同林分覆盖的响应[J]. 土壤通报,47(3):605-610. [Sun H, Zhang J F, Hu Y, Wang L, Chen G C. 2016. Research on the responses of soil catalase to different stand covers[J]. Chinese Journal of Soil Science,47(3):605-610.] doi:10.19336/j.cnki.trtb.2016.03.15.
汤茜,丁访军,朱四喜,吴鹏,崔迎春,赵文君,侯贻菊. 2020. 茂兰喀斯特地区不同植被演替阶段对土壤化学性质与酶活性的影响[J]. 生态环境学报,29(10):1943-1952. [Tang Q, Ding F J, Zhu S X, Wu P, Cui Y C, Zhao W J, Hou Y J. 2020. Effects of different vegetative succession stages on soil chemical properties and enzyme activities in karst region of Maolan[J]. Ecology and Environmental Sciences,29(10):1943-1952.] doi:10.16258/j.cnki.1674-5906.2020.10.003.
王理德,王方琳,郭春秀,韩福贵,魏林源,李发明. 2016. 土壤酶学硏究进展[J]. 土壤,48(1):12-21. [Wang L D, Wang F L, Guo C X, Han F G, Wei L Y, Li F M. 2016. Review: Progress of soil enzymology[J]. Soils,48(1):12-21.] doi:10.13758/j.cnki.tr.2016.01.002.
魏翠翠,刘小飞,林成芳,李先锋,李艳,郑裕雄. 2018. 凋落物输入改变对亚热带两种米槠次生林土壤酶活性的影响[J]. 植物生态学报,42(6):692-702. [Wei C C, Liu X F, Lin C F, Li X F, Li Y, Zheng Y X. 2018. Response of soil enzyme activities to litter input changes in two secon-dary Castanopsis carlessii forests in subtropical China[J]. Chinese Journal of Plant Ecology,42(6):692-702.] doi:10.17521/cjpe.2017.0247.
薛飞,龙翠玲,廖全兰,熊玲. 2020. 喀斯特森林凋落物对土壤养分及土壤酶的影响[J]. 森林与环境学报,40(5):449-458. [Xue F, Long C L, Liao Q L, Xiong L. 2020. An analysis of litter,soil,stoichiometry,and soil enzymes in karst forest[J]. Journal of Forest and Environment,40(5):449-458.] doi:10.13324/j.cnki.jfcf.2020.05.001.
严令斌. 2020. 土壤微生物群落与植物功能性状对喀斯特小生境水热的响应机制[D]. 贵阳:贵州大学. [Yan L B. 2020. Response mechanism of soil microbial community and plant functional traits to ecological factors of water and heat in karst micro-habitats[D]. Guiyang: Guizhou University.]
杨万勤,王开运. 2004. 森林土壤酶的研究进展[J]. 林业科学,40(2):152-159. [Yang W Q, Wang K Y. 2004. Advances in forest soil enzymology[J]. Scientia Silvae Sinicae,40(2):152-159.] doi:10.3321/j.issn:1001-7488.2004.02.027.
俞国松,王世杰,容丽. 2011. 茂兰喀斯特森林演替阶段不同小生境的小气候特征[J]. 地球与环境,39(4):469-477. [Yu G S, Wang S J, Rong L. 2011. Microclimate characteris-tics of different microhabitats in successional stages of Maolan karst forest[J]. Earth and Environment,39(4):469-477.] doi:10.14050/j.cnki.1672-9250.2011.04.005.
喻理飞,朱守谦,叶镜中,魏鲁明,陈正仁. 2002. 退化喀斯特森林自然恢复过程中群落动态研究[J]. 林业科学,38(1):1-7. [Yu L F, Zhu S Q, Ye J Z, Wei L M, Chen Z R. 2002. Dynamics of a degraded karst forest in the process of natural restoration[J]. Scientia Silvae Sinicae,38(1):1-7.] doi:10.3321/j.issn:1001-7488.2002.01.001.
袁道先. 2001. 全球巖溶生态系统对比:科学目标和执行计划[J]. 地球科学进展,16(4):461-466. [Yuan D X. 2001. World correlation of karst ecosystems: Objectives and implementation plan[J]. Advances in Earth Science,16(4):461-466.] doi:10.3321/j.issn:1001-8166.2001.04.002.
张威巍,游雄,宋国民. 2009. 两种面向地貌晕渲的光照模型比较[J]. 测绘科学技术学报,26(2):153-156. [Zhang W W, You X, Song G M. 2009. Comparison of two relief shading oriented illumination models[J]. Journal of Geomatics Science and Technology,26(2):153-156.] doi:10.3969/j.issn.1673-6338.2009.02.020.
朱守谦. 2003. 喀斯特森林生态研究(Ⅲ)[M]. 贵阳:贵州科技出版社. [Zhu S Q. 2003. Ecological research on karst forest(Ⅲ)[M]. Guiyang: Guizhou Science and Technology Press.]
邹军,喻理飞,李媛媛. 2010. 退化喀斯特植被恢复过程中土壤酶活性特征研究[J]. 生态环境学报,19(4):894-898. [Zou J, Yu L F, Li Y Y. 2010. Study on soil enzyme activity characteristics during succession of degraded karst vegetation[J]. Ecology and Environmental Sciences,19(4):894-898.] doi:10.16258/j.cnki.1674-5906.2010. 04.029.
Alkorta I, Aizpurua A, Riga P, Albizu I, Amézaga I, Garbisu C. 2003. Soil enzyme activities as biological indicators of soil health[J]. Reviews on Environmental Health,18(1):65-73. doi:10.1515/reveh.2003.18.1.65.
Burns R G, DeForest J L, Marxsen J, Sinsabaugh R L, Stromberger M E, Wallenstein M D, Weintraub M N, Zoppini A. 2013. Soil enzymes in a changing environment: Current knowledge and future directions[J]. Soil Biology and Biochemistry, 58: 216-234. doi:10.1016/j.soilbio.2012.11.009.
Dai X Y, Yang C H, Yang B, Chen P, Ma Y P. 2020. A new species of Rhododendron(Ericaceae) from Guizhou, China[J]. PhytoKeys,146:53-59. doi:10.3897/phytokeys.146. 51342.
McDaniel M D, Kaye J P, Kaye M W. 2013. Increased temperature and precipitation had limited effects on soil extracellular enzyme activities in a post-harvest forest[J]. Soil Biology and Biochemistry,56:90-98. doi:10.1016/j.soilbio.2012.02.026.
Steinweg J M, Dukes J S, Paul E, Wallenstein M. 2013. Microbial responses to multi-factor climate change:Effects on soil enzymes[J]. Frontiers in Microbiology,4:146. doi:10.3389/fmicb.2013.00146.
Utobo E B, Tewari L. 2015. Soil enzymes as bioindicators of soil ecosystem status[J]. Applied Ecology and Environmental Research,13(1):147-169. doi:10.15666/aeer/1301_147169.
Yan L B, Zhang J L, Zhu S Y, Gao F, Yang Y Z, Huang Z S, Yu L F. 2019. Base on model experiment to study the effects of vertical space on the temperature of soil microhabitats in the process of karst rock desertification[J]. Applied Ecology and Environmental Research,17(6):15605-15614. doi:10.15666/aeer/1706_1560515614.
(責任编辑 邓慧灵)
——以贵阳花溪公园为例

