1株纤维素降解细菌的筛选及其对甘蔗叶的降解效果
史国英 曾泉 叶雪莲 马明亮 胡春锦


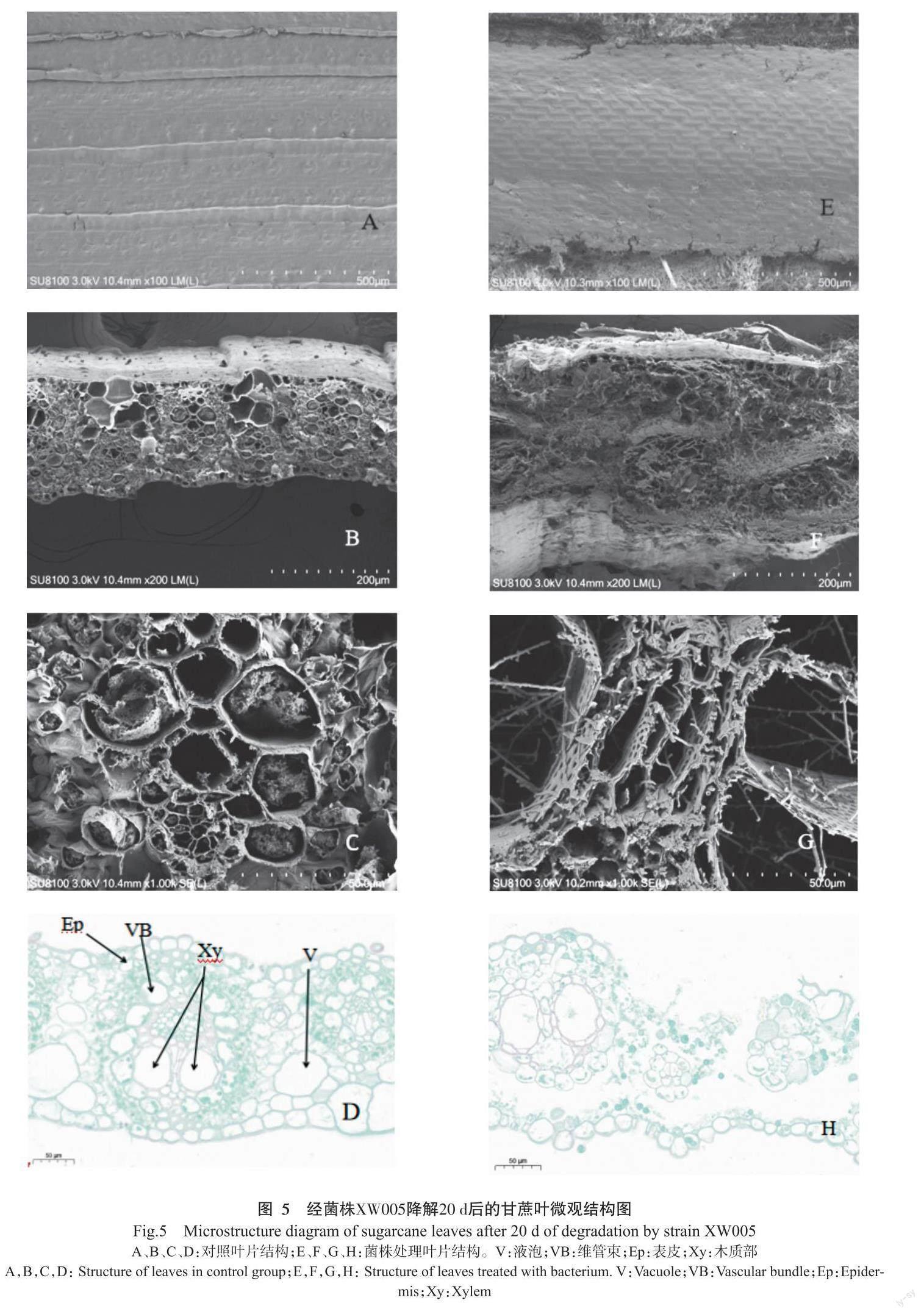
摘要:【目的】篩选对甘蔗叶有降解效果的细菌菌株,为其在蔗叶还田中的应用及甘蔗叶田间高效生物腐解剂和纤维素酶制剂产品的研发提供参考。【方法】用以甘蔗叶粉为唯一碳源的培养基对田间腐解甘蔗叶样品中的降解菌进行富集,通过刚果红培养基初筛和羧甲基纤维素酶(CMCase)活性测定复筛纤维素降解菌,结合形态特征和16S rDNA序列分析,明确筛选菌株的系统分类地位;分析经菌株发酵处理后甘蔗叶的失重率,利用透射电镜和扫描电镜观察甘蔗叶超微组织结构变化,明确菌株对甘蔗叶的降解效果。【结果】经过初筛和复筛,获得1株高效产CMCase菌株XW005,其纤维素酶活力为80.51 U/mL,经16S rDNA序列及系统发育分析,将XW005菌株鉴定为Brucella intermedia细菌(NCBI登录号:MW538324.1)。电镜观察甘蔗叶显微结构,发现经菌株发酵处理的甘蔗叶表皮层开裂,维管束和质膜解体,受损的叶片呈疏松状态,平坦表面受到破坏,致密结构变得松散。甘蔗叶降解试验结果表明,发酵处理20 d后,菌株处理的甘蔗叶失重率达45.09%。【结论】菌株XW005是1株具有降解纤维素能力的细菌,在常温条件下可对甘蔗叶进行有效降解,具有潜在的开发价值和良好的应用前景。
关键词:甘蔗叶;纤维素降解菌;Brucella intermedia;组织微结构
中图分类号:S646.099 文献标志码:A 文章编号:2095-1191(2023)02-0488-09
Abstract:【Objective】To screen bacteria with degradation effects on sugarcane leaves, and to provide reference for application of bacteria in sugarcane leaf returning and development of efficient biological decomposition agents and cellulase preparation products for sugarcane leaf in field. 【Method】Medium with sugarcane leaf powder as the only carbon source was used to enrich cellulose-degrading bacteria of sugarcane leaf decomposition in field. Cellulose-degrading bacteria were preliminarily screened using Congo red medium and rescreened via determination of carboxymethyl cellulose(CMCase) activity, and according to analysis of morphological characteristics and 16S rDNA sequences, systematic taxonomic classification position of the screened bacteria were made clear. Weight loss rate of sugarcane leaves after fermentation treatment was analyzed and transmission electron microscope and scanning electron microscope were used to observe the change of sugarcane leaf ultrastructure, so as to make clear effects of the strain on sugarcane leaf degradation. 【Result】Through preliminary screening and rescreening, a strain of CMCase-producing strain XW005 with cellulase activity of 80.51 U/mL was obtained. According to analysis of 16S rDNA gene sequence and phylogenetic analysis, XW005 strain was identified as bacterium Brucella intermedia(NCBI accession number: MW538324.1). Electron microscopic observation of sugarcane leaf microstructure showed that epidermis of sugarcane leaves under fermentation treatment of the strain cracked, while vascular bundles and plasma membrane disintegrated, the damaged leaves were loosened, the flat surface was destroyed, and the dense structure became loose. The results of sugarcane leaf degradation test showed that after 20 d of fermentation treatment, the weight loss rate of sugarcane leaves under the strain treatment reached 45.09%. 【Conclusion】XW005 is a bacterium capable of degrading cellulose and it can effectively degrade sugarcane leaves at room tempera-ture,which has potential of development and prospect for application.
Key words: sugarcane leaf; cellulose-degrading bacterium; Brucella intermedia; tissue microstructure
Foundation items:Guangxi Natural Science Foundation(2020GXNSFAA297096);Guangxi Science and Technology Plan Project(Guike AB18221048);Basic Research Project of Guangxi Academy of Agricultural Science(Guinongke 2021JM89,Guinongke 2021YT098)
0 引言
【研究意义】甘蔗作为制糖业的主要原料,广泛种植于我国广东、广西、云南、海南等热带亚热带地区。甘蔗为宿根多年生作物,生长期长,需肥量大,长期连作会消耗大量土壤养分,对地力的消耗高于其他作物,甚至引起营养元素失调(樊仙等,2014)。单一依赖化肥补偿土壤地力难以有效解决问题,还会造成甘蔗种植成本上升、蔗区土壤质量下降等一系列问题。研究表明,甘蔗叶中含有大量的碳、氮、磷、钾及微量元素,是一种数量多、可就地利用的优质有机肥源,蔗叶还田能改善土壤理化性状、保持土壤生产力,同时又能提高土壤微生物物种总数和群落多样性(赵丽萍,2014;张才芳,2019)。蔗叶还田是当前集约化、机械化生产的甘蔗产业发展的必然选择。然而,由于甘蔗叶含有大量的纤维素,在田间自然条件下很难降解。2016年之前,甘蔗叶大多在采收后直接进行焚烧处理。近年来,随着国家对环境保护的重视,已严禁进行秸秆焚烧。目前,每年有大量甘蔗叶弃于田间地头,不仅造成资源浪费,而且由于甘蔗叶在田间降解速度缓慢,不及时处理会严重影响新植蔗的耕整地、开沟和宿根蔗的破垄松蔸、培土等后续作业(樊保宁等,2020;葛畅等,2020)。筛选获得具有较好环境适应性的高效秸秆降解菌是利用外源微生物促进秸秆原位腐化的关键。从添加外源微生物促进甘蔗叶原位腐解角度筛选适合的甘蔗叶降解菌,开发新型甘蔗叶降解菌剂,促进甘蔗叶原位腐解,对我国糖料甘蔗叶的有效处理与利用及促进蔗糖产业持续发展均具有重要意义。【前人研究进展】近年来,研究人员已陆续分离得到一些对秸秆具有降解能力的微生物,包括细菌、真菌和放线菌。由于细菌繁殖快、发酵周期短,关于纤维素降解菌的研究已引起较多关注(李冠杰等,2015;贾辉等,2016)。自然界中广泛存在纤维素降解菌,特别是在一些降解菌较活跃的特定环境中,可分离获得能高效降解纤维素的微生物,如从腐烂秸秆、食草动物粪便、蚯蚓肠道及特定作物秸秆(胡海红等,2016;张蕴琦等,2017;王丽萍等,2018)、特定环境(王旭辉等,2017)和特定温度(黄亚丽等,2020;江高飞等,2020)中筛选获得纤维素降解菌。研究表明,添加外源微生物有利于缩短秸秆发酵时间。曲继松等(2019)研究表明,向枸杞枝条粉添加粗纤维降解菌、锯末专用复合益菌后,枸杞枝条粉堆体整体温度提升,在发酵周期内,其堆体内部温度超过50 ℃的时间达9 d,有助于加快基质化进程、缩短发酵时间、提高发酵效率。宋春丽(2019)研究发现,添加微生物菌剂能显著提高蔬菜废弃物堆肥温度、延长堆肥高温时间、加快有机物质分解、缩短堆肥发酵周期,添加微生物菌剂处理比未添加微生物菌剂处理完成发酵的时间缩短13 d;同时添加微生物菌剂可促进堆肥腐熟,降低堆肥产品对植物发芽和生长的不良影响。李雯等(2020)研究表明,玉米秸秆中添加纤维素降解菌X11-1(Luteimonas sp.)菌株,堆肥腐熟时间可提前5 d;Wang等(2022)研究发现,外源纤维素降解菌(ECDB)作為生物活性剂可促进玉米秸秆和牛粪混合堆肥中腐殖质的形成,提高玉米秸秆堆肥的效率和质量。【本研究切入点】目前已报道具有产纤维素酶活性的细菌种属较多(臧超群等,2018;Surachaia et al.,2020;Danso et al.,2021;Mohammadipour et al.,2021),但可培养秸秆降解菌种类不多,尤其是适合甘蔗叶腐解的功能菌鲜见报道。【拟解决的关键问题】用以甘蔗叶粉为唯一碳源的培养基对田间腐解甘蔗叶样品中的降解菌进行富集,通过刚果红培养基初筛和羧甲基纤维素酶(CMCase)活性测定复筛纤维素降解菌,结合形态特征和16S rDNA序列分析,明确筛选菌株的系统分类地位;分析经菌株发酵处理后甘蔗叶的失重率,电镜观察甘蔗叶超微组织结构变化,明确菌株对甘蔗叶的降解效果,为其在蔗叶还田中的应用及甘蔗叶田间高效生物腐解剂和纤维素酶制剂产品的研发提供参考。
1 材料与方法
1. 1 试验材料
样品来源:采集田间堆积腐烂的甘蔗叶装入封口袋中,封口,冷藏备用。
主要培养基:(1)纤维素降解菌富集培养基:K2HPO4 2.0 g,(NH4)2SO4 1.4 g,MgSO2·7H2O 0.3 g,CaCl2·2H2O 0.3 g,FeSO4·7H2O 5.0 mg,MnSO4·H2O 1.6 mg,ZnSO4 1.7 mg,甘蔗叶粉(过40目筛)2%,蒸馏水1000 mL;(2)甘蔗叶发酵培养基:去掉上述富集培养基中的蔗叶粉,加入尿素0.3 g/L,分装成150 mL/瓶,每瓶加入于80 ℃烘干至恒重的2~3 cm长蔗叶段5 g;(3)刚果红培养基、细菌纯化培养基、种子培养基、发酵产酶培养基参考马欣雨等(2020)的方法配制。
主要试剂:(NH4)2SO4、MgSO4·7H2O、K2HPO4、NaCl、CMC-Na、刚果红、CaCl2·2H2O、MgSO4·7H2O、ZnSO4和Tween-80(v/v)购自天津市大茂化学试剂厂;DNS试剂、琼脂、蛋白胨和酵母提取物购自北京索莱宝科技有限公司;DNA提取试剂盒及PCR反应试剂购自北京全式金生物技术有限公司。
主要仪器设备:PCR仪(北京东胜创新生物科技有限公司)、全温振荡培养箱(上海知楚仪器有限公司)、紫外分光光度计(上海元析仪器有限公司)、数显恒温水浴锅(常州国华电器有限公司)、H1850R 台式冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1. 2 试验方法
1. 2. 1 纤维素降解菌的富集培养 称取10 g样品,加入到装有100 mL富集培养基的三角瓶中,于28 ℃、180 r/min 摇床振荡培养5 d。吸取10 mL培养液转接至新的富集培养基中继续进行传代培养,重复以上操作,富集培养3代,进行下一步试验。
1. 2. 2 纤维素降解菌的初步筛选 量取1 mL第3代富集液加入9 mL灭菌水,连续稀释3次,取第3次的稀释液100 μL在刚果红纤维素培养基中涂布,于28 ℃下培养7 d,观察透明圈的有无及大小,将有明显透明圈的菌株接种到新的刚果红纤维素培养基上,连续点接纯化获得纯培养。用游标卡尺准确测定菌落直径(d)和透明圈直径(D),同时计算透明圈直径与菌落直径的比值(D/d)。选取D/d较大的菌株划线纯化4~5代后保存备用。
1. 2. 3 菌株复筛 将初筛得到的菌株接种至20 mL种子培养基中,28 ℃、150 r/min培养18 h,制成种子液。取1 mL种子液接入100 mL产酶发酵培养基中,28 ℃、150 r/min培养3 d,于4 ℃、5000 r/min条件下离心20 min,取上清液测定纤维素酶活性。纤维素酶活性的测定采用DNS法,以每分钟从底物溶液中分解产生1 μmol还原糖所需的酶量为1个酶活性单位(U)。
羧甲基纤维素酶(CMCase)测定:0.5 mL粗酶液与含1% CMC-Na的醋酸缓冲液(pH 4.8,0.1 mol/L)1.5 mL,放入≥25 mL刻度试管中,经50 ℃恒温水浴 30 min后,立即加入DNS 3 mL终止反应。随后将处理过的样品煮沸5 min,冷却至颜色稳定,加入去离子水或蒸馏水至25 mL,540 nm处测定吸光值。记录数据,计算纤维素酶活性。
葡萄糖标准曲线制作:称取100 mg分析纯无水葡萄糖,定容至100 mL。分别吸取上述溶液0、0.2、0.4、0.6、0.8、1.0、1.2和1.4 mL于干燥刻度试管中,补加蒸馏水至2.0 mL,再加3.0 mL DNS试剂,煮沸5 min后冷却,并定容至25 mL,540 nm处测定吸光值。以葡萄糖含量(mg)为横坐标,以吸光值为纵坐标,得到葡萄糖标准曲线方程为y=0.6963x-0.0224(R?=0.9991)。
1. 2. 4 菌株鉴定 菌株培养性状及菌落形态观察:以平板划线法将筛选菌株培养于NA培养基上,置于28 °C培养箱中培养2 d。观察并记录菌落的颜色、大小、形状。
菌株的16S rDNA序列分析:16S rDNA序列的扩增采用菌落PCR方法,培养供试菌株24 h,挑取少许菌落作为PCR模板。利用已报道16S rDNA序列通用引物27F(5'-AGAGTTTGATCCTGGCTCA-3'),1492R(5'-GGTTACCTTGTTACGACTT-3')进行扩增;扩增产物测序及菌株系统发育分析参照史国英等(2019)的方法进行。扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI进行BLAST同源性比对,并用MEGA 7.0构建菌株系统发育进化树,确定菌株的种属。
1. 2. 5 菌株对甘蔗叶的降解特性及降解能力测定 将筛选菌株接种至LB液体培养基培养48 h后,按1%接种量接种到发酵产酶培养液中,在恒温摇床上震荡培养72 h后,按2%接菌量将筛选菌株的菌液转接到甘蔗叶发酵培养液中,以加入未接菌的发酵产酶培养液为对照,每处理15瓶,28 ℃、150 r/min培养20 d。
甘蔗叶组织微结构观察:发酵第20 d时各处理随机取1瓶,选取有代表性的叶片进行微结构观察。参照滕尧等(2018)的方法制作石蜡切片,采用LEICA-DMLB型多功能生物显微镜观察和拍照,显微照片采用CaseViewer 2.4进行分析、标注;参照刘恺等(2020)的方法制备扫描电镜样品,采用HITACHI扫描电子显微镜观察和拍照采图。每处理样本组织采集3小块,制备20个切片。
甘蔗叶失重率测定:蔗叶降解过程中,每隔5 d取样(每处理随机取3瓶),分别用双层纱布过滤后于80 °C烘至恒重,称量后计算失重率。失重率(%)=(处理组蔗叶干重-对照组蔗叶干重)/对照组蔗叶干重×100。
1. 3 统计分析
利用Excel 2003和DPS 9.50进行数据处理和統计分析。
2 结果与分析
2. 1 纤维素降解菌初筛结果
通过富集培养、刚果红平板染色法初筛和菌株纯化,得到8株具有明显透明圈的菌株,分别命名为XW001~XW008,测定菌株的菌落直径(d)及其对应的透明圈直径(D),D/d比值在3.56~4.98(图1)。D/d比值可反映菌株纤维素酶活性的高低,比值越大,纤维素酶活性越高,菌株的纤维素降解能力越强。根据初步筛选结果,选择D/d比值较高的4株细菌XW001、XW002、XW005和XW007进行复筛试验。
2. 2 复筛菌株纤维素酶活性比较
进一步的复筛试验中,测定菌株XW001、XW002、XW005和XW007的纤维素酶活力,结果(图2)表明,XW005菌株的纤维素酶活性最高,达80.51 U/mL,与其他菌株的纤维素酶活性差异极显著(P<0.01),显示出良好的应用潜力。
2. 3 筛选菌株的分类鉴定结果
2. 3. 1 菌落培养性状 菌落的培养性状见图3。菌株XW005在NA固体培养基上的菌落呈乳白色、圆形、光滑凸起、边缘整齐、不产色素。
2. 3. 2 菌株XW005的16S rDNA序列分析及系统发育关系 将菌株XW005的16S rDNA序列在NCBI数据库进行在线同源比对,结果显示,该菌株与多株Brucella intermedia细菌的相似性在99%~100%。系统发育进化树结果(图4)显示,菌株XW005与已报道的B. intermedia(MK249656.1)自成一个分支,表明这2个菌株的亲缘关系最近。因此,将菌株XW005鉴定为B. intermedia细菌(NCBI登录号:MW538324.1)。
2. 4 筛选菌株对甘蔗叶的降解效果
通过扫描电镜观察甘蔗叶腐解的表面形态变化,结果显示,未接菌对照处理的甘蔗叶,其表面结构的蜡质层光滑规则,平整且致密,甘蔗叶结构较完整,紧密相连,纤维束均匀且伸展(图5-A、图5-B和图5-C),表皮层未受破坏,组织结构完整(图5-D);经菌株XW005处理后,甘蔗叶表皮出现分解孔洞,进而形成裂纹(图5-E),破坏严重的部位维管束解体成丝状结构,总体出现蓬松化(图5-F和图5-G),石蜡切片可观察到叶片的表皮细胞破裂,组织被破坏消解,呈松弛状态(图5-H)。
甘蔗叶发酵过程中每隔5 d采样1次,对比不同发酵时间的腐解情况,发现甘蔗叶先从四周切面处开始腐解,然后逐渐向叶片中间扩展,最后将整段叶片腐解成粉末状(图6)。测定发酵5~20 d的甘蔗叶失重率,结果显示,随着培养时间的延长,甘蔗叶失重率呈逐渐上升趋势;发酵至第20 d时,XW005菌株处理的甘蔗叶失重率达45.09%(图7)。
3 讨论
产纤维素酶菌株在自然界中分布广泛,利用选择性培养基对纤维素降解菌进行富集是筛选特定作物秸秆纤维降解微生物的常用方法。雷湘兰等(2017)以椰糠作为唯一碳源,从红树林土壤中分离出1株高产纤维素酶菌株,该菌株对椰糠的降解率达39.88%;张蕴琦等(2017)利用滤纸和水稻秸秆驯化出对滤纸纤维素和水稻秸秆纤维素均有较强降解能力的优势菌群,该菌群培养7 d时水稻秸秆的失重率达39.3%;孙美娜等(2018)以棉花秸秆为唯一碳源ISAM固体培养基对棉花秸秆纤维素降解菌菌株进行筛选,获得4株高效纤维素降解菌株,将筛选菌株接种到新鲜棉花秸秆进行培养,培养25 d的棉花秸秆失重率最高可达52.52%。为获得针对甘蔗叶有较强降解功能的菌株,本研究借鉴前人研究经验,选择以甘蔗叶为唯一碳源的培养基富集筛选纤维素降解菌,通过羧甲基纤维素—刚果红染色法及DNS法对菌株产CMCase能力进行定性和定量检测,有效提高了甘蔗叶纤维素降解菌的筛选效率;从腐烂的甘蔗叶中分离获得了具有产纤维素酶活性的Brucella属细菌菌株XW005,该菌株在28 ℃条件下产纖维素酶活性达80.51 U/mL。本研究结果进一步丰富了产纤维素细菌的菌种资源,同时为蔗叶还田提供了具有潜在应用前景的优良菌株。近年来国内外已有一些关于Brucella属细菌产纤维素酶特性的相关报道,如Behera等(2016)从印度马哈纳迪河三角洲的红树林土壤中分离出1株产纤维素酶Brucella属细菌,该菌株在以麦芽糖为碳源、酵母抽提物为氮源,发酵温度35 ℃下产酶活性为96.37 U/mL;Li等(2021)从新疆4种盐生植物中分离获得4株Brucella属细菌,其中有3株具有产纤维素酶活性;此外,有研究结果表明Brucella属细菌菌株PS4可降解乐果,同时促进植物在逆境和有利条件下生长(Ahmad et al.,2022)。然而,由于Brucella属细菌个别种是条件致病菌,可能会引发人类和动物疾病(顾晓英,2017;Guzmán-Verri et al.,2019),因此,对Brucella属细菌在农业上的应用还需保留谨慎态度。本研究获得的菌株XW005虽来源于甘蔗田间,但若要将菌株做为活体菌剂或含有活菌的微生态制剂直接应用,除要进一步验证菌株在田间对甘蔗叶的实际腐解效果外,还需对其环境安全性进行充分评价。
组织微结构观察可较直观地反映菌株对秸秆的腐解情况,从而判断其降解能力。本研究结果表明,接种XW005发酵液后,甘蔗叶由边缘开始腐解,结构被严重破坏,整体呈现断裂状的碎片状态且结构变得更加纤细化,出现大量条状裂纹,其腐解状态与李凌波等(2022)观察的绿色木霉对油菜秸秆腐解过程相似,区别在于真菌对秸秆的腐解过程中菌丝体进入秸秆组织内部,加大与秸秆的接触面,加剧秸秆断裂,加快秸秆腐解(朴哲等,2011;孙玲,2018)。XW005菌株的作用破坏了甘蔗叶表面最初的完整结构,形成一些小孔,凹陷的小孔表明细菌可水解秸秆并破坏其表面结构。马玲玲(2020)研究发现小麦秸秆在经过细菌预处理后,麦秆的表皮观察到类似现象。有研究表明,细菌进入秸秆组织后需氧细菌如嗜纤维菌(Cytophaga hutchinsonii)主要通过分泌单独的纤维素酶降解纤维素,而厌氧细菌如一些瘤胃细菌和热纤维梭菌(Clostridiumthermo cellum)通过产生纤维素多酶复合物降解纤维素(Wilson,2008)。本研究中,通过扫描电镜观察到甘蔗叶表面的结构变化,证明了菌株对甘蔗叶的降解作用,表明该菌株在甘蔗叶降解方面具有一定的研究开发潜力。由于甘蔗的收获季节气温偏低,后期将会进一步对XW005菌株在15~20 ℃条件下对甘蔗叶的降解效果及降解甘蔗叶过程中的产酶特性、菌株的环境驯化等方面开展研究,拟为菌株的实际应用提供科学支持。
4 结论
本研究获得的产纤维素酶菌株XW005来源于田间自然腐解的甘蔗叶,对蔗叶还田环境具有适应性优势;此外,菌株在常温条件下可对甘蔗叶进行有效降解,在甘蔗叶田间高效生物腐解剂及纤维素酶制剂产品的研发上具有良好的应用前景。
参考文献:
樊保宁,游建华,周秋惠. 2020. 我国糖料甘蔗叶有效处理与利用[J]. 中国糖料,42(1):77-80. [Fan B N,You J H,Zhou Q H. 2020. Effective treatment and utilization of sugarcane leaves in China[J]. Sugar Crops of China,42(1):77-80.] doi:10.13570/j.cnki.scc.2020.01.014.
樊仙,郭家文,张跃彬. 2014. 国内外甘蔗养分管理概况[J]. 中国糖料,(3):71-73. [Fan X,Guo J W,Zhang Y B. 2014. Progress of sugarcane at home and abroad nutrient management[J]. Sugar Crops of China,(3):71-73.] doi:10.13570/j.cnki.scc.2014.03.027.
葛畅,韦丽娇,李明,董学虎,牛钊君,黄伟华,陈小艳. 2020. 甘蔗叶还田技术正负效应研究[J]. 中国热带农业,(2):56-60. [Ge C,Wei L J,Li M,Dong X H,Niu Z J,Huang W H,Chen X Y. 2020. Study on positive and negative effects of sugarcane leaf returning technology[J]. China Tropical Agriculture,(2):56-60.] doi:10.3969/j.issn.1673- 0658.2020.02.014.
顾晓英. 2017. 2例非牧区布鲁氏菌感染致关节疼痛患者的护理[J]. 中西医结合护理,10(3):180-182. [Gu X Y. 2017. Nursing management of joint pain caused by Brucella sp. infection:With two case reports[J]. Nursing of Integrated Traditional Chinese and Western Medicine,10(3):180-182.] doi:10.11997/nitcwm.2017010057.
胡海红,孙继颖,高聚林,王振,包闹干朝鲁,胡树平,青格尔. 2016. 低温高效降解玉米秸秆复合菌系发酵条件优化及腐解菌剂的研究[J]. 农业环境科学学报,35(8):1602-1609. [Hu H H,Sun J Y,Gao J L,Wang Z,Bao N G C L,Hu S P,Qing G E. 2016. Optimization of fermentation conditions for low-temperature and high-efficiency composite microbial system for corn stover degradation and preliminary development of microbial inocula[J]. Journal of Agro-Environment Science,35(8):1602-1609.] doi:10. 11654/jaes.2016-0110.
黃亚丽,黄媛媛,马慧媛,徐炳雪,贾振华,宋水山,李再兴,贾素巧. 2020. 低温秸秆降解真菌的筛选及在秸秆还田中的应用[J]. 中国农学通报,36(21):53-60. [Huang Y L,Huang Y Y,Ma H Y,Xu B X,Jia Z H,Song S S,Li Z X,Jia S Q. 2020. Fungi with corn straw decomposing characterization at low-temperature:Screening and application in straw returning field[J]. Chinese Agricultural Science Bulletin,36(21):53-60.]
贾辉,陈秀蓉,芦光新,孔雅丽,杨成德. 2016. 纤维素降解细菌的筛选、生物学特性及降解效果[J]. 草业学报,25(3):60-66. [Jia H,Chen X R,Lu G X,Kong Y L,Yang C D. 2016. Isolation of cellulose-degrading bacteria and determination of their degradation activity[J]. Acta Prataculturae Sinica,25(3):60-66.] doi:10.11686/cyxb2014172.
江高飞,暴彦灼,杨天杰,郑海平,梅新兰,韦中,徐阳春,沈其荣. 2020. 高温秸秆降解菌的筛选及其纤维素酶活性研究[J]. 农业环境科学学报,39(10):2465-2472. [Jiang G F,Bao Y Z,Yang T J,Zheng H P,Mei X L,Wei Z,Xu Y C,Shen Q R. 2020. Screening of thermophilic cellulolytic bacteria and investigation of cellulase thermostability[J]. Journal of Agro-Environment Science,39(10):2465-2472.] doi:10.11654/jaes.2020-0958.
雷湘兰,沈振国,孙倩,郑金明. 2017. 一株椰糠纤维降解菌的分离、鉴定及特性研究[J]. 中国酿造,36(8):16-23. [Lei X L,Shen Z G,Sun Q,Zheng J M. 2017. Isolation,identification and characteristics of a coconut coir fiber-decomposing strain[J]. China Brewing,36(8):16-23.] doi:10.11654/jaes.2020-0958.
李冠杰,刘莹莹,甄静,王继雯,慕琦. 2015. 一株降解纤维素细菌的分离、鉴定及酶学性质分析[J]. 河南科学,(4):530-534. [Li G J,Liu Y Y,Zhen J,Wang J W,Mu Q. 2015. Isolation,identification of a cellulose-degrading bacterium and analysis the properties of its enzyme[J]. Henan Science,(4):530-534.]
李凌波,许欢欢,夏燕维,郭传旭,杨明珠,马磊,缪有志,刘东阳,张瑞福. 2022. 油菜秸秆高效降解菌的筛选及其双功能纤维素酶性质研究[J]. 南京农业大学学报,45(4):711-720. [Li L B,Xu H H,Xia Y W,Guo C X,Yang M Z,Ma L,Miao Y Z,Liu D Y,Zhang R F. 2022. Scree-ning of efficient degradation fungi of rape straw and pro-perties of its bifunctional cellulase[J]. Journal of Nanjing Agricultural University,45(4):711-720.] doi:10.7685/jnau.202111024.
李雯,刘艳薇,李停锋,郭君钰,顾欣,孙权,王锐. 2020. 不同纤维素降解菌对玉米秸秆的降解效果[J]. 生态环境学报,29(2):402-410. [Li W,Liu Y W,Li T F,Guo J Y,Gu X,Sun Q,Wang R. 2020. Effects of different cellulose-degrading microorganism on corn straw degradation[J]. Ecology and Environmental Sciences,29(2):402-410.] doi:10.16258/j.cnki.1674-5906.2020.02.023.
刘恺,密玲煜,刘玲玲,李洋. 2020. 不同扫描电镜制样方法观察棉花叶片气孔[J]. 生命科学研究,24(4):293-300. [Liu K,Mi L Y,Liu L L,Li Y. 2020. Different SEM sample preparation methods to observe the stomata of cotton leaves[J]. Life Science Research,24(4):293-300.] doi:10.16605/j.cnki.1007-7847.2020.04.006.
马玲玲. 2020. 纤维素降解细菌B. subtilis 1AJ3的纤维素酶的克隆表达、协同作用及其应用研究[D]. 杨凌:西北农林科技大学. [Ma L L. 2020. Cloning,expression,synergy and application of cellulases from celluloytic bacterium B. subtilis 1AJ3[D]. Yangling:Northwest A & F University.]
马欣雨,孙丽娜,卢珊,何鹏,周一平,刘星邑. 2020. 秸秆降解菌的筛选及对秸秆的降解效果[J]. 生态学杂志,39(4):1198-1205. [Ma X Y,Sun L N,Lu S,He P,Zhou Y P,Liu X Y. 2020. Screening of straw degrading microbial strains and their degradation effects[J]. Chinese Journal of Ecology,39(4):1198-1205.] doi:10.13292/j.1000-4890.202004.012.
樸哲,李玉敏,马帅,陈德莹,梅丽娟,殷士学. 2011. 堆肥制作中微生物侵染秸秆的环境扫描电镜(ESEM)观察[J]. 生态与农村环境学报,27(5):98-100. [Pu Z,Li Y M,Ma S,Chen D Y,Mei L J,Yin S X. 2011. Environmental scanning electron microscope(ESEM)observation of microbial colonization process in straw composting[J]. Journal of Ecology and Rural Environment,27(5):98-100.] doi:10.3969/j.issn.1673-4831.2011.05.018.
曲继松,张丽娟,朱倩楠,田永强,高丽红. 2019. 微生物菌剂对枸杞枝条粉发酵堆体腐熟效果的影响[J]. 环境科学研究,32(2):332-339. [Qu J S,Zhang L J,Zhu Q N,Tian Y Q,Gao L H. 2019. Effect of microbial inoculum on the humification degree of Lycium barbarum L.branches powder substrate fermentation[J]. Research of Environmental Sciences,32(2):332-339.] doi:10.13198/j.issn.1001-6929.2018.08.19.
史国英,曾泉,农泽梅,叶雪莲,岑贞陆,李杨瑞,胡春锦. 2019. 一株高效甘蔗内生固氮菌NN08200的鉴定及其对甘蔗的促生长作用[J]. 微生物学通报,46(6):1336-1345. [Shi G Y,Zeng Q,Nong Z M,Ye X L,Cen Z L,Li Y R,Hu C J. 2019. Identification of an endophytic nitrogen-fixing bacterium NN08200 from sugarcane and its growth promotion of sugarcane[J]. Microbiology China,46(6):1336-1345.] doi:10.13344/j.microbiol.china.180523.
宋春丽. 2019. 蔬菜废弃物堆肥化技术研究[J]. 农学学报,9(9):40-44. [Song C L. 2019. Study on composting tech-niques of vegetable wastes[J]. Journal of Agriculture,9(9):40-44.]
孙玲. 2018. 秸秆降解菌的筛选及促腐菌剂的应用探究[D]. 长春:吉林农业大学. [Sun L. 2018. Screening of straw degrading bacteria and application of microbial inoculum[D]. Changchun:Jilin Agricultural University.]
孙美娜,张凡凡,王永强,魏晓燕,鲁建江. 2018. 棉花秸秆纤维素降解菌的筛选鉴定与降解棉秆效果研究[J]. 新疆农业科学,55(1):72-75. [Sun M N,Zhang F F,Wang Y Q,Wei X Y,Lu J J. 2018. Screening and identification of cellulolytic strains from cotton straw and its effect on degradation of cotton stalk[J]. Xinjiang Agricultural Scien-ces,55(1):72-75.] doi:10.6048/j.issn.1001-4330.2018. 01.003.
滕堯,李安定,郝自远,张洪亮,张丽敏,蔡国俊. 2018. 西番莲解剖结构特征及低温胁迫下叶片结构与抗寒性的关系[J]. 浙江农业学报,30(11):1849-1858. [Teng Y,Li A D,Hao Z Y,Zhang H L,Zhang L M,Cai G J. 2018. Anatomical structure of Passiflora caerulea L. and relationship between leaf structure and cold resistance under low temperature stress[J]. Acta Agriculturae Zhejiangensis,30(11):1849-1858.] doi:10.3969/j.issn.1004-1524.2018.11.07.
王丽萍,李菊馨,黄显雅,吴耿寰,谢红辉. 2018. 6株纤维素降解细菌菌株的分离及其酶活性比较[J]. 农业研究与应用,31(1):5-8. [Wang L P,Li J X,Huang X Y,Wu G H,Xie H H. 2018. Isolation and enzyme activity compari-son of six cellulose decomposing bacteria strains[J]. Agri-cultural Research and Application,31(1):5-8.] doi:10. 3969/j.issn.2095-0764.2018.01.002.
王旭辉,叶凯,徐鑫,山其米克,王卉,李冠,邓宇. 2017. 耐盐纤维素降解菌的筛选、鉴定及其配比优化的研究[J]. 新疆农业科学,54(12):2282-2292. [Wang X H,Ye K,Xu X,Shanqimike,Wang H,Li G,Deng Y. 2017. Study on the isolation,identification of salt-tolerant cellulose-degra-ding strains and optimization of its strain ratio[J]. Xinjiang Agricultural Sciences,54(12):2282-2292.] doi:10.6048/j.issn.1001-4330.2017.12.016.
臧超群,白元俊,宋飞,谢瑾卉,林英,梁春浩. 2018. 苍白杆菌SY286菌株纤维素酶基因的克隆与表达[J]. 沈阳农业大学学报,49(3):279-285. [Zang C Q,Bai Y J,Song F,Xie J H,Lin Y,Liang C H. 2018. Cloning and expression of a cellulase gene from Ochrobactrum sp. SY286[J]. Journal of Shenyang Agricultural University,49(3):279-285.] doi:0.3969/j.issn.1000-1700.2018.03.004.
张才芳. 2019. 蔗叶还田深度和生物表面活性剂对土壤养分和微生物群落的影响[D]. 福州:福建农林大学. [Zhang C F. 2019. Effects of sugarcane leaves amendments to different soil depth and biosurfactant on soil nutrition and microbial community[D]. Fuzhou:Fujian Agriculture and Forestry University.
张蕴琦,徐凤花,张书敏,吴优,张晴. 2017. 水稻秸秆降解菌系的筛选及其菌群组成分析[J]. 江苏农业科学,45(8):257-260. [Zhang Y Q,Xu F H,Zhang S M,Wu Y,Zhang Q. 2017. Screening of rice straw degradation bacteria and analysis of its microbial composition[J]. Jiangsu Agricultural Sciences,45(8):257-260.] doi:10.15889/j.issn.1002-1302.2017.08.069.
赵丽萍. 2014. 蔗叶还田对土壤理化性状、生态环境及甘蔗产量的影响[J]. 土壤通报,45(2):500-507. [Zhao L P. 2014. Effect of trash returning on physical and chemical properties of soil,ecological environment and yields of sugarcane[J]. Chinese Journal of Soil Science,45(2):500-507.] doi:10.19336/j.cnki.trtb.2014.02.041.
Ahmad S,Chaudhary H J,Damalas C A. 2022. Microbial detoxification of dimethoate through mediated hydrolysis by Brucella sp. PS4:Molecular profiling and plant growth-promoting traits[J]. Environmental Science and Pollution Research International,29(2):2420-2431. doi:10.1007/s 11356-021-15806-1.
Behera B C,Mishra R R,Singh S K,Dutta S K,Thatoi H. 2016. Cellulase from Bacillus licheniformis and Brucella sp. isolated from mangrove soils of Mahanadi river delta,Odisha,India[J]. Biocatalysis and Biotransformation,34(1):790-800. doi:10.1080/10242422.2016.1212846.
Danso B,Ali S S,Xie R R,Sun J Z. 2021. Valorisation of wheat straw and bioethanol production by a novel xylanase-and cellulase-producing Streptomyces strain isolated from the wood-feeding termite,Microcerotermes species[J]. Fuel,310:122333. doi:10.1016/j.fuel.2021.122333.
Guzmán-Verri C,Suárez-Esquivel M,Ruiz-Villalobos N,Zygmunt M S,Gonnet M,Campos E,Víquez-Ruiz E,Chacón-Díaz C,Aragón-Aranda B,Conde-Alvarez R,Moriyón I,Blasco J M,Mu?oz P M,Baker K S, Thomson N R,Cloeckaert A,Moreno E. 2019. Genetic and phenotypic characterization of the etiological agent of canine orchiepididymitis smooth Brucella sp. BCCN84.3[J]. Frontiers in Veterinary Science,6:175. doi:10.3389/fvets.2019.00175.
Li L,Gao L,Liu Y H,Fang B Z,Huang Y,Mohamad O A A,Egamberdieva D,Li W J,Ma J B. 2021. Diversity of cultivable endophytic bacteria associated with halophytes in Xinjiang of China and their plant beneficial traits[J]. Journal of Arid Land,13(8):790-800. doi:10.1007/s13205- 019-1678-8.
Mohammadipour Z,Enayatizamir N,Ghezelbash G,Moezzi A. 2021. Bacterial diversity and chemical properties of wheat straw-based compost leachate and screening of cellulase producing bacteria[J]. Waste and Biomass Valorization,12(3):1293-1302. doi:10.1007/s12649-020-01119-w.
Surachaia R,Apisitb S,Thanatipc S. 2020. Pseudomonas stutzeri CM1,novel thermotolerant cellulase-producing bacteria isolated from forest soil[J]. Pakistan Journal of Biological Sciences,23(10):1345-1350. doi:10.3923/pjbs. 2020.1345.1350.
Wang X G,Tian L,Li Y X,Zhong C,Tian C J. 2022. Effects of exogenous cellulose-degrading bacteria on humus formation and bacterial community stability during composting[J]. Bioresource Technology,395:127458. doi:10.1016/j. biortech.2022.127458.
Wilson D B. 2008. Three microbial strategies for plant cell wall degradation[J]. Annals of the New York Academy of Sciences,1125:289-297. doi:10.1196/annals.1419.026.
(責任编辑 王 晖)

