miR-146b-3p 通过靶向结合LCN1 抑制肺鳞癌生物学行为
丁晓霞,刘亚群,于小纬,杨 楠,张悦琪(河北北方学院附属第一医院呼吸与危重症监护室,河北 张家口 075000)
肺癌是导致癌症患者死亡的重要原因,肺鳞癌是常见的肺癌亚型之一,其化疗和放疗敏感性较低[1-2]。由于肺鳞癌容易发生转移,并且目前缺乏有效的诊断性生物标志物,确诊时患者往往已处于中晚期,导致患者预后较差[3-4]。因此,积极寻找用于肺鳞癌诊断和预后预测的生物标志物至关重要。微小RNA(microRNA,miRNA)是一类不具有编码能力的小分子RNA,在基因转录中发挥重要作用,参与细胞增殖、迁移、侵袭和凋亡等生物行为学过程[5-6]。脂质运载蛋白1(lipocalin-1,LCN1) 能够间接导致肺组织基质降解增加,造成肺组织结构重塑,使病情加重。miRNA 可长期稳定存在,且其异常表达会影响肿瘤的发生发展[7-8]。miRNA 既可以发挥抑癌作用,也可以发挥促癌作用,并且在多数人类恶性肿瘤中异常表达[9-10]。有研究显示,miR-146b-3p 可作为诊断非小细胞肺癌的重要标志物[11]。还有研究显示,miR-146a 在肺鳞癌组织中表达下调,其异常表达能抑制肺鳞癌细胞的迁移和侵袭[12]。基于这些研究结果,我们推测miR-146b-3p可能在肺癌中发挥重要作用。本研究探讨miR-146b-3p差异表达对肺鳞癌细胞生物学行为的影响,并初步分析其可能的作用机制,以期为肺鳞癌的治疗提供理论依据。
1 材料与方法
1.1 细胞、试剂与仪器
NCI-H226、NCI-H2170 细胞株购于中国科学院上海生命科学研究院细胞资源中心;RPMI 1640培养基、AnnexinV-FITC 凋亡检测试剂盒购于上海经科化学科技有限公司;胎牛血清购于爱必信(上海)生物科技有限公司;细胞计数仪购于Invitrogen 有限公司;RNA 提取试剂TRIzol 及转染试剂Lipofectamine 2000 均购自南京森贝伽生物科技有限公司;逆转录试剂盒Prime-ScriptTMRT Master Mix 购自上海妍琦生物科技有限公司,PCR 试剂盒Quanti Fast SYBR Green PCR Kit 购自武汉极捷生物科技有限公司;BCA 蛋白浓度测定试剂盒、SDS-PAGE 凝胶配制试剂盒购自北京伊塔生物科技有限公司;CCK-8 试剂盒购自上海吉至生化科技有限公司;BCL2、BAX、CCNB1、CDK2 多克隆抗体、LCN1多克隆抗体以及HRP 标记的羊抗兔免疫球蛋白G(H+L)二抗购自上海科敏生物科技有限公司;双荧光素酶报告基因系统试剂盒购自成都安森盛源科技有限公司;ST-360 型酶标仪购自上海晚成医疗器械有限公司;细胞周期试剂盒购于杭州联科生物技术股份有限公司;ELx808 酶标仪购自北京泽平科技有限责任公司;FACS VantageTM流式细胞仪购自南京华奥生物医药技术有限公司。
1.2 生物信息学分析
通过TCGA 在线数据库下载肺鳞癌临床样本数据,比较miR-146b-3p、LCN1在癌旁组织与肺鳞癌组织中的表达情况,并分析LCN1 与肺鳞癌患者临床表型的关系。使用Kaplan-Meier Plotter 数据库评估LCN1 mRNA水平对肺鳞癌患者总生存期的影响。利用Star-Base 数据库在线预测靶基因数据库预测miR-146b-3p的靶基因。
1.3 细胞培养
将NCI-H226、NCI-H2170 细胞接种至含10%胎牛血清的RPMI 1640 培养基,在37 ℃、5%CO2饱和湿度条件下培养,待细胞贴壁生长,胰酶消化液消化后传代培养,实验取对数生长期细胞。
1.4 RT-PCR检测miR-146b-3p表达
采用TRIzol 法提取细胞或组织中的总RNA,采用紫外分光光度计法测定RNA 的浓度。按TaqMan©MicroRNA Reverse Transcription kit 逆转录试剂盒说明书以RNA 为模板进行逆转录获得cDNA 并置于4 ℃保存,进行荧光定量PCR 扩增,反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火45 s,65 ℃延伸1 min,4 ℃ 10 min,扩增40个循环。以β-actin 为内参,miR-146b-3p 上 游 引 物 序 列 :5′-CCTGGCA CTGAGAACTGAAT-3′,下游序列:5′-GCACCAGAA CTGAGTCCACA-3′;β-actin 上游引物序列:5′-CATC CCTTCTCCCCACACAC-3′,下游序列:5′-AGTCCCAG GGCTTTGATTTG-3′。以2-ΔΔCt法计算miR-146b-3p 的相对表达水平。
1.5 构建miR-146b-3p过表达细胞模型
将对数生长期的NCI-H2170 和NCI-H226 细胞分为miR-NC 组和miR-146b-3p 组,根据Lipofectamine 2000 说明书分别转染miR-146b-3p NC 和miR-146b-3p质粒,24 h后更换完全培养基。采用G418筛选出能够稳定过表达miR-146b-3p的NCI-H2170和NCI-H226细胞系。采用RT-PCR 检测miR-146b-3p 水平以评估转染效率。
1.6 构建LCN1敲低细胞模型
将对数生长期的NCI-H2170 和NCI-H226 细胞分为shNC 组、shLCN1 1#组、shLCN1 2#组和miR-146b-3p+LCN1 组,并根据Lipofectamine 2000 说明书分别转染shNC、shLCN1 1#、shLCN1 2#质粒,24 h 后更换完全培养基。用嘌呤霉素筛选出稳定敲低LCN1 的NCI-H2170 和NCI-H226 细胞系。采用Western blot 检测LCN1 蛋白水平以评估转染效率,筛选稳定质粒构建miR-146b-3p+LCN1 组(共转染miR-146b-3p+LCN1 2#质粒)。
1.7 细胞增殖实验
将miR-NC 组、miR-146b-3p 组、shNC 组、shLCN1 1#组、shLCN1 2#组和miR-146b-3p+LCN1 组细胞置于CO2培养箱中培养24 h,分别于0、1、2、3、4、5 d 时对细胞增殖活性进行检测。每孔加入CKK-8 10 μL,在37 ℃、5%CO2的培养箱中继续培养1 h,随后用酶标仪测定450 nm波长处的光密度(optical density,OD)值。
1.8 细胞克隆实验
将miR-NC 组、miR-146b-3p 组、shNC 组、shLCN1 1#组、shLCN1 2#组和miR-146b-3p+LCN1 组细胞分别接种到6 孔板中,并轻轻转动,使细胞分散均匀。用PBS 清洗3 次,再用40 g/L 多聚甲醛固定20 min。结晶紫染色液染色,光学显微镜下观察细胞集落。
1.9 细胞周期实验
将miR-NC 组、miR-146b-3p 组、shNC 组、shLCN1 1#组、shLCN1 2#组和miR-146b-3p+LCN1 组细胞以1×105个/孔的密度接种于6 孔板,消化离心,弃去上清液,收集细胞团块,PBS 重悬细胞,离心,清洗1 次,振荡,使细胞沉淀充分分散,先加入300 μL、4 ℃预冷PBS,再将上样管置于涡旋振荡器上振荡,加700 μL、4 ℃预冷的纯乙醇沉悬,4 ℃固定过夜。第2天,离心弃去上清液,PBS洗1次,加500 μL PI染液,室温避光孵育15 min,上流式细胞仪检测,用Flowjo 软件分析细胞周期时相分布。
1.10 细胞凋亡实验
取miR-NC 组、miR-146b-3p 组、shNC 组、shLCN1 1#组、shLCN1 2#组和miR-146b-3p+LCN1 组细胞进行消化、离心、重悬。将细胞接种于6 孔板内并置于37 ℃、5%CO2的培养箱中培养24 h。以1 500 r/min 离心10 min 去除上清液。加入5 μL AnnexinV-FITC 混匀,再加入5 μL PI混匀,随后室温下避光孵育15 min。采用流式细胞仪检测细胞凋亡情况。
1.11 双荧光素酶报告实验
构建野生型报告基因载体LCN1-WT 与突变型报告基因载体LCN1-MT,将载体分别与miR-NC 或miR-146b-3p 共转染到肺鳞癌细胞中。置于37 ℃、5%CO2培养箱继续培养48 h,用双荧光素酶检测试剂盒测量各组细胞中的荧光素酶活性。
1.12 裸鼠移植瘤实验
16 只裸鼠购自成都达硕实验动物有限公司,动物生产许可证号:SCXK(川)2020-030,在标准环境中饲养,自由采食饮水。将小鼠分为对照组和观察组,每组8 只,对照组裸鼠于右侧腹股沟皮下注射0.2 m L(1×107/mL)转染miR-NC 的NCI-H2170 细胞悬液,观察组裸鼠于右侧腹股沟皮下注射0.2 mL(1×107/mL)已转染miR-146b-3 的NCI-H2170 细胞悬液。待成瘤后,每2 d 用微米卡尺测量肿瘤体积,于第2 周末处死小鼠,剥离移植瘤并称重,RT-PCP 检测移植瘤组织中miR-146b-3p的表达。
1.13 Western blot检测
收集miR-NC组、miR-146b-3p组、shNC组、shLCN1 1#组、shLCN1 2#组、miR-146b-3p+LCN1组对数生长期的NCI-H2170 和NCI-H226 细胞,加入SDS Loading buffer,沸水浴中煮沸10 min,电泳后转至PVDF 膜,用5%脱脂牛奶室温封闭1 h。加入用封闭液稀释的抗体(1∶5 000),4 ℃孵育过夜。次日PBS 洗涤6 min,重复3 次,然后加入封闭液稀释的HRP 标记的羊抗兔二抗(1∶1 000),室温孵育60 min,PBS 洗涤6 min,重复3 次,ECL 化学发光液进行显影,以β-actin 作为内参,利用BCA 蛋白检测试剂盒检测蛋白浓度,具体操作遵照试剂盒说明书进行。
1.14 统计学处理
数据采用SPSS 17.0 软件进行统计学处理,计量资料以均数±标准差(±s)表示,2 组间的表达差异采用t检验分析,多组间比较采用单因素方差分析。Kaplan-Meier生存曲线分析患者总生存期。P<0.05 表示差异具有统计学意义。
2 结果
2.1 miR-146b-3p 过表达抑制肺鳞癌细胞增殖、促进凋亡
GEO数据库分析显示,肺鳞癌组织中miR-146b-3p表达水平明显低于癌旁组织(P<0.05)。RT-PCR 实验结果显示,miR-146b-3p 组中miR-146b-3p 表达明显高于miR-NC 组(P<0.05)。细胞增殖实验结果显示,与miR-NC 组相比,miR-146b-3p 组增殖能力明显降低(P<0.05)。细胞克隆实验结果显示,与miR-NC 组相比,miR-146b-3p 组克隆细胞数明显减少(P<0.05)。细胞周期实验结果显示,与miR-NC组相比,miR-146b-3p组G0/G1 期细胞数明显增加(P<0.05),S 期细胞数明显减少(P<0.05)。细胞凋亡实验结果显示,与miRNC 组相比,miR-146b-3p 组细胞凋亡率明显增高(P<0.05)。Western blot结果显示,与miR-NC组相比,miR-146b-3p 组细胞BCL2、CCNB1 和CDK2 蛋白减少(P<0.05),BAX蛋白增加(P<0.05),见图1。
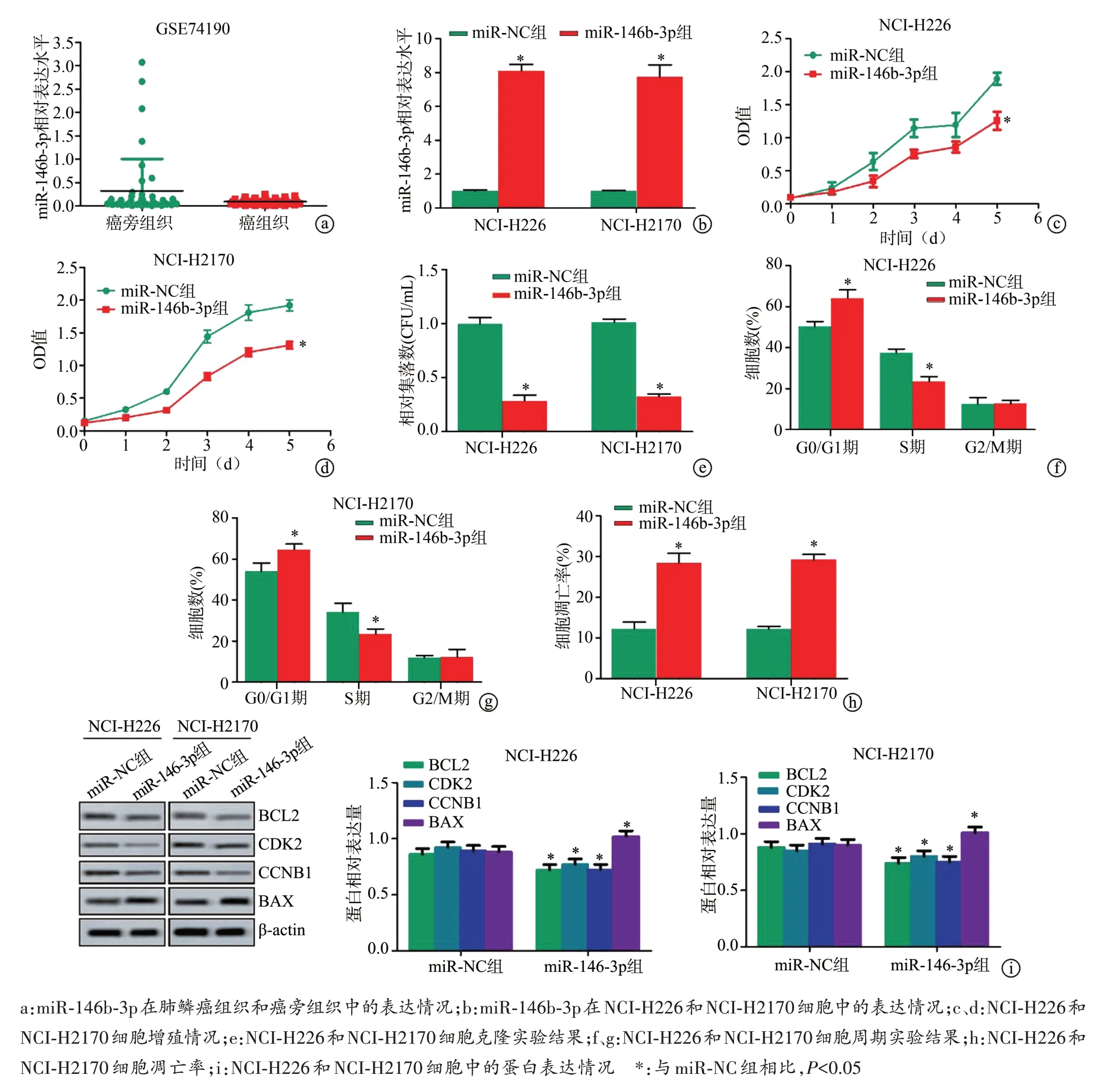
图1 miR-146b-3p抑制肺鳞癌细胞增殖并促进其凋亡
2.2 miR-146b-3p过表达抑制移植瘤生长
裸鼠移植瘤实验结果显示,观察组移植瘤体积(468.57±50.63)mm3和体质量(0.38±0.04)g明显小于对照组的体积(287.91±50.63)mm3和体质量(0.19±0.02)g(P<0.05)。随着时间的推移,移植瘤体积不断增大,但是观察组的增长速度明显慢于对照组(P<0.05)。RT-PCR 结果显示,在裸鼠移植瘤组织中,观察组中miR-146b-3p mRNA 相对表达量明显高于对照组(P<0.05),见图2。
2.3 miR-146b-3p与LCN1的靶向关系
生物信息学分析结果表明,miR-146b-3p 序列3′-UTR 区与LCN1 存在结合位点。双荧光素酶报告实验显示,miR-146b-3p mimic 与LCN1-WT 共转染致荧光素酶活性降低(P<0.05)。Western blot 和RTPCR实验结果显示,与miR-NC组相比,miR-146b-3p组中LCN1 mRNA 和蛋白表达水平明显降低(P<0.05),见图3。

图3 miR-146b-3p与LCN1的靶向关系
2.4 LCN1 在肺鳞癌不同临床特征患者癌组织中的表达水平
TCGA 数据库分析显示,肺鳞癌组织中LCN1 表达高于癌旁组织(P<0.05),M1 期患者LCN1 表达高于M0 期患者(P<0.05),预后不良患者LCN1 表达高于预后良好患者(P<0.05),LCN1 高表达患者总生存率明显低于LCN1低表达患者(P<0.05),见图4。
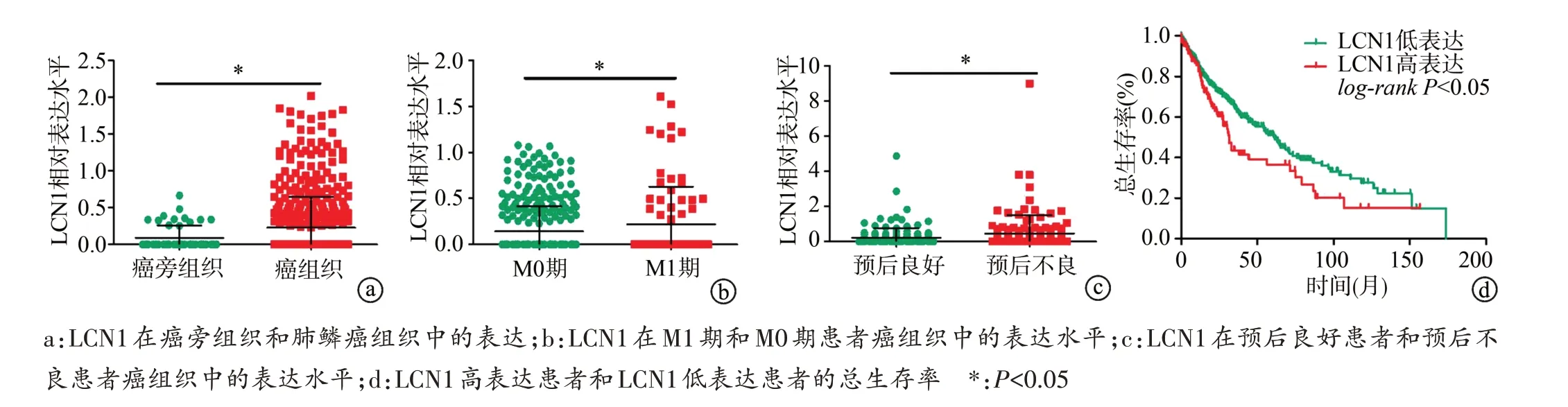
图4 LCN1在肺鳞癌不同临床特征患者癌组织中的表达水平
2.5 敲低LCN1表达抑制肺鳞癌细胞增殖并促进其凋亡
Western blot 实验结果显示,与shNC 组相比,shLCN1 1#组和shLCN1 2#组中LCN1 蛋白表达明显降低(P<0.05)。细胞增殖实验结果显示,与shNC组相比,shLCN1 1#组和shLCN1 2#组中细胞增殖能力降低(P<0.05)。细胞克隆实验结果显示,与shNC 组相比,shLCN1 1#组和shLCN1 2#组中克隆细胞数明显减少(P<0.05)。细胞周期实验结果显示,与shNC组相比,shLCN1 1#组和shLCN1 2#组G0/G1 期细胞数明显增加,S 期细胞数明显减少(P<0.05)。细胞凋亡实验结果显示,与shNC 组相比,shLCN1 1#组和shLCN1 2#组中凋亡率明显增高(P<0.05),见图5。

图5 敲低LCN1表达抑制肺鳞癌细胞增殖并促进其凋亡
2.6 miR-146b-3p 靶向LCN1 抑制肺鳞癌增殖并促进其凋亡
Western blot 实验结果显示,与miR-NC 组及miR-146b-3p+LCN1组相比,miR-146b-3p组中LCN1蛋白相对表达水平下降(P<0.05)。细胞增殖实验结果表明,与miR-NC 组及miR-146b-3p+LCN1 组相比,miR-146b-3p 组中增殖能力降低(P<0.05)。细胞克隆实验结果显示,与miR-NC 组及miR-146b-3p+LCN1 组相比,miR-146b-3p组中克隆细胞数明显减少(P<0.05)。细胞周期实验结果显示,与miR-NC 组及miR-146b-3p+LCN1 组相比,miR-146-3p 组中G0/G1 期细胞数量明显增加,S 期细胞数量明显减少(P<0.05)。细胞凋亡实验结果显示,与miR-NC 组及miR-146b-3p+LCN1组相比,miR-146b-3p组中凋亡细胞数明显增加(P<0.05),见图6。
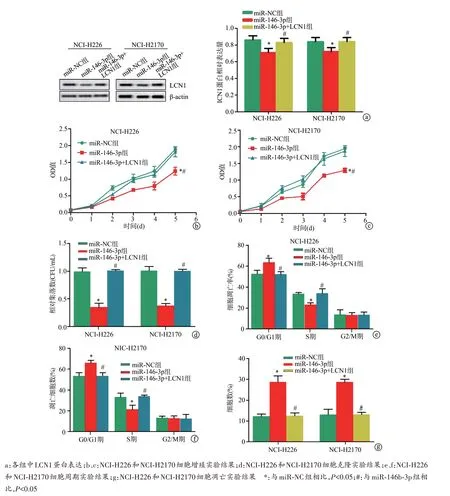
图6 miR-146b-3p靶向LCN1抑制肺鳞癌细胞增殖并促进其凋亡
3 讨论
肺鳞癌是非小细胞肺癌的常见类型,早期并无明显特异性,确诊时大多已处于中晚期,错过了最佳手术时机,因而通常采取化疗等保守治疗,但长期使用各种类型的抗癌药物会导致机体出现耐药性,从而影响治疗效果[13-17]。随着肿瘤精准治疗的快速发展,对肿瘤生物学行为和基因的调控成为了研究重点。其中miRNA 在肿瘤细胞增殖、迁移、侵袭、分化、凋亡、化疗耐药等多种生理过程中起到关键作用[18-19]。本研究旨在寻找影响肺鳞癌生物学行为的潜在标志物,为临床治疗提供理论依据。
本研究通过生物信息学分析发现,miR-146b-3p在肺鳞癌组织中低表达;LCN1 在肺鳞癌组织中高表达,且LCN1 差异表达与肺鳞癌临床预后不良及M 分期有关。构建miR-146b-3p 过表达细胞模型进行一系列体外功能试验,结果显示,肺鳞癌细胞过表达miR-146b-3p后,miR-146b-3p表达水平增加,细胞增殖和克隆能力降低,细胞周期受到阻滞,细胞凋亡明显增加,提示miR-146b-3p 过表达可抑制肺鳞癌细胞增殖,阻滞细胞周期,并诱导肿瘤细胞凋亡。进一步行Western blot分析显示,肺鳞癌细胞过表达miR-146b-3p后,细胞BCL2、CCNB1和CDK2蛋白减少,BAX 蛋白增加,表明过表达miR-146b-3p 可调节肺鳞癌细胞凋亡相关蛋白表达。促凋亡蛋白BAX 和抗凋亡蛋白BCL2在凋亡信号介导的凋亡过程中起关键作用,BAX 过表达可拮抗BCL2 表达,促进细胞凋亡。因此,上调BCL2 表达、下调BAX 表达可抑制细胞凋亡。众所周知,miRNA 通过抑制或降解靶基因mRNA 发挥生物学功能[14]。既往研究显示,miR-146b-5p 可通过靶向调节ZNRF2 表达诱导乳腺癌细胞增殖、迁移和侵袭[20]。因此,结合本研究结果推测miR-146b-3p 可抑制肺鳞癌细胞增殖,调节细胞周期相关蛋白,进而阻滞细胞周期,并通过上调BAX 和下调BCL2蛋白表达诱导细胞凋亡。本研究通过裸鼠移植瘤实验进一步发现,miR-146b-3p 过表达可抑制裸鼠移植瘤的生长,证实了miR-146b-3p 过表达在肺鳞癌中发挥抑制作用。
LCN1 是脂质运载蛋白家族的成员,是泪液中重要的脂质结合蛋白,分布在多种组织和腺体中,并与多种疾病的发生有关[21-22]。既往研究显示,LCN1 在乳腺癌中高表达,且其异常表达与临床病理特征和生存率较低有关[23]。本研究通过miRNA 靶基因数据库预测miR-146b-3p 调控肺鳞癌细胞的靶基因,结果显示,miR-146b-3p 存在与LCN1 靶向结合的位点,LCN1 是miR-146b-3p 的靶基因。Western blot 结果显示,miR-146b-3p 组中LCN1 蛋白表达水平明显低于miR-NC组,推测miR146b-3p 可以调控LCN1 蛋白表达。本研究发现,肺鳞癌组织中LCN1 表达高于癌旁组织,且与肺鳞癌患者M 分期存在一定关联。为进一步分析LCN1 在肺鳞癌中发挥的生物学功能,本研究通过构建LCN1 敲低细胞模型进行体外功能实验,结果显示,LCN1 敲低可以抑制肺鳞癌细胞生长、增殖,阻滞细胞周期,并诱导细胞凋亡。提示LCN1 在肺鳞癌中高表达,敲低LCN1表达可影响肺鳞癌生物学行为。
本研究结果显示,miR-146b-3p 过表达降低了肺鳞癌细胞增殖能力,减少了克隆细胞数,阻滞了细胞生长周期,增加了凋亡细胞数量;而miR-146b-3p 和LCN1 共转染后,逆转了miR-146b-3p 对肺鳞癌的抑制作用。故我们推测,miR-146b-3p 在肺鳞癌中发挥促癌作用,其可能通过靶向抑制LCN1 表达调控肺鳞癌生物学行为。
综上,本研究发现miR-146b-3p 在肺鳞癌细胞中低表达,LCN1在肺鳞癌细胞中高表达,且miR-146b-3p与LCN1 存在靶向结合位点。上调miR-146b-3p 可以抑制肺鳞癌细胞增殖,诱导细胞凋亡,并影响细胞生长周期。而miR-146b-3p 过表达可以抑制移植瘤生长,其作用机制可能是通过靶向LCN1实现的。

