PAD4 介导的瓜氨酸化组蛋白在中耳炎发病进程中的机制研究
阿不拉江·托合提,程秀琴,古丽波斯坦·买买提艾力(新疆维吾尔自治区人民医院耳鼻咽喉科,新疆 乌鲁木齐 830001)
中耳炎在全世界范围内被认为是耳鼻咽喉科最常见的疾病之一,可分为急性中耳炎和慢性中耳炎[1]。其中慢性化脓性中耳炎(chronic suppurative otitis media,CSOM)作为慢性中耳炎的一种,其主要特征是持续性且严重的耳溢液,且病程通常在6 个月以上[2],但是关于CSOM的发病机制仍缺乏进一步的研究。
瓜氨酸化组蛋白3(citrullinated histone H3,CitH3)指肽链中的精氨酸残基转化为瓜氨酸后的组蛋白,是一种表观遗传修饰后的产物,广泛存在于免疫和炎症相关的疾病中[3]。Makrygiannakis 等[4]通过免疫组织化学检查了类风湿性关节炎、肌炎、扁桃体炎和炎症性肠病的活检组织,发现炎症组织中的瓜氨酸的蛋白水平显著增加。Morita 等[5]在中耳炎患者的中耳液中检测到了CitH3,并发现其与疾病的严重程度呈正相关,表明CitH3 可能参与了CSOM 的发生发展。肽精酰基精氨酸脱亚胺酶4(peptidyl arginine deimidase 4,PAD4)可将精氨酸转化为瓜氨酸,其主要定位于细胞核并靶向组蛋白H3、H2A 和H4,对其进行瓜氨酸化[6]。在类风湿性关节炎中,PAD4 通过驱动细胞因子失调,促进炎症发生,并增加瓜氨酸化自身抗原的产生,从而加快疾病的发展[7]。然而,PAD4 是否可通过介导CitH3的生成来参与中耳炎的发病进程尚不清楚。
本研究通过检测中耳炎患者耳组织中的PAD4 与CitH3 水平,并构建CSOM 小鼠模型,初步评估PAD4、CitH3 与CSOM 的相关性,探索PAD4 是否通过介导CitH3 形成而影响CSOM 的发病进程,以期为CSOM 的预防及治疗提供一定的参考。
1 材料与方法
1.1 临床样本
选取于我院耳鼻咽喉诊疗中心接受中耳手术治疗的30 例CSOM 患者和30 例非中耳炎患者为研究对象。非中耳炎纳入标准:耳硬化或听骨链畸形需行听骨链重建术;双侧重度感音神经性耳聋进行听觉植入手术,主要行人工耳蜗植入术;无中耳炎史,且术前超薄颞骨断层CT 扫描显示中耳及乳突气房无任何可疑感染病灶;术前耳内镜检查鼓膜完整,无内陷及鼓膜感染。CSOM 纳入标准:有慢性持续间断的流脓病史,伴或不伴听力下降、耳鸣、眩晕等不适,并经耳内镜检查证实,出现复发性耳流脓性分泌物超过6 个月。将术中取材的中耳肉芽组织立即置于液氮冷冻,置于-80 ℃冰箱保存。本研究经我院伦理委员会批准(KY20220429117),所有患者或家属签署研究知情同意书。
1.2 实验动物
SPF 级雄性BALB/c 小鼠30 只(6~8 周龄,20~25 g)购自新疆维吾尔自治区实验动物研究中心,动物生产许可证号:SCXK(新)2021-0001。所有小鼠于室温、自然光暗周期的环境中饲养,实验期间自由饮食、饮水。
1.3 主要试剂
脂多糖(lipopolysaccharides,LPS)购自上海生物制剂公司,乌拉坦购自上海易恩化学技术有限公司,PAD4 抑制剂cl-amidine 购自美国MedChemExpress 公司,ELISA 检测试剂盒购自上海酶联生物科技有限公司,BCA 检测试剂盒、TRIzol、逆转录试剂盒和SYBR Green 试剂购自上海翌圣公司,qRT-PCR 引物由上海生工生物工程有限公司合成,PAD4 抗体、CitH3 抗体、p-P65、P65、GAPDH抗体购自英国Abcam公司,HRP标记的山羊抗兔IgG 抗体购自上海白鲨生物科技有限公司,RIPA组织细胞快速裂解液购自北京索莱宝科技有限公司,ECL试剂盒购自美国Millipore公司。
1.4 方法
1.4.1 CSOM小鼠模型的构建与治疗 随机将30只小鼠分为对照组、模型组和给药组,每组10 只。对照组不造模,模型组和给药组采用鼓室内少量多次注射LPS 制备CSOM小鼠模型:采用20%乌拉坦5 mL/kg进行腹腔内注射麻醉后,将15 μL的0.1 mg/mL LPS 经小鼠右中耳鼓膜前下方注入鼓室;24 h 后再次进行麻醉,注入15 μL的0.3 mg/mL LPS;24 h后注射15 μL的0.5 mg/mL LPS。小鼠正常喂养3 d 后,以耳内镜观察鼓膜情况,鼓膜破裂并见积液征则表示造模成功。建模成功后,给药组每日中耳注射5 mg/kg cl-amidine,模型组和对照组注射等量生理盐水。
1.4.2 听性脑干反应测试 小鼠完全麻醉后,将电极置于两耳间连线中点,参考电极插于给声耳垂下,地线插于对侧耳垂下,电极之间阻抗小于3kΩ。采用美国TDT公司TDTⅢ设备给声并采集信号。刺激声为click 声,强度10~90 dBHL,衰减间隔10 dB,在接近阈值时,衰减间隔5 dBHL。以出现较为明确的Ⅲ波作为反应测试的阈值。
1.4.3 Western blot检测PAD4、CitH3、p-P65和P65蛋白表达 提取患者和小鼠中耳组织中的总蛋白,利用BCA 试剂盒检测总蛋白浓度。SDS-PAGE 分离蛋白,之后转移至PVDF 膜上,脱脂牛奶封闭1 h,分别加入兔抗鼠PAD4(1∶800)、p-P65(1∶1 000)、P65(1∶1 000)、CitH3(1∶200)和GAPDH (1∶5 000),4 ℃孵育过夜,加入山羊抗兔二抗于37 ℃孵育1 h 后曝光显影,并使用Image J软件进行定量分析。
1.4.4 ELISA检测血清中PAD4、CitH3、IL-6和TNF-α含量 血浆样本制备:分别采集患者与小鼠的全血样本,置于抗凝管中,随后于4 ℃以3 000 r/min 离心10 min,取离心后的上清即为血浆样品。根据试剂盒说明书,检测患者与小鼠血清PAD4、CitH3、IL-6 和TNF-α含量。将标准品工作液和待测样品加入样品孔中,将覆膜覆在酶标板上,轻轻晃动混匀,37 ℃孵育20 min;弃去酶标板中液体,洗涤液洗涤5次,每次30 s,拍干,除空白孔,每孔加入酶标抗体,盖上覆膜,37 ℃孵育30 min,弃去液体,洗涤液洗涤5 次,每次30 s,拍干;在样品孔中加入显色剂A、B,盖上覆膜,轻轻振荡混匀,37 ℃避光孵育10 min;加入终止液终止反应,立即用酶标仪测定450 nm 波长处吸光度。根据标准品浓度对应吸光度制作标准曲线,并根据样品吸光度计算样品相应浓度。
1.4.5 qRT-PCR检测耳组织中IL-6、TNF-α mRNA表达 采用TRIzol 提取各组细胞总RNA。使用酶标仪检测总RNA的纯度和含量。按照qRT-PCR试剂盒说明书依次进行逆转录和qRT-PCR实验。qRT-PCR反应条件:95 ℃预变性30 s,95 ℃变性7 s,55 ℃退火30 s,72 ℃ 15 s,循环40 个周期。IL-6 引物序列:正向5'-CTGC AAGAGACTTCCATCCAG-3',反向5'-AGTGGTATAGA CAGGTCTGTTGG-3';TNF-α 引物序列:正向5'-CTGA ACTTCGGGGTGATCGG-3',反向5'-GGCTTGTCACTC GAATTTTGAGA-3';GAPDH 的引物序列:正向5'-AG GTCGGTGTGAACGGATTTG-3',反向5'-TGTAGACC ATGTAGTTGAGGTCA-3'。采用2-△△Ct法计算mRNA的相对表达量。
1.5 统计学分析
采用GraphPad Prism 8.0 软件对相关数据进行统计学分析。计量资料以均数±标准差(±s)表示,2 组间比较采用独立样本t检验,多组间比较采用单因素方差分析。使用Spearman法进行相关性分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 CSOM患者PAD4和CitH3表达上调
Western blot 结果显示,与非中耳炎患者比较,CSOM 患者耳组织中PAD4、CitH3 蛋白表达水平升高,差异有统计学意义(P<0.05),见图1。ELISA 结果显示,与非中耳炎患者比较,CSOM 患者血清中PAD4、CitH3浓度升高,差异有统计学意义(P<0.05),见图2a、b。Spearman相关性分析结果显示,CSOM 患者血清中PAD4和CitH3浓度呈正相关(R=0.363 6,P=0.000 4),见图2c。
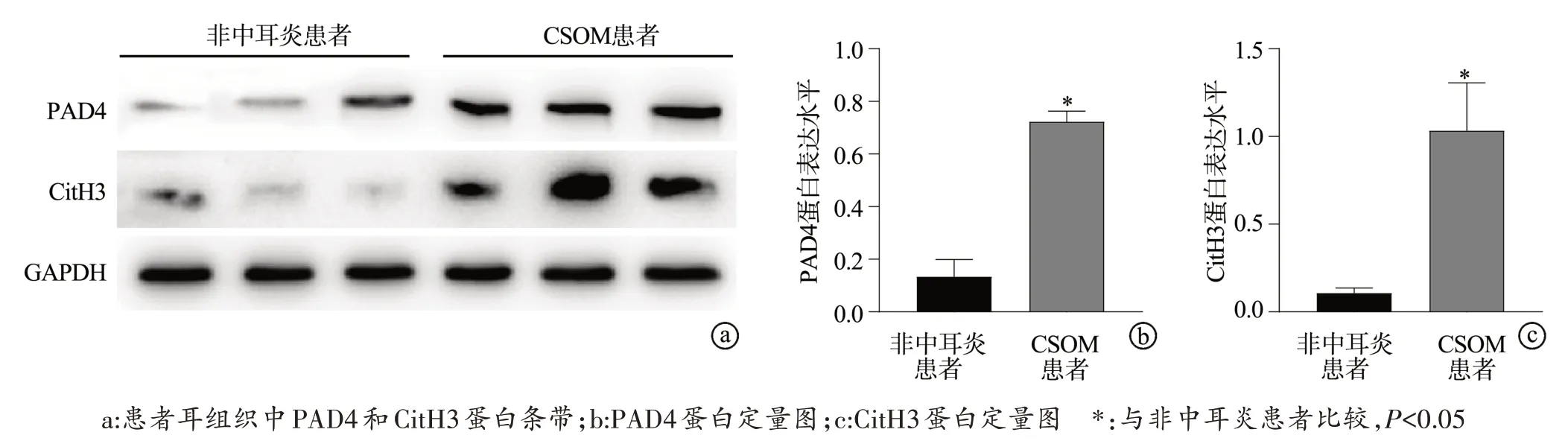
图1 非中耳炎患者和CSOM患者耳组织中PAD4、CitH3表达水平比较

图2 非中耳炎患者和CSOM患者血清中PAD4和CitH3含量情况
2.2 抑制PAD4缓解CSOM小鼠症状
听性脑干反应测试结果显示,与对照组比较,模型组听性脑干反应阈值升高,差异有统计学意义(P<0.05);与模型组比较,给药组听性脑干反应阈值降低,差异有统计学意义(P<0.05),见图3。

图3 小鼠听性脑干反应阈值比较
2.3 抑制PAD4降低CitH3表达
Western blot 结果显示,与对照组比较,模型组耳组织中PAD4、CitH3 蛋白表达水平升高,差异有统计学意义(P<0.05);与模型组比较,给药组耳组织中PAD4、CitH3 蛋白表达水平降低,差异有统计学意义(P<0.05),见图4。ELISA 结果显示,与对照组比较,模型组血清中PAD4、CitH3 浓度升高,差异有统计学意义(P<0.05);与模型组比较,给药组血清中PAD4、CitH3 浓度降低,差异有统计学意义(P<0.05),见图5。

图4 小鼠耳组织中PAD4、CitH3表达水平比较

图5 小鼠血清中PAD4、CitH3含量比较
2.4 抑制PAD4减轻CSOM小鼠炎症反应
qRT-PCR 结果显示,与对照组比较,模型组耳组织中IL-6、TNF-α mRNA 表达水平升高,差异有统计学意义(P<0.05);与模型组比较,给药组耳组织中IL-6、TNF-α mRNA 表达水平降低,差异有统计学意义(P<0.05),见图6。ELISA 结果显示,与对照组比较,模型组血清中IL-6、TNF-α 含量升高,差异有统计学意义(P<0.05);与模型组比较,给药组血清中IL-6、TNF-α浓度降低,差异有统计学意义(P<0.05),见图7。

图6 小鼠耳组织IL-6、TNF-α mRNA表达比较
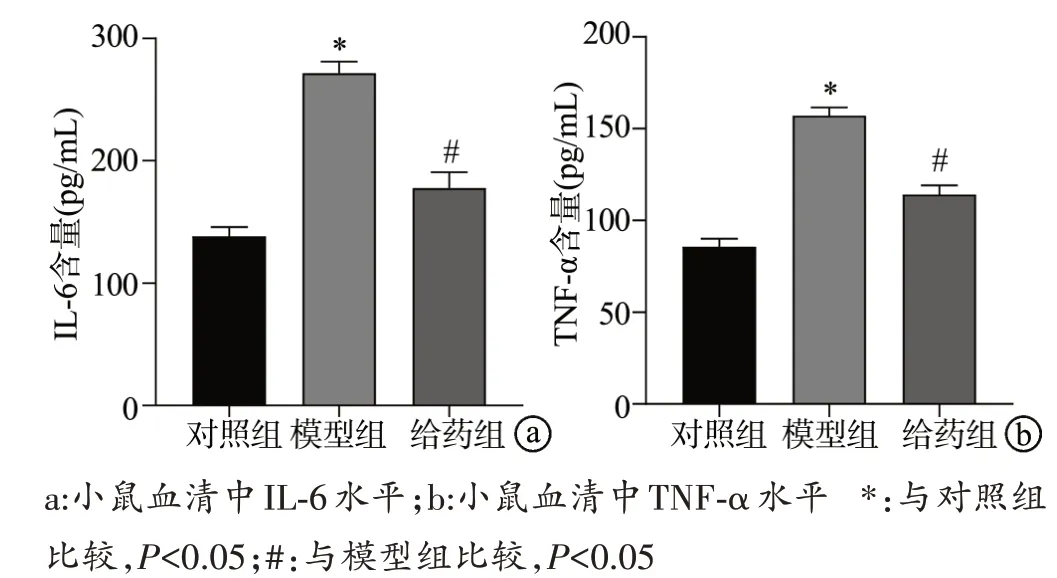
图7 小鼠血清中IL-6、TNF-α含量比较
2.5 抑制PAD4拮抗CSOM小鼠NF-κB信号通路
Western blot 结果显示,与对照组比较,模型组耳组织中p-P65/P65 水平升高,差异有统计学意义(P<0.05);与模型组比较,给药组耳组织中p-P65/P65蛋白表达水平降低,差异有统计学意义(P<0.05),见图8。

图8 小鼠耳组织中p-P65蛋白激活水平比较
3 讨论
中耳炎的病程迁延,可引起注意力、认知感及听力下降,从而影响患者生活质量,严重者会引起颅内外并发症甚至危及生命[8-9]。CSOM 患者鼓膜穿孔后,脓液一方面侵蚀听骨链听小骨,听骨链骨质破坏引起传导性耳聋,另一方面脓液也会循内耳圆窗破坏内耳的微细结构,造成感音神经性聋[10]。目前关于CSOM的标准治疗虽然已经有了多种方案,但无论手术治疗还是保守治疗,约有41%患者经过各种内外科治疗后耳溢液仍然持续存在,因此迫切需要发现新的生物标志物用于临床疗法的开发[11]。
CitH3 与多种炎症疾病的形成有关,如系统性红斑狼疮、类风湿性关节炎等[12]。PAD4作为脒基转移酶超家族的成员,可以催化组蛋白H3 的精氨酸残基瓜氨酸化[13]。有研究表明,CitH3是一种常见的炎症疾病标志物,细胞外CitH3 表现出高毒性,引起组织损伤,可能导致多器官衰竭并最终导致患者死亡。本研究结果显示,CSOM 患者的中耳液和血清中PAD4 和CitH3 含量增加,且二者表达呈正相关,表明PAD4 和CitH3 参与了CSOM 的发展,并提示PAD4 可能介导CitH3的形成。
有研究发现,引发CSOM 的致病菌主要是革兰氏阴性菌[14],其产物LPS 可加剧CSOM 的发病与病程进展。80%的中耳渗液中可发现LPS[15]。cl-amidine是一种PAD4 抑制剂,可以抑制PAD4 的酶活性,降低细胞中CitH3 水平[16]。本研究通过少量多次向小鼠鼓室内注射LPS 构建CSOM 模型,然后通过中耳注射5 mg/kg cl-amidine 抑制PAD4 酶活性,结果表明,cl-amidine 治疗可以缓解CSOM 小鼠症状,恢复听力,并降低中耳组织和血清中CitH3 的水平,表明PAD4 可以通过促进CitH3形成而加重CSOM的发展。
CSOM 的病因较多,其发病率可能受传染性病原体变异、宿主解剖结构和免疫状态的影响[17]。在分子水平上,CSOM 是由促炎转录因子激活、炎症细胞因子产生和释放,黏液分泌增加、黏膜增生、白细胞浸润中耳腔等一系列复杂的生理过程驱动[18]。研究报道,NF-κB可通过刺激因子(病毒、肿瘤坏死因子、B细胞活化因子、淋巴毒素等)的活化诱导多种基因的表达,产生IL-6、TNF-α等多种细胞因子,参与炎症反应[19]。IL-6、TNF-α 作为促炎细胞因子,均参与了细菌性和非细菌性急性中耳炎的持续炎症过程[20]。Zhao 等[21]的研究发现,抑制PAD4可通过调节上皮细胞核p65定位来保护LPS 诱导的急性肺损伤。而本研究结果显示,使用cl-amidine 抑制PAD4 后,p-P65 蛋白表达受到抑制,cl-amidine 治疗可以降低CSOM 小鼠耳组织与血清中的IL-6、TNF-α 水平,缓解炎症反应。因此,PAD4 介导CitH3 生成可能通过活化NF-κB 信号通路,增加炎症信号因子来加重CSOM 进程,但具体的分子机制仍有待进一步研究。
综上所述,CSOM 患者血清中PAD4 与CitH3 含量增加,且呈正相关,PAD4 通过介导CitH3 形成加重了CSOM,抑制PAD4 酶活性可显著降低CitH3 的表达水平,并通过抑制NF-κB 信号通路抑制炎症细胞因子的表达。以上结果初步明确了PAD4 介导CitH3 形成在CSOM 中的作用,可为进一步探索CSOM 的治疗提供新的思路。

