经头静脉植入心血管植入型电子器械的方法
杨玲玉,李学文(山西医科大学第三医院/山西白求恩医院/山西医学科学院/同济山西医院心血管内科,山西 太原 030032)
在过去的几十年里,心力衰竭等心脏疾病发病率逐渐上升,因而心血管植入型电子器械(cardiovascular implantable electronic devices,CIED)的需求在世界范围内激增。CIED 需经静脉将电极置入心腔或冠状静脉窦,不同的手术方式会出现不同的并发症,静脉入路一直以来争议较大,其受患者解剖结构、起搏电极、装置类型和临床判断的影响。锁骨下静脉、腋静脉和头静脉入路因操作相对简单,是临床较常用的入路,其中锁骨下静脉可能引起气胸或电极受压断裂等严重并发症;腋静脉穿刺存在体表定位困难、盲穿难度大等问题。2013年,欧洲心脏节律协会对其62个研究中心进行了CIED技术的调查,60%的研究中心将头静脉作为植入CIED 的首选静脉入路[1]。头静脉体表标志明确,局部较固定,导线不易因肢体活动牵拉而脱位,且经头静脉植入CIED 可在直视下操作,避免误伤锁骨下动脉、颈动脉、肺、气管和臂丛神经等邻近组织结构,术中结扎对远端血液回流影响较小,准确性高[2]。本文对头静脉解剖及经头静脉植入CIED 的手术方法进行分析总结,以期为术前静脉入路的选择提供参考。
1 静脉解剖
研究表明,经头静脉植入心脏再同步化治疗(cardiac resynchronization therapy,CRT)失败的原因不是头静脉的大小,而是头静脉汇入锁骨下静脉的走行情况[3]。Tse 等[4]发现约20%的患者经头静脉植入CIED失败,主要由于头静脉分离困难及静脉存在狭窄、弯曲或异常。因此,需了解头静脉的走行变异情况,以帮助术前评估经头静脉植入CIED的困难程度。
头静脉起自手背静脉网的桡侧,沿前臂下部的桡侧、前臂上部和肘部的前面及肱二头肌外侧沟上行,再经三角肌与胸大肌间沟行至锁骨下窝,穿锁胸筋膜汇入腋静脉或锁骨下静脉。两条肱静脉在大圆肌下远处汇合成腋静脉,腋静脉位于腋动脉的前内侧,在第1肋外侧缘续为锁骨下静脉。锁骨下静脉向内侧行于锁骨下动脉前下方,至胸锁关节后方与颈内静脉汇合成头臂静脉。头静脉位于胸三角沟的浅表位置,适合采用切开法植入CIED。头静脉走行恒定,变异较为罕见[5],但其作为植入CIED 的首选静脉入路,了解其解剖结构具有重要的临床意义。目前报道的头静脉局部解剖走行变异包括头静脉走行于锁骨上汇入颈外静脉[6-9]、头静脉走行于锁骨上汇入锁骨下静脉[10-11]、头静脉汇入颈内静脉[12]、头静脉存在侧支[6-9]、头静脉汇入锁骨下静脉时夹角较大[13-14]、狭窄[14]、缺如[15]等(图1)。若在术中观察到头静脉呈弓形走行于锁骨上,应警惕,并在不同体位进行透视或静脉造影明确。头静脉狭窄会影响经头静脉植入起搏电极数量。头静脉缺如可更换其他静脉入路继续手术。头静脉解剖的研究可能基于尸体,也可能基于手术,术中只能观察到一侧头静脉解剖情况,而尸体研究则可以同时观察到双侧头静脉情况,且头静脉走行变异在双侧同时存在的可能性很大[16]。有研究尝试从胚胎发育方面解释头静脉变异,但具体机制尚不清楚[17],有待后续研究。头静脉的解剖变异会影响经头静脉植入CIED 手术成功率,有研究报道2%~4%的头静脉跨越锁骨走行于锁骨上[16],这会使头静脉受到压迫,长期压迫会引起电极磨损断裂,导致二次手术。因此,术前了解头静脉局部解剖情况有助于制定手术方案及提高手术成功率。
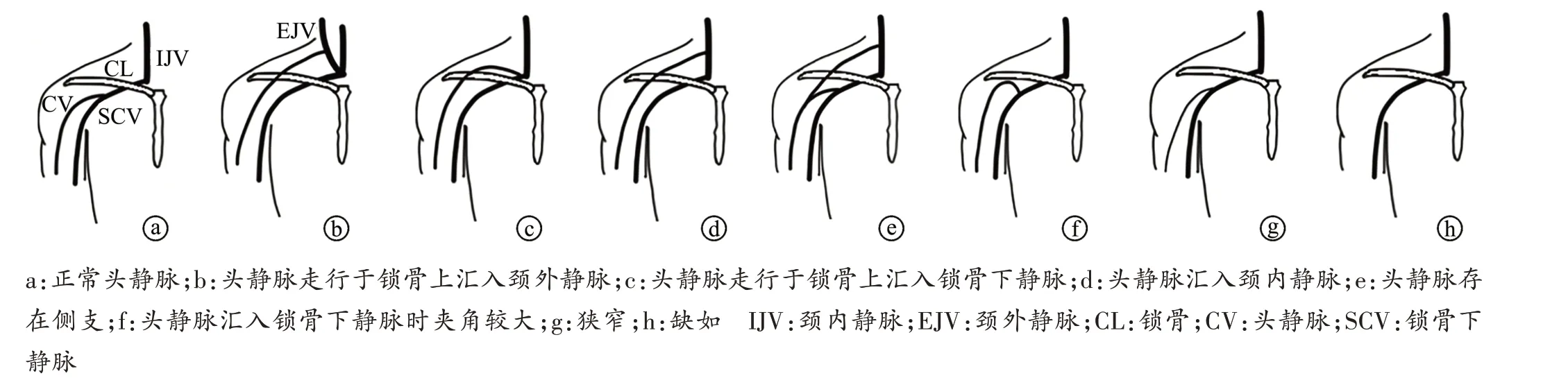
图1 头静脉局部解剖
一项前瞻性研究基于术前头静脉汇入腋静脉的角度、直径、是否有瓣膜、有无侧支四个变量建立了评分系统进行评估,超过50%的患者能够完成经头静脉置入至少1 个起搏电极,通过该评分系统更容易筛选出适合经头静脉植入CIED 的患者,特别是对于经验较少的操作者,可提高手术成功率和安全性[18]。但该研究系单中心研究,涉及的术者及患者数量有限,其评分系统需要更多数据来进一步验证。
2 手术方式
在头静脉较细或位置较深时,传统头静脉法植入CIED较困难,而采用改进的导引钢丝技术能顺利植入CIED[3-4],其在局部麻醉下于胸大肌三角肌间沟作一斜切口至胸大肌的筋膜,充分暴露后仔细分离胸三角沟,显露头静脉(图2),结扎头静脉远段,在头静脉上作一小切口,然后使用静脉拉钩将静脉切口拉开,放入电极导线。若头静脉太细不能容纳1 根电极导线,先经头静脉切口植入泥鳅导丝至下腔静脉,循泥鳅导丝植入撕剥式导线导引器,再经撕剥式导线导引器植入电极导线至目标位置[19]。Rademakers 等[20]的研究表明,使用多导丝的塞丁格尔方法比直接置入导丝的切开技术更容易放置多个起搏电极,即使是缺乏经验的术者成功率也较高,该手术方法可以使71%的患者避免锁骨下穿刺,从而减少并发症的发生。Kumar 等[21]提出了一种小切口开胸和心内膜双腔导线置入的混合技术,该术式可减少早期并发症,缩短住院时间,值得临床借鉴。
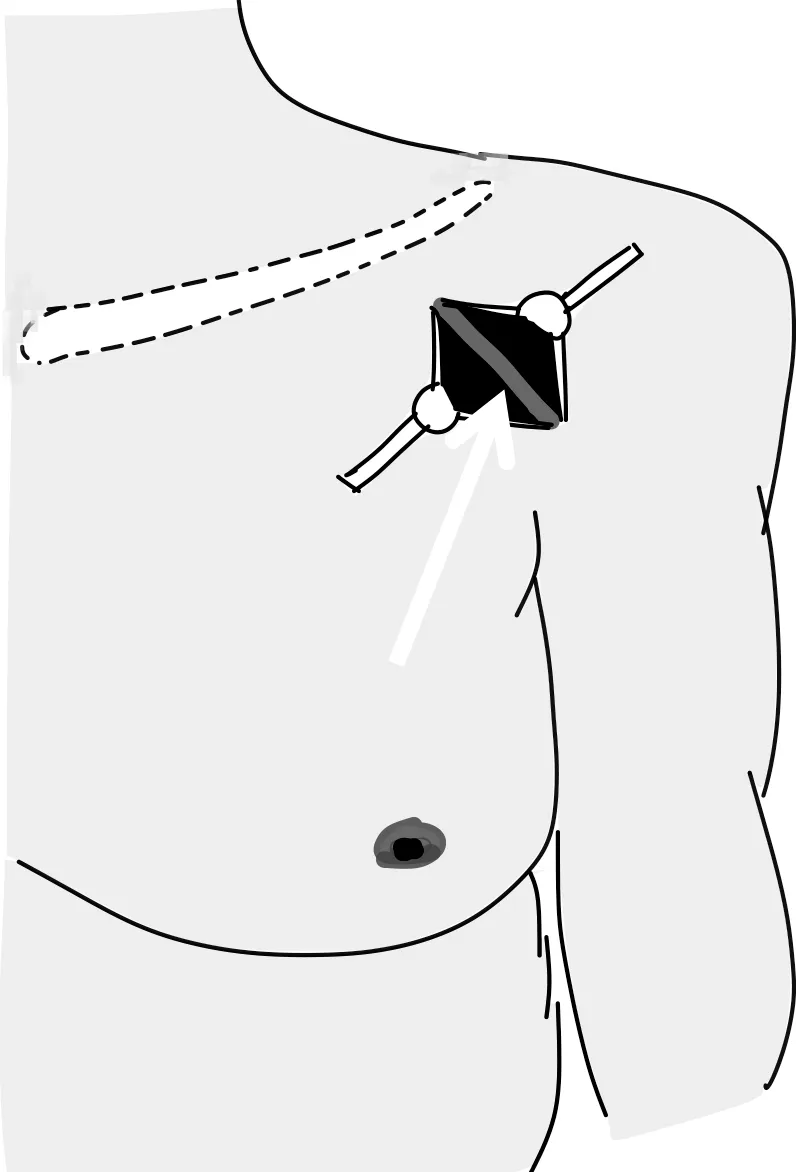
图2 分离胸三角沟,充分暴露头静脉(白色箭头:头静脉)
近年来,超声引导下植入CIED 逐渐兴起,利用超声显示针头、静脉和周围结构,有助于头静脉的定位及分离,减少患者及术者辐射暴露。有研究显示,通过多普勒超声观察和定位头静脉安全可靠,可缩短手术时间,提高手术成功率[22]。Otsubo 等[23]通过术前超声检查成功定位94.4%的头静脉。若术前超声检查未观察到头静脉,则建议及时更换静脉入路。但超声引导下植入CIED 时超声探头和呼吸压迫会影响术前对于头静脉直径及深度的判断,从而影响手术成功率。
头静脉切开植入CIED 失败主要与头静脉分离困难或静脉狭窄、弯曲有关,术前行静脉造影可观察到头静脉相关解剖走行异常。若存在静脉闭塞,则可以更换为对侧头静脉。Tse 等[4]的研究纳入315 例患者,最初其中82例患者电极导线无法进入头静脉,头静脉造影显示65例患者的头静脉存在静脉弯曲或狭窄,在静脉造影引导下成功经头静脉植入起搏电极。与单纯头静脉切开相比,静脉造影需建立同侧外周静脉通路,且有肾毒性和造影剂过敏的风险。
X 射线透视可用于确定与静脉位置相关的骨性标志,也是目前较常使用的引导方法。X 射线透视下经头静脉植入CIED,可观察头静脉走行情况,确定电极置入心腔位置。Deepti 等[24]通过对X 射线图像进行分析,在前后位透视中增加30°~35°足位成角,利用第1肋骨确定靶区,有效避免了将锁骨作为骨性标志。有研究显示,在X射线透视引导下经头静脉植入CIED简单、快速、有效,手术成功率为76.7%[25],但患者及术者暴露于X射线辐射下,对健康有潜在的危害[26]。
采用不同方式植入CIED 各有优劣,应结合术者经验及患者的具体情况制定个性化方案。
3 手术安全性及有效性
一般头静脉较小时,无法容纳CRT 装置的3 个起搏电极,通常更适合放置单个起搏电极。有研究证实,经头静脉植入CRT 安全有效[4]。而Al-Hadithi 等[2]的研究显示,87%的患者可通过头静脉入路置入3 个起搏电极,故认为头静脉可以作为CRT 植入的首选静脉入路。这提示术者不用担心因头静脉大小而改换其他静脉入路。
头静脉入路的安全性及有效性仍有一定争议。故Atti 等[27]对23 项研究的35 722 例患者进行分析显示,经头静脉植入CIED 成功率为76.2%,与锁骨下静脉入路相比,头静脉入路气胸和电极故障等并发症发生率更低,且不会延长手术时间,安全可行。Ussen等[28]的研究显示,与锁骨下入路相比,经头静脉植入CIED 的手术时间和X 射线曝光时间更短,并发症发生率更低(3.3%vs.7.1%),手术成功率达89%;且该研究认为以往文献报道的较低成功率和较长的手术时间是术者经验不足所致。多项研究发现,经腋静脉入路和头静脉入路植入起搏电极的并发症发生率无明显差异[29-30]。Benz等[31]的一项荟萃分析发现,与锁骨下静脉入路相比,头静脉入路发生气胸和电极故障的风险更低,出血事件的发生率两者无显著差异。我们认为,头静脉入路是安全的静脉入路,在直视下植入CIED,避免了误穿锁骨下动脉、气胸、锁骨下挤压综合征等与锁骨下静脉相关的并发症。此外,可适当加强手术医师对经头静脉植入CIED 的练习,打破头静脉入路的使用限制,使其得到进一步推广。
近年来,临床上开始应用无导线起搏器,旨在避免传统经静脉起搏器治疗中起搏电极和起搏器囊袋相关的并发症。Tjong 等[32]的研究发现,与传统经静脉单腔起搏器相比,无导线起搏器的短期并发症发生率(4.8%)略高。无导线起搏器的并发症包括:心脏穿孔、装置脱位和股动脉相关并发症,受术者的操作影响较大。相信随着无导线起搏装置技术的成熟和医师经验的积累,操作相关并发症会逐渐减少,使更多患者受益。
4 总结与展望
头静脉作为植入CIED 的首选静脉入路,相较于其他静脉入路优势明显,但其解剖走行仍偶有变异。术前超声定位头静脉、顺行静脉造影观察头静脉走行情况,结合术者经验及患者的具体情况制定个性化方案,术中在X 射线引导下采用导引钢丝均可明显提高手术成功率。随着无导线起搏器在临床上的应用发展,有望减少并发症的发生,使更多人获益。

