CDCA3 在上皮性卵巢癌中的表达及意义
李 苗,金海红,付静静,韩 坤,龚 姗(秦皇岛市第一医院妇科,河北 秦皇岛 066000)
卵巢癌是女性生殖系统常见的恶性肿瘤,致死率高。临床上约有70%的卵巢癌患者就诊时已处晚期,5 年生存率仅为30%[1-2]。目前卵巢癌的发病机制尚未完全明确,增殖、侵袭和迁移是影响病情进展的重要因素[3]。细胞分裂周期相关蛋白3(cell division cycle associated protein 3,CDCA3)与细胞分裂密切相关,会影响肿瘤细胞增殖、侵袭及免疫浸润和肿瘤微环境[4]。CDCA3 与肿瘤发生发展的关系日益受到重视,研究发现,CDCA3 可能参与肝细胞癌[4]、膀胱癌[5]、胃癌[6]和肾癌[7]等肿瘤的发生。本研究通过检测上皮性卵巢癌组织中CDCA3 的表达,在细胞水平上探讨CDCA3 对卵巢癌细胞增殖、侵袭和迁移的影响,以期寻找新的上皮性卵巢癌诊治靶点。
1 材料与方法
1.1 组织样本
选取2019 年6 月至2021 年12 月于本院进行手术切除的50 例患者的卵巢癌组织,患者年龄42~62 岁,平均(48.09±9.23)岁;浆液性癌31 例,透明细胞癌10 例,黏液性癌7 例,其他2 例;FIGO 分期为Ⅰ~Ⅱ期22例,Ⅲ~Ⅳ期28例。纳入标准:①组织病理学检查证实为上皮性卵巢癌;②术前未接受过放化疗;③未合并其他类型肿瘤。排除标准:①合并感染性疾病;②代谢性疾病;③自身免疫性疾病;④严重的心、肝、肾功能障碍。另选取同期因子宫肌瘤或子宫腺肌病进行手术切除的30例患者的正常卵巢组织作为对照,患者年龄38~52 岁,平均(47.03±8.45)岁。本研究已经我院伦理委员会批准(S2019-02-11)。
1.2 细胞及试剂
上皮性卵巢癌细胞系A2780、Hey、CAOV3、SKOV3 购于中科院上海细胞库;胎牛血清和DMEM 培养基购于北京伊诺凯科技有限公司;总RNA 提取试剂盒、逆转录试剂盒、PCR 试剂盒、BCA 试剂盒、凝胶快速制备试剂盒购于上海尚宝生物科技有限公司;CDCA3、细胞周期蛋白D1(Cyclin D1)、基质金属蛋白酶9(matrix metalloprotein 9,MMP-9)、E-钙黏蛋白(E-cadherin)、GAPDH 抗体均购于美国Sigma 公司;CDCA3 siRNA和pLenti6/V5-CDCA3质粒由生工生物工程(上海)股份有限公司设计并提供;LipofectamineTM2000转染试剂盒购于北京伊诺凯科技有限公司;CCK-8 细胞检测试剂盒及Transwell 小室购于上海语纯生物科技有限公司。
1.3 细胞培养
将A2780、Hey、CAOV3、SKOV3细胞培养于37 ℃、5%CO2、含10%胎牛血清的DMEM培养基中。
1.4 RT-PCR检测组织和细胞中CDCA3 mRNA表达
采用RT-PCR检测组织和细胞中CDCA3 mRNA表达水平[8]。首先用总RNA 提取试剂盒提取组织和细胞中总RNA,随后用逆转录试剂盒合成cDNA。用PCR试剂盒扩增引物,反应条件:95 ℃预变性15 min;95 ℃变性15 s,95 ℃退火30 s,70 ℃延伸30 s,共40个循环。用2-△△Ct法计算CDCA3相对表达水平。
1.5 Western blot 检测组织和细胞中CDCA3 蛋白表达水平
采用Western blot 检测组织中CDCA3 蛋白表达水平及细胞中CDCA3、Cyclin D1、MMP-9、E-cadherin 表达水平[9]。用RAPI 裂解液提取组织和细胞中的总蛋白,用BCA试剂盒检测蛋白浓度,10% SDS-PAGE电泳分离蛋白,用半干转移法将蛋白转至PVDF 膜上。随后用5%脱脂奶粉封闭1 h,加入CDCA3 抗体(稀释500 倍)、Cyclin D1 抗体(稀释500 倍)、MMP-9 抗体(稀释1 000 倍)、E-cadherin 抗体(稀释1 000 倍)、GAPDH抗体(稀释1 000 倍),4 ℃孵育过夜,次日除去一抗,用TBST 缓冲液洗涤3 次后加入二抗。用ECL 发光仪成像,Image J软件分析灰度值。
1.6 siRNA转染CAOV3细胞
将处于对数生长期的CAOV3 细胞接种于24 孔板,分为沉默组和Control组。沉默组加入50 nmol/L的CDCA3 siRNA,Control 组加入50 nmol/L 的阴性对照序列。转染步骤严格按照LipofectamineTM2000转染试剂盒说明书进行。
1.7 慢病毒转染Hey细胞
将处于对数生长期的Hey 细胞接种于24 孔板,分为过表达组和对照组。过表达组用CAOV3 慢病毒(1 mL 含CDCA3 基因的pLenti6/V5-CDCA3 质粒)感染Hey 细胞,对照组用空载体慢病毒感染。感染48 h 后进行后续实验。
1.8 细胞增殖、侵袭和迁移能力检测
用CCK-8 试剂盒检测细胞活性,细胞培养24 h 后向每个培养孔中添加10 μL CCK-8 试剂,最后用酶标仪检测450 nm 波长处的吸光度值[10]。用Transwell 实验检测细胞侵袭和迁移[11]。迁移实验:在Transwell 迁移板上室加入5×104个细胞,下室中加入600 μL 完全培养基,于5%CO2、37 ℃培养24 h。固定膜底细胞并进行0.1%结晶紫染色20 min,光学显微镜下对细胞进行定量。侵袭实验:使用预先加入Matrigel 胶的小室,上室中加入5×104个细胞,于5%CO2、37 ℃培养48 h,其余步骤同迁移实验。
1.9 统计学方法
采用SPSS 20.0 统计软件处理数据。计量资料以均数±标准差(±s)表示,2 组间比较采用t检验;多组间比较采用单因素方差分析,组内两两比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 CDCA3在上皮性卵巢癌组织及细胞中的表达
与正常卵巢组织比较,上皮性卵巢癌组织中CDCA3 mRNA 和蛋白表达水平均较高(P<0.05)。在A2780、Hey、CAOV3、SKOV3 上皮性卵巢癌细胞系中,CAOV3 细胞中CDCA3 的mRNA 和蛋白表达水平最高,而Hey 细胞最低,见图1。因此,我们选择CAOV3和Hey细胞进行后续机制验证。

图1 CDCA3在上皮性卵巢癌组织及细胞中的表达
2.2 沉默或过表达CDCA3对卵巢癌细胞增殖活力的影响
沉默CDCA3 后CAOV3 细胞CDCA3 蛋白表达水平和细胞增殖活力降低(P<0.05),过表达CDCA3 后Hey 细胞CDCA3 蛋白表达水平和细胞增殖活力升高(P<0.05),见图2。
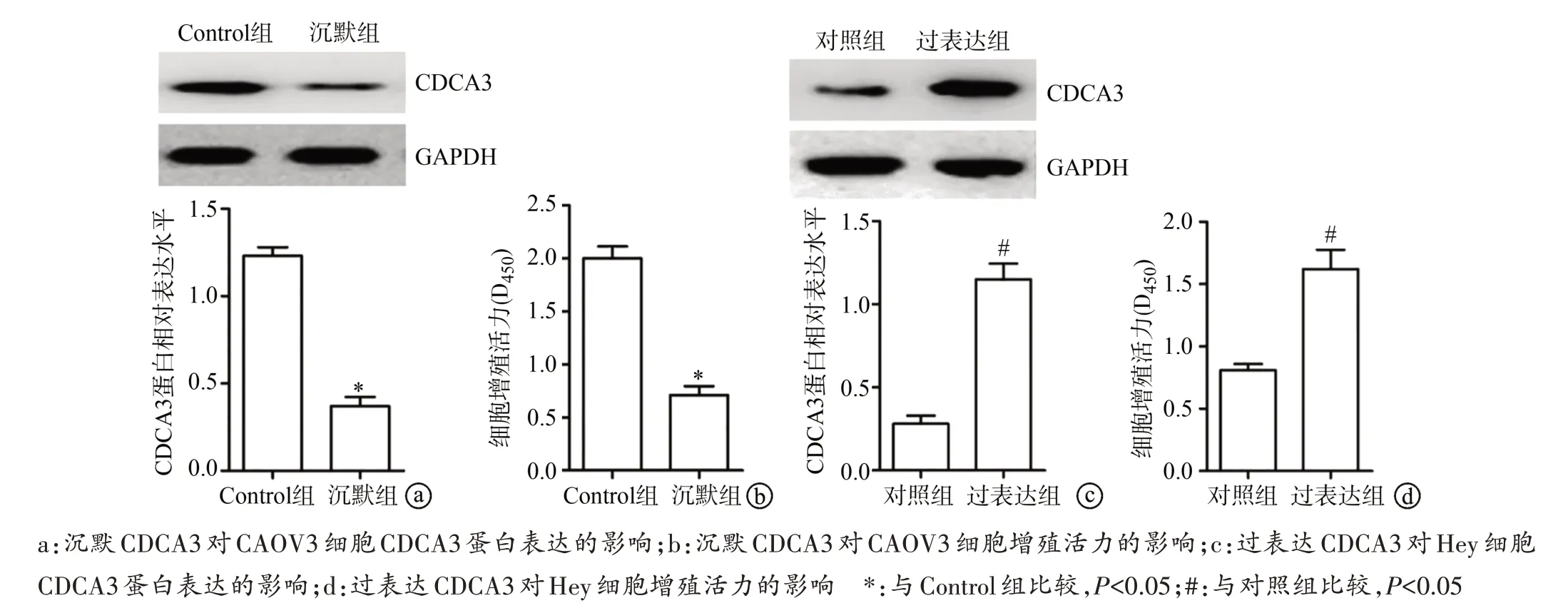
图2 沉默或过表达CDCA3对卵巢癌细胞CDCA3蛋白表达及增殖活力的影响
2.3 沉默或过表达CDCA3对卵巢癌细胞侵袭和迁移的影响
沉默CDCA3 后CAOV3 细胞侵袭和迁移能力降低(P<0.05),过表达CDCA3后Hey细胞侵袭和迁移能力升高(P<0.05),见图3。
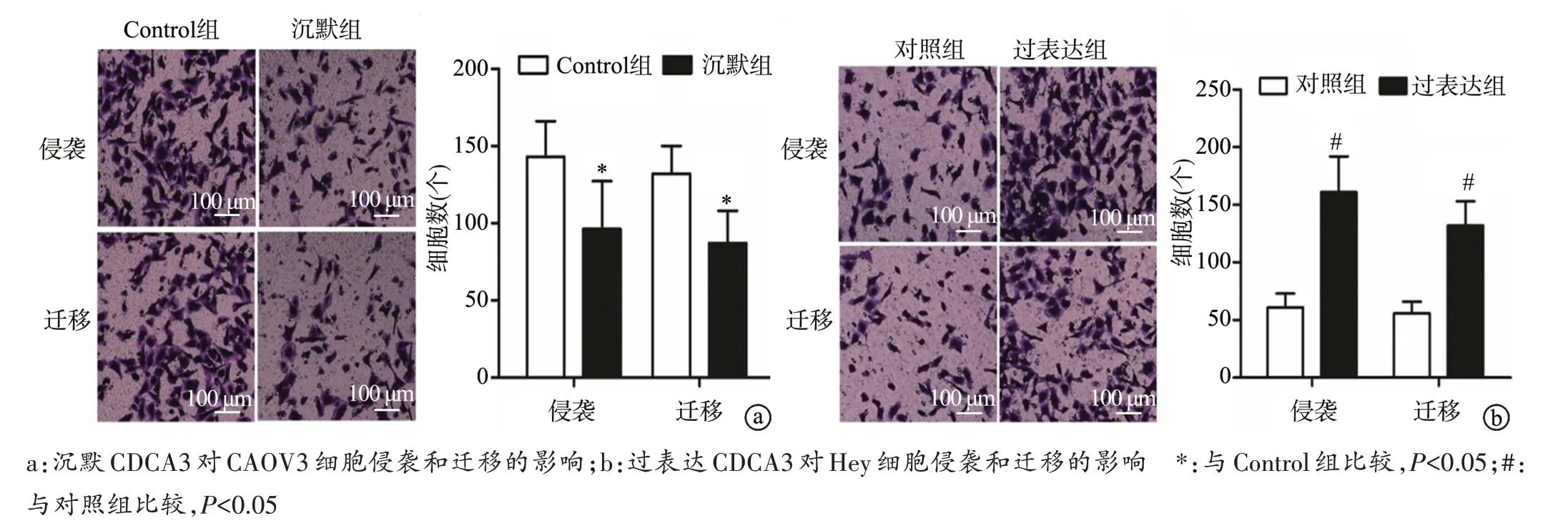
图3 沉默或过表达CDCA3对卵巢癌细胞侵袭和迁移的影响
2.4 沉默或过表达CDCA3 对卵巢癌细胞Cyclin D1、MMP-9、E-cadherin蛋白表达水平的影响
沉默CDCA3 后,CAOV3 细胞Cyclin D1、MMP-9 蛋白表达水平降低(P<0.05),E-cadherin 蛋白表达水平升高(P<0.05)。过表达CDCA3后,Hey细胞Cyclin D1、MMP-9 蛋白表达水平升高(P<0.05),E-cadherin 蛋白表达水平降低(P<0.05),见图4。

图4 沉默或过表达CDCA3对卵巢癌细胞Cyclin D1、MMP-9、E-cadherin蛋白表达水平影响
3 讨论
CDCA 基因家族由8 个成员(CDCA1~CDCA8)组成,是细胞增殖的重要调控因子,在肿瘤进展中发挥重要作用[12]。CDCA3 是CDCA 家族的重要成员,是S期激酶相关蛋白1/淘汰素/F-boxE3 泛素连接酶复合物的一部分,可以介导有丝分裂抑制激酶weel 的降解,影响细胞周期[13]。另CDCA3 可以和Skp1、cullin 结合,通过多种信号通路参与病理生理过程[14]。CDCA3 在肿瘤发生发展中的作用逐渐受到重视,其可通过调控E2F 转录因子1(E2F1)、NF-κB/Cyclin D1 信号通路促进结直肠癌细胞的增殖[14-15]。此外,CDCA3 还参与非小细胞肺癌、乳腺癌、口腔癌等的增殖,其高表达与不良预后有关[16]。
CDCA3 与上皮性卵巢癌的关系目前尚不清楚。本研究发现上皮性卵巢癌组织中CDCA3 表达水平高于正常卵巢组织,提示CDCA3可能参与上皮性卵巢癌的发生。为进一步探讨CDCA3 在上皮性卵巢癌中的作用机制,我们检测了上皮性卵巢癌细胞系中CDCA3的表达水平,结果显示,沉默CDCA3 后CAOV3 细胞中CDCA3 蛋白表达水平、细胞增殖活力、侵袭能力、迁移能力降低,过表达CDCA3 后Hey 细胞CDCA3 蛋白表达水平、细胞增殖活力、侵袭和迁移能力升高。说明CDCA3 可能作为促癌基因在上皮性卵巢癌中发挥作用。Cyclin D1 主要在肿瘤中促进细胞增殖,其还与肿瘤黏附和侵袭有关[17]。肿瘤细胞侵袭和迁移与细胞外基质的降解有关,肿瘤细胞分泌MMP可以破坏肿瘤周围组织的细胞外基质[18]。MMP-9在上皮性卵巢癌组织中高表达,并且能够促进肿瘤细胞的侵袭及迁移[19]。E-cadherin 表达水平下降可影响细胞基质黏附受体的表达,进而使肿瘤细胞间黏附性下降,最终引起肿瘤细胞侵袭和转移[20]。本研究沉默CDCA3后,CAOV3细胞中Cyclin D1、MMP-9 蛋白表达水平降低,E-cadherin蛋白表达水平升高;过表达CDCA3 后,Hey 细胞中Cyclin D1、MMP-9 蛋白表达水平升高,E-cadherin 蛋白表达水平降低。以上结果提示,CDCA3 可能参与上皮性卵巢癌的进展。
综上,CDCA3 在上皮性卵巢癌中高表达,能够促进上皮性卵巢癌细胞的增殖、侵袭和迁移。CDCA3 可能成为上皮性卵巢癌的生物学标志物,对临床诊治有潜在价值。未来需要进一步开展临床和基础研究,探讨CDCA3在上皮性卵巢癌中的作用及机制。

