PTX3 对重症急性胰腺炎小鼠肾损伤的作用及机制研究
李 川,钟育武,赵展庆(海南西部中心医院重症医学科,海南 儋州 571799)
急性胰腺炎是一种常见的胰腺疾病,其严重程度从轻度自限性疾病到重症急性胰腺炎(severe acute pancreatitis,SAP)不等。其中SAP 是一种急性临床综合征,是胰腺局部炎症病变累及多个器官的全身性疾病,其特点是起病急、进展快、并发症发生率高和多器官衰竭,病死率为7%~47%[1]。急性肾损伤(acute kidney injury,AKI)是SAP 的常见并发症,预后极差,尤其是在需要肾替代治疗时,病死率为25%~75%[2]。AKI的特点是患者肾排泄功能迅速丧失,一般通过氮代谢终产物(尿素和肌酐)的积累和/或尿量减少来诊断[3]。SAP 患者发生AKI 的确切机制较为复杂,了解SAP 肾损伤的病理学机制可能为危重症患者的治疗提供新的方向。
正五聚蛋白3(pentraxin 3,PTX3)是正五聚蛋白家族的成员之一,主要产生于炎症部位,在宿主防御、癌症生物学、自身免疫、血管生成调节和组织修复等一系列事件中具有重要作用[4]。研究表明,PTX3 是唯一能在肾组织中检测到的戊聚糖,危重症患者发生AKI后,血清和尿液中PTX3 含量明显升高[5]。然而,PTX3在SAP 诱导的AKI 中的作用尚未阐明。本研究探讨PTX3 在SAP 诱导的肾损伤小鼠中的作用及其可能的机制,以期为SAP诱导的AKI提供治疗靶点。
1 材料与方法
1.1 实验动物及材料
40 只雄性BALB/c 小鼠,体质量(22±2)g,7~8 周龄,购自海南药物研究所有限责任公司,动物使用许可证号:SYXK(琼)2020-0025。小鼠饲养于标准动物房,环境温度(22±3)℃,普通饲料喂养,自由饮水、进食。所有动物都得到了人道主义的照顾,所有动物实验均按照国家实验动物管理法规和海南医学院动物实验伦理委员会规定进行。
PTX3 单克隆抗体和左旋精氨酸购自美国Sigma公司;重组小鼠PTX3 购自美国R&D 公司;白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-4 和IL-13 检测试剂盒购自武汉默沙克生物科技有限公司;iNOS、CD16/32 和GAPDH 抗体购自英国Abcam 公司;CD206 和Arg-1 抗体购自美国圣克鲁斯生物技术有限公司;一步法TUNEL 细胞凋亡检测试剂盒(绿色荧光)购自上海碧云天生物技术有限公司。
1.2 SAP小鼠模型建立[6]及干预处理
40只小鼠适应环境1周后,随机分为空白对照组、SAP 组、PTX3 组和anti-PTX3 组,每组10 只。PTX3 组和anti-PTX3 组小鼠分别腹腔注射重组小鼠PTX3(0.5 mg/kg)[7]和PTX3单克隆抗体(0.2 mg/kg);空白对照组和SAP组小鼠腹腔注射等量生理盐水。然后SAP组小鼠腹腔注射20%左旋精氨酸(4 mg/g),PTX3 组和anti-PTX3 组小鼠分别于给药48 h、24 h 之后腹腔注射20%左旋精氨酸(4 mg/g);1 h 后,各组再次腹腔注射20%左旋精氨酸(4 mg/g)。若小鼠表现为腹部收缩明显,痛苦异常,且伴有间歇性呕吐,则视为建模成功[8]。注射结束后,小鼠自由进食、饮水。
1.3 血清生化指标检测
小鼠最后一次干预24 h 后麻醉,眼球采血。血液静置离心后,取上层血清,于-80 ℃保存。全自动生化分析仪检测血清淀粉酶(amylase,AMY)、肌酐(creatinine,Cr)和尿素氮(blood urea nitrogen,BUN)水平。
1.4 HE染色检测胰腺和肾组织病理学变化
小鼠最后一次干预24 h 后麻醉,眼球采血后处死小鼠。取胰腺和肾组织,用4%多聚甲醛固定72 h,梯度乙醇脱水,二甲苯透明;石蜡包埋、切片。石蜡切片常规二甲苯、乙醇脱蜡至水,苏木素染色10 min,0.7%盐酸乙醇分化数秒,流水洗涤后,伊红浸染3 min。梯度乙醇脱水,二甲苯透明,中性树胶封片。于光学显微镜下观察。
对胰腺组织进行病理学评分,评分标准:轻度水肿、炎症和出血各计1 分;中度水肿、炎症和出血各计2 分;重度水肿、炎症和出血各计3 分;此外,局灶性坏死计3分,片状坏死计5分,小叶坏死计7分[9]。对肾小管损伤进行评分:无损伤计0 分;<25%损伤计1 分;25%~<50%损伤计2 分;50%~75%损伤计3 分;>75%损伤计4 分[10]。分值越高说明胰腺及肾组织损伤越严重。
1.5 TUNEL染色检测肾组织细胞凋亡情况
使用1.4 项下制备的肾组织石蜡切片,并常规二甲苯、乙醇脱蜡至水,用蛋白酶K 于37 ℃孵育15 min。PBS 洗涤后,添加TUNEL 检测液,37 ℃避光孵育60 min。DAPI 染核,PBS 洗涤3 次后,用抗荧光淬灭封片液封片,于荧光显微镜下观察。
1.6 ELISA检测IL-6、TNF-α、IL-4和IL-13水平
取出冻存的血清解冻,另取胰腺组织研磨后的上清液。按照ELISA试剂盒说明书检测IL-6、TNF-α、IL-4和IL-13水平。
1.7 Western blot 检测PTX3、iNOS、CD16/32、CD206和Arg-1蛋白表达
取各组小鼠肾组织剪碎,RIPA 裂解液裂解组织,离心取上清,BCA 法测定蛋白浓度。取30 μg 蛋白进行SDS-PAGE 分离并转至PVDF 膜上。10%脱脂奶粉封闭,随后加入PTX3(1∶1 000)、iNOS(1∶1 000)、CD16/32(1∶1 000)、CD206(1∶1 000)、Arg-1(1∶1 000)和GAPDH(1∶1 000)抗体,于4 ℃孵育过夜。加入二抗(1∶5 000)室温孵育1 h 后,滴加BeyoECL Star 工作液到膜上,使用化学发光成像仪检测。
1.8 流式细胞术检测肾组织中M1 型和M2 型巨噬细胞比例
取各组小鼠肾组织剪碎,加入消化液于37 ℃消化30 min。移液枪吹打分散细胞后,过200 目铜网。800 r/min 离心5 min,去上清。PBS 清洗细胞2 次,800 r/min 离心5 min 去上清,使用DMEM 培养基重悬细胞,然后以1×106个/孔多密度接种于细胞培养板中,制备单个核细胞悬液,加入佛波酯(终浓度30 ng/mL)[11]刺激2 h。细胞离心去上清,PBS 重悬细胞,加入iNOS(1∶2 000)、CD16/32(1∶3 000)、CD206(1∶3 000)和Arg-1(1∶3 000)抗体,室温孵育30 min,PBS 洗涤细胞。荧光二抗避光孵育30 min,PBS 洗涤细胞并重悬。上流式细胞仪检测M1型和M2型巨噬细胞比例。
1.9 统计学分析
采用SPSS 21.0 统计软件进行数据分析,计量数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 各组小鼠胰腺组织病理学变化
空白对照组小鼠胰腺组织结构未见明显异常损伤。与空白对照组相比,SAP 组、PTX3 组和anti-PTX3组小鼠胰腺组织结构紊乱,胰腺组织病理学评分升高(P<0.05);与SAP 组相比,PTX3 组小鼠胰腺结构损伤加重,胰腺组织病理学评分明显升高(P<0.05);anti-PTX3组胰腺组织病理学变化较SAP组和PTX3组明显改善,具有更好的结构完整性,炎症细胞的浸润减少,胰腺组织病理学评分明显降低(P<0.05),见图1。
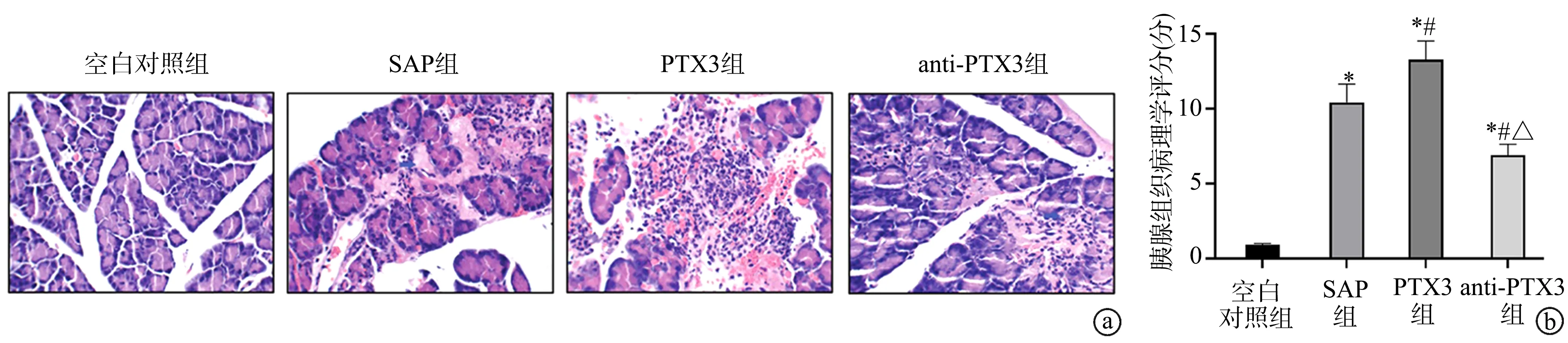
图1 小鼠胰腺组织病理学变化
2.2 各组小鼠PTX3表达变化
与空白对照组相比,SAP 组、PTX3 组和anti-PTX3组小鼠PTX3 蛋白表达明显升高(P<0.05);与SAP 组相比,PTX3 组小鼠PTX3 蛋白表达明显升高(P<0.05),anti-PTX3 组小鼠PTX3 蛋白表达明显降低(P<0.05),见图2。
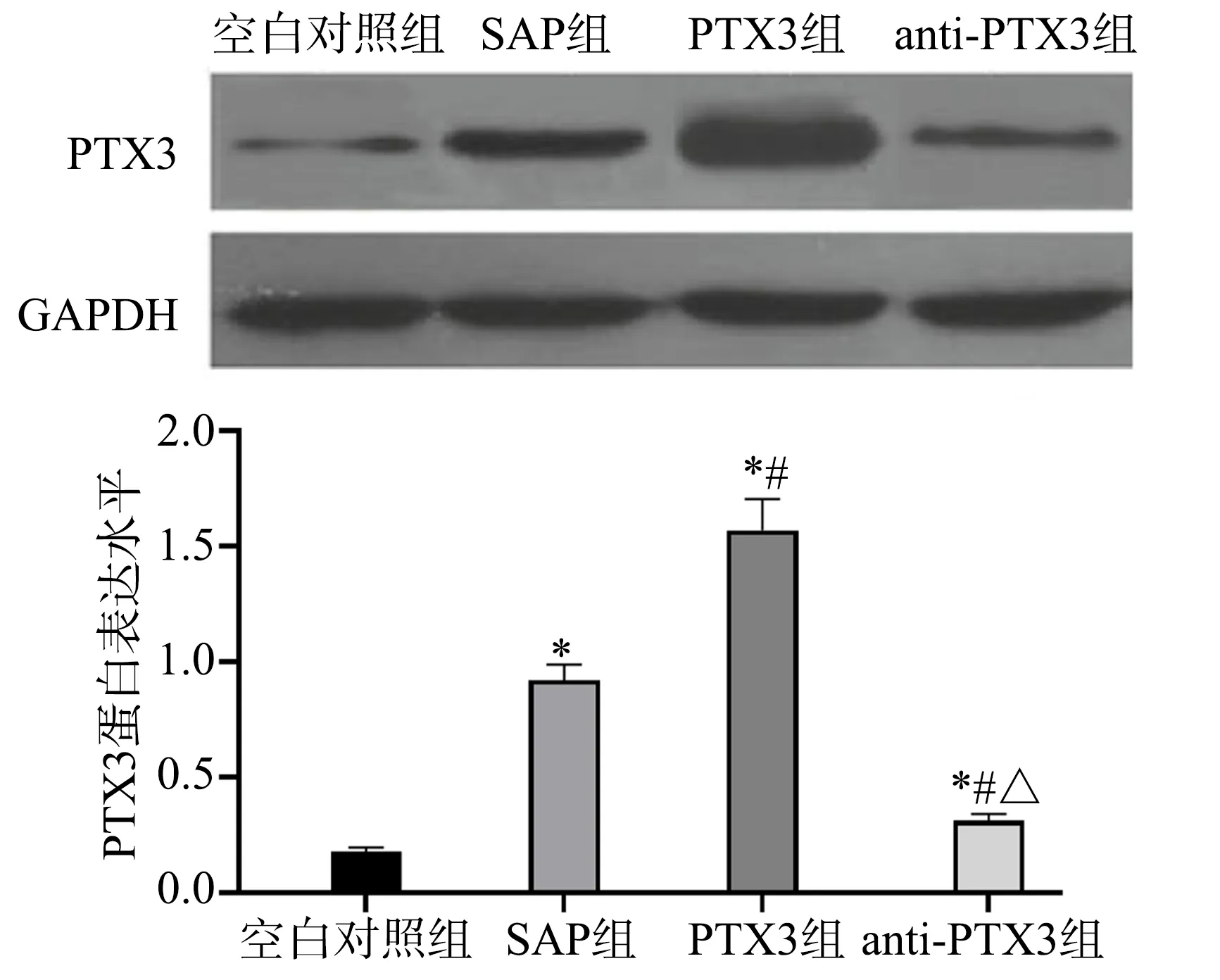
图2 Western blot检测小鼠PTX3蛋白表达
2.3 各组小鼠血清生化指标比较
与空白对照组相比,SAP 组、PTX3 组和anti-PTX3组小鼠AMY、BUN 和Cr 水平升高(P<0.05);与SAP 组相比,PTX3 组小鼠AMY、BUN 和Cr 水平明显升高(P<0.05),anti-PTX3组小鼠AMY、BUN和Cr水平明显降低(P<0.05);与PTX3 组相比,anti-PTX3 组小鼠AMY、BUN和Cr水平明显降低(P<0.05),见表1。
表1 各组小鼠血清AMY、BUN和Cr水平比较(±s,n=10)

表1 各组小鼠血清AMY、BUN和Cr水平比较(±s,n=10)
*:与空白对照组比较,P<0.05;#:与SAP 组比较,P<0.05;△:与PTX3组比较,P<0.05
组别空白对照组SAP组PTX3组anti-PTX3组AMY(U/L)2 464.92±329.34 9 174.38±634.57*11 273.05±856.48*#3 746.92±478.51*#△BUN(mmol/L)7.29±0.83 16.16±1.74*21.53±2.26*#7.85±0.90*#△Cr(μmol/L)12.73±1.16 18.76±1.45*23.76±2.14*#13.09±1.24*#△
2.4 各组小鼠肾组织病理学变化
空白对照组小鼠肾组织结构未见明显异常损伤。与空白对照组相比,SAP 组、PTX3 组和anti-PTX3 组小鼠肾小管伴有炎症细胞浸润,肾小管损伤评分升高(P<0.05);与SAP 组相比,PTX3 组小鼠肾组织结构损伤加重,肾小管损伤评分明显升高(P<0.05),anti-PTX3组肾组织病理学变化明显改善,肾小管结构完整性更佳,肾小管损伤评分明显降低(P<0.05);与PTX3组相比,anti-PTX3 组肾小管损伤显著降低(P<0.05),见图3。
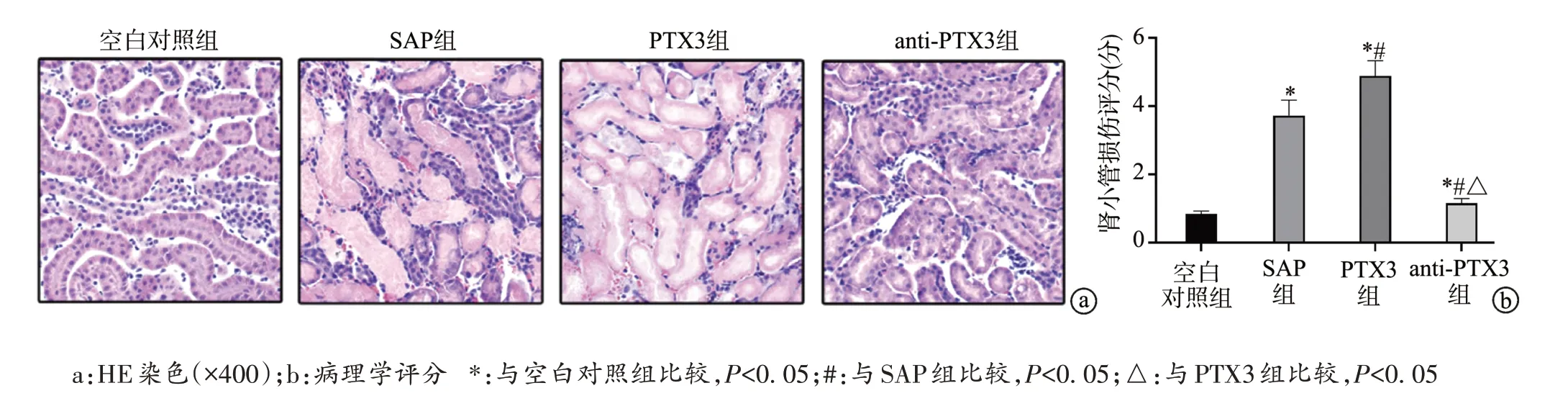
图3 小鼠肾组织病理学变化
2.5 各组小鼠肾组织细胞凋亡率比较
与空白对照组相比,SAP 组、PTX3 和anti-PTX3 组小鼠细胞凋亡率升高(P<0.05);与SAP 组相比,PTX3组小鼠细胞凋亡率明显升高(P<0.05),anti-PTX3组小鼠细胞凋亡率明显降低(P<0.05);与PTX3 组相比,anti-PTX3 组小鼠细胞凋亡率明显降低(P<0.05),见图4。
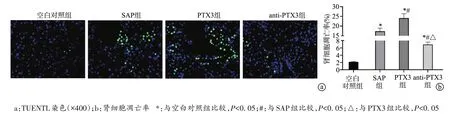
图4 肾组织细胞凋亡情况
2.6 各组小鼠IL-6、TNF-α、IL-4和IL-13水平比较
与空白对照组相比,SAP 组、PTX3 组和anti-PTX3组小鼠血清和胰腺组织中IL-6 和TNF-α 水平升高(P<0.05),IL-4 和IL-13 水平明显降低(P<0.05);与SAP 组相比,PTX3 组小鼠血清和胰腺组织中IL-6 和TNF-α水平明显升高(P<0.05),IL-4和IL-13水平明显降低(P<0.05),anti-PTX3 组小鼠血清和胰腺组织中IL-6和TNF-α 水平明显降低(P<0.05),IL-4和IL-13水平明显升高(P<0.05);与PTX3组相比,anti-PTX3组小鼠血清和胰腺组织中IL-6 和TNF-α 水平明显降低(P<0.05),IL-4 和IL-13 水平明显升高(P<0.05),见表2、3。
表2 各组小鼠血清IL-6、TNF-α、IL-4和IL-13水平比较(±s,n=10,pg/mL)

表2 各组小鼠血清IL-6、TNF-α、IL-4和IL-13水平比较(±s,n=10,pg/mL)
*:与空白对照组比较,P<0.05;#:与SAP组比较,P<0.05;△:与PTX3组比较,P<0.05
组别空白对照组SAP组PTX3组anti-PTX3组IL-6 43.52±6.78 196.34±21.57*262.48±33.62*#119.23±13.59*#△TNF-α 24.69±4.18 77.56±8.94*116.27±12.69*#48.35±6.68*#△IL-4 156.78±16.14 93.49±11.87*62.56±8.44*#136.20±12.60*#△IL-13 175.06±18.83 113.49±15.67*71.78±8.40*#152.17±14.87*#△
表3 各组小鼠胰腺组织IL-6、TNF-α、IL-4和IL-13水平比较(±s,n=10,pg/mL)

表3 各组小鼠胰腺组织IL-6、TNF-α、IL-4和IL-13水平比较(±s,n=10,pg/mL)
*:与空白对照组比较,P<0.05;#:与SAP组比较,P<0.05;△:与PTX3组比较,P<0.05
组别空白对照组SAP组PTX3组anti-PTX3组IL-6 68.47±5.64 329.86±26.35*453.86±29.75*#148.73±17.83*#△TNF-α 43.76±5.29 129.74±11.25*204.82±24.85*#73.78±12.62*#△IL-4 285.48±24.73 128.38±16.48*79.27±6.62*#197.58±20.61*#△IL-13 387.72±31.26 185.29±11.83*113.49±13.25*#274.94±23.61*#△
2.7 各组小鼠M1 型和M2 型巨噬细胞表型标志物蛋白水平比较
与空白对照组相比,SAP 组、PTX3 组和anti-PTX3组小鼠iNOS和CD16/32蛋白表达明显升高(P<0.05),CD206 和Arg-1 蛋白表达明显降低(P<0.05);与SAP组相比,PTX3 组小鼠iNOS 和CD16/32 蛋白表达明显升高(P<0.05),CD206 和Arg-1 蛋白表达明显降低(P<0.05),anti-PTX3 组小鼠iNOS 和CD16/32 蛋白表达明显降低(P<0.05),CD206 和Arg-1 蛋白表达明显升高(P<0.05);与PTX3 组相比,anti-PTX3 组小鼠iNOS 和CD16/32 蛋白表达明显降低(P<0.05),CD206和Arg-1蛋白表达明显升高(P<0.05),见图5。
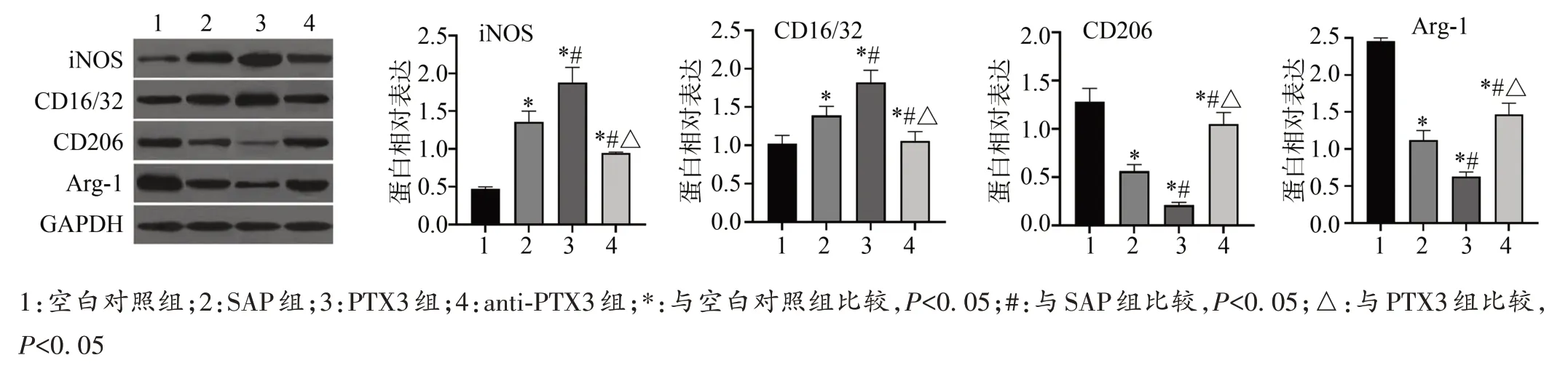
图5 Western blot检测小鼠iNOS、CD16/32、CD206和Arg-1蛋白表达
2.8 各组小鼠肾组织中M1 型和M2 型巨噬细胞比例比较
与空白对照组相比,SAP组小鼠M1型巨噬细胞比例明显升高(P<0.05),M2 型巨噬细胞比例明显降低(P<0.05);与SAP 组相比,PTX3 组小鼠M1 型巨噬细胞比例明显升高(P<0.05),M2 型巨噬细胞比例明显降低(P<0.05),anti-PTX3 组小鼠M1 型巨噬细胞比例明显降低(P<0.05),M2 型巨噬细胞比例明显升高(P<0.05);与PTX3 组比较,anti-PTX3 组小鼠M1 型巨噬细胞比例明显降低(P<0.05),M2 型巨噬细胞比例明显升高(P<0.05),见表4。
表4 各组小鼠肾组织中M1 型和M2 型巨噬细胞比例比较(±s,n=10,%)

表4 各组小鼠肾组织中M1 型和M2 型巨噬细胞比例比较(±s,n=10,%)
*:与空白对照组比较,P<0.05;#:与SAP 组比较,P<0.05;△:与PTX3组比较,P<0.05
组别空白对照组SAP组PTX3组anti-PTX3组M1型巨噬细胞比例1.35±0.08 6.20±0.27*13.82±0.84*#3.64±0.21*#△M2型巨噬细胞比例5.16±0.37 2.18±0.09*1.23±0.05*#3.45±0.12*#△
3 讨论
SAP 被认为是导致危重症患者发生AKI的主要危险因素,其发病率不断上升[12]。AKI 以血清Cr 和BUN升高为特征,是SAP 的严重并发症,病死率高,是SAP患者常见的死亡原因之一[13]。SAP 患者发生AKI 的机制可能涉及多种因素。因此,研究SAP 诱导的肾损伤过程及潜在发病机制可能为治疗SAP提供新方向。
PTX3是一种新型的AKI标志物,与慢性肾损伤有关,其可引起急性缺血性肾损伤[14-15],但具体机制尚不清楚。研究表明,PTX3在AKI患者的血清和尿液中高表达[5]。本研究建立了SAP 小鼠模型,并通过过表达和敲减PTX3 探究其在SAP 小鼠中的作用,结果显示,与空白对照组相比,SAP 组小鼠存在明显的胰腺和肾损伤,且过表达PTX3 后,小鼠症状加重,而敲低PTX3后,小鼠症状减轻,以上结果提示PTX3 对SAP 诱导的肾损伤具有促进作用,与相关研究[14-15]报道的PTX3 可作为肾损伤的标志物相一致,但PTX3促进AKI发展的具体机制仍不清楚。
炎症渗出和炎症介质的过度释放是SAP 肾损伤的重要机制。有研究发现,炎症细胞(包括巨噬细胞、中性粒细胞和树突状细胞)主动进入胰腺组织,诱导TNF-α 和IL-6 等炎症细胞因子的快速产生和释放,在局部胰腺炎症和全身并发症中起重要作用[16]。TNF-α、IL-1、IL-6 和IL-8 等通过促进炎症细胞活化和向肾募集,增加肾小球通透性,引起肾小管和间质组织的损伤,促进AKI的毒性损伤[17]。有研究表明,胰腺炎患者血浆中PTX3 水平升高,PTX3 水平与胰腺炎患者IL-6、IL-8、TNF-α及APACHEⅡ评分、Ranson评分均呈显著正相关[14-15]。本研究结果显示,相比于空白对照组,SAP 组小鼠PTX3 表达升高,促炎因子IL-6 和TNF-α水平明显升高,抑炎因子IL-4和IL-13水平明显降低,过表达PTX3 则加重上述变化,而敲低PTX3 后则可逆转上述变化。表明PTX3 可促进SAP 诱导的肾损伤小鼠的炎症反应。
PTX3 可通过炎症因子(IL-1β、IL-6 和TNF-α)、脂多糖或外膜蛋白A等刺激,增强巨噬细胞的吞噬功能,调节补体激活或直接与受体结合改变巨噬细胞分化和极化来调节巨噬细胞反应,促进机体天然免疫[18]。Th1细胞分泌IFN-γ 和TNF-α,刺激巨噬细胞向促进炎症的M1型分化,而IL-4和IL-13主要由Th2细胞分泌,诱导巨噬细胞向M2表型分化[19]。有研究表明,在永生化异位子宫内膜异位基质细胞中,补体成分3/PTX3通过促进THP1 巨噬细胞分泌多种细胞因子,诱导巨噬细胞M1 表型分化[20]。本研究结果显示,过表达PTX3可上调SAP 小鼠肾组织中M1型巨噬细胞标志物iNOS和CD16/32 表达及M1 型巨噬细胞比例,下调M2 型巨噬细胞标志物CD206、Arg-1 表达及M2 型巨噬细胞比例,而敲减PTX3 则可逆转上述变化。推测PTX3 可能促进SAP诱导的肾损伤小鼠肾组织中巨噬细胞M1/M2的转化。
综上所述,PTX3 可能通过促进巨噬细胞向M1 型分化,抑制M2 型分化,促进小鼠肾组织的炎症反应,进而促进SAP 小鼠诱发肾组织细胞凋亡和肾损伤。本研究结果为明确SAP诱发AKI的发病机制及开发新的治疗靶点提供了新的科学依据。

