仑伐替尼联合TACE治疗中晚期肝癌的疗效及对血清Ki-67、PCNA、GP73、GPC-3水平的影响
胡邵宁,朱书渊,魏燕斌
胡邵宁,魏燕斌,丽水市第二人民医院老年科 浙江省丽水市 323000
朱书渊,丽水市第二人民医院消化内科 浙江省丽水市 323000
胡邵宁,主治医师,研究方向为老年病学.
0 引言
肝癌是临床常见消化道恶性肿瘤,据统计,肝癌发病率在所有恶性肿瘤中居于第三位,死亡率居于第二位,已成为全球范围内严重的公共卫生问题之一[1,2].早期肝癌无明显临床症状,多数患者就诊时已进展至中晚期,丧失最佳手术根治时间[3].近年来,肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)成为临床治疗中晚期肝癌的主要手段,可通过阻断肿瘤组织血供控制肿瘤增殖、侵袭,从而达到抗肿瘤的目的[4].但研究表明[5,6],TACE术后出现的缺氧缺血现象会促使肿瘤新生血管形成,增加肿瘤复发风险,是TACE治疗失败的重要因素.仑伐替尼属于抗血管生成药物,可高选择性地结合生长因子受体,竞争性抑制生长因子与其受体结合,从而发挥抗肿瘤作用[7].目前关于仑伐替尼联合TACE的应用价值仍缺乏大量循证依据.为此,本研究尝试探究仑伐替尼联合TACE治疗中晚期肝癌的疾病缓解率、不良反应的影响.报告如下.
1 材料和方法
1.1 材料 回顾性选取我院2018-09/2021-08中晚期肝癌患者102例作为研究对象,按照治疗方案不同分组,各51例.两组年龄、性别、肿瘤直径、巴塞罗那分期、肝功能Child-Pugh分级、远处转移、合并门脉癌栓、慢性肝炎等一般资料均衡可比(P>0.05),见表1.本研究经我院伦理委员会审批通过.

表1 两组一般资料比较
(1)纳入标准: 均基于《原发性肝癌诊疗规范(2017年版)》标准经影像学(腹部彩超、肝脏CT等)、病理学(穿刺活检)检查首次确诊为原发性肝癌;预计生存期>6 mo;符合TACE治疗指征;患者及家属均知情,自愿签订知情同意书;治疗前肾功能正常;临床资料完整;(2)排除标准: 伴有活动性出血者;合并精神病史、认知异常者;心脑肾肺等其他重要脏器功能异常者;存在其他肿瘤者;凝血功能异常者;对本研究药物过敏或存在药物禁忌者.
1.2 方法 (1)治疗方法根据临床病理特征制定: 对照组采取TACE治疗,患者均取仰卧位,常规消毒铺巾,局麻,采用改良Seldinger技术经右股动脉穿刺置管,在导丝引导下将导管(5F)置入腹腔,行肝动脉造影,仔细观察肿瘤病灶部位、大小及血供等情况,将洛铂(海南长安国际制药有限公司,批准文号: 国药准字H20050308,规格: 10 mg)40 mg、盐酸表柔比星(浙江海正药业股份有限公司,批准文号: 国药准字H19990279,规格: 10 mg)40 mg采用明胶海绵辅助栓塞处理.术后下肢严格制动8 h,卧床24 h,密切监测患者生命体征.观察组在对照组基础上给予仑伐替尼(Eisai GmbH,批准文号: HJ20200044,规格: 4 mg),口服,体质量<60 kg者起始剂量为8 mg/次,1次/d,≥60 kg者起始剂量为12 mg/次,1次/d,并根据患者实际情况合理调整剂量,持续用药2 mo;(2)检测方法: 以化学发光法测定糖类抗原199(carbohydrate antigen 199,CA199)水平,采用酶联免疫吸附法检测血清甲胎蛋白(alpha fetoprotein,AFP)、Ki-67、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、高尔基体蛋白73(golgi protein 73,GP73)、磷脂酰肌醇蛋白聚糖-3(glypicans-3,GPC-3)水平,采用日本日立有限公司全自动生化分析仪(型号为7170A)检测血清谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)、总胆红素(total bilirubin,TBIL)水平.
1.3 疗效评价标准[8]肿瘤病灶消失,维持时间>4 wk为完全缓解(complete remission,CR);肿瘤病灶缩小≥50%,维持时间>4 wk为部分缓解(partial remission,PR);肿瘤病灶缩小<50%或增加<25%为稳定(stable disease,SD);肿瘤病灶增加≥25%为进展(progressive disease,PD).将CR、PR纳入疾病缓解率.
1.4 观察指标 (1)两组疾病缓解率;(2)两组治疗前、治疗2 mo后肿瘤标志物血清AFP、CA199水平;(3)两组治疗前、治疗2 mo后肿瘤恶性程度指标血清Ki-67、PCNA、GP73、GPC-3水平;(4)两组治疗前、治疗2 mo后血清ALT、AST水平;(5)两组不良反应;(6)两组生存预后,随访12 mo统计对比两组生存率.
统计学处理采用统计学软件SPSS 22.0处理数据,计量资料均确认具备方差齐性且近似服从正态分布,以mean±SD描述,组间比较采用独立样本t检验;计数资料用n(%)表示,χ2检验.P<0.05表明差异有统计学意义.
2 结果
2.1 两组疾病缓解率 观察组疾病缓解率高于对照组(P<0.05),见表2.

表2 两组疾病缓解率比较n(%)
2.2 两组肿瘤标志物 两组治疗前血清AFP、CA199水平差异无统计学意义;两组治疗2 mo后血清AFP、CA199水平较治疗前下降,观察组低于对照组(P<0.05),见表3.

表3 两组治疗前后肿瘤标志物比较(mean±SD)
2.3 两组血清Ki-67、PCNA、GP73、GPC-3水平 两组治疗前血清Ki-67、PCNA、GP73、GPC-3差异无统计学意义;治疗2 mo后两组血清Ki-67、PCNA、GP73、GPC-3低于治疗前,观察组低于对照组(P<0.05),见表4、图1.

图1 两组术前、治疗2 mo后Ki-67、PCNA、GP73、GPC-3比较.A: 两组术前、治疗2 mo后Ki-67比较;B: 两组术前、治疗2 mo后PCNA比较;C: 两组术前、治疗2 mo后GP73比较;D: 两组术前、治疗2 mo后GPC-3比较.Ki-67: 细胞增殖核抗原67;PCNA: 增殖细胞核抗原;GP73: 浸润转移指标高尔基体蛋白73;GPC-3: 磷脂酰肌醇蛋白聚糖.

表4 两组治疗前后血清Ki-67、PCNA、GP73、GPC-3水平比较(mean±SD)
2.4 两组肝功能指标 两组治疗前、治疗2 mo后血清ALT、AST、ALP、TBIL水平差异无统计学意义,见表5.

表5 两组治疗前后肝功能指标比较(mean±SD)
2.5 两组不良反应 观察组不良反应与对照组无明显差异,见表6.
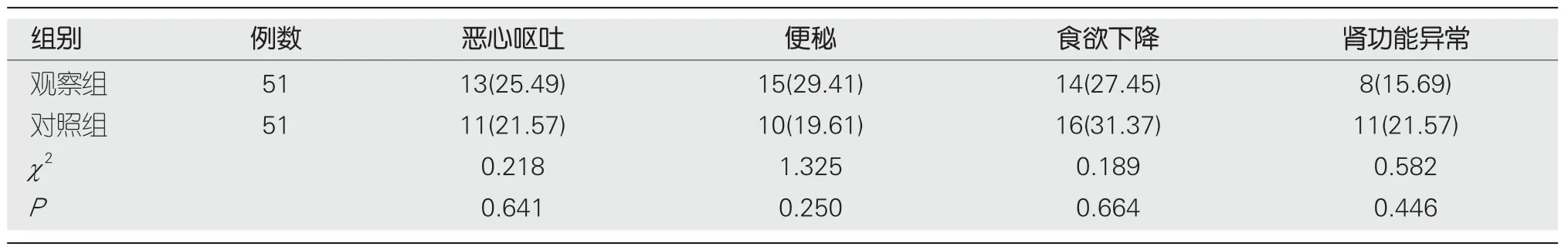
表6 两组不良反应比较n(%)
2.6 两组生存预后 随访12 mo,观察组失访1例,对照组失访2例.观察组12 mo生存率为86.00%(43/50)高于对照组69.39%(34/49)(χ2=3.951,P=0.047).
3 讨论
肝癌具有发病率高、并发症多、预后差、死亡率高等特点,相关资料显示,我国每年约有11万人死于肝癌,占全球范围内肝癌死亡人数的45%左右,严重威胁我国居民生命健康及生存质量,防治形势极为严峻[9,10].因此,积极探索较为可靠、安全的治疗方案成为临床重要研究方向.
TACE是临床治疗中晚期肝癌的一线治疗方法,对于无法进行手术切除治疗的中晚期肝癌患者而言,TACE可通过阻断肿瘤病灶血供达到控制肿瘤病情进展、延长生存期的目的[11].且相关研究表明[12],TACE可上调Fas在肝癌细胞中的表达,抑制Bcl-xl表达,从而加快肝癌细胞凋亡,缩小肿瘤病灶.但临床实践显示,晚期肝癌患者经TACE治疗后仅少部分肿瘤病灶完全坏死,多数肿瘤胞膜内外均可见存活的肿瘤细胞,加之其在控制肿瘤新生血管方面作用欠佳,导致术后肿瘤复发风险高,需进行重复治疗,极易损伤肝功能[13].Makker等[14]报道证实,仑伐替尼用于晚期子宫内膜癌具有良好治疗效果.为此,本研究尝试在TACE基础上给予仑伐替尼治疗中晚期肝癌患者,结果显示,观察组疾病缓解率显著高于对照组,说明仑伐替尼联合TACE能显著提高治疗效果.仑伐替尼属于新型靶向药物,作为一种多靶点受体络氨酸激酶抑制剂,对肿瘤血管生成相关通路具有控制作用,其主要作用靶点包括cKIT、成纤维细胞生长因子受体1-4、血管内皮生长因子受体1-3等,可经由以上靶点抑制肿瘤血管生成,还可阻滞肿瘤细胞分裂、增殖,从而加快肿瘤细胞坏死、凋亡,达到抗肿瘤的目的,有利于延长患者生存期[15,16].AFP、CA199是临床常见肿瘤标志物,可有效反映肿瘤发生发展情况[17].Ki-67、PCNA、GP73、GPC-3作为细胞增殖相关,可通过调节生长因子与受体之间的相互作用,蛋白酶、胞外基质等结合,影响信号传递,对细胞生长、分化、肿瘤形成、转移发挥重要作用[18,19].本研究发现,与TACE单独治疗相比,仑伐替尼联合TACE治疗中晚期肝癌患者能显著降低血清AFP、CA199、Ki-67、PCNA、GP73、GPC-3水平,提示两者联合在控制肿瘤进展、抑制肿瘤细胞生长方面具有明显优势.分析原因,TACE能有效阻断病灶血流,在此基础上,仑伐替尼可有效抑制肿瘤新生血管生成,控制肿瘤病灶侧支循环,弥补TACE的局限性,使得对肿瘤病灶血供的切断作用更为彻底有效,从而致使肿瘤细胞无法增殖、侵袭,进而明显降低肿瘤标志物水平[20,21].故仑伐替尼联合TACE在临床应用中具有较为突出的优势.本研究结果还显示,两者联合能够显著提高生存率,与联合治疗时疗效增强有关.
此外,除保障治疗效果外,用药安全性亦是需要关注的重要因素[22,23].本研究结果显示,治疗2 mo后,两组血清ALT、AST、ALP、TBIL水平及不良发生率差异无统计学意义,说明仑伐替尼联合TACE治疗不会增加肝功能损伤风险及药物不良反应.但本研究中,观察组胃肠道反应发生率高达29.41%,提示临床在实际应用仑伐替尼中应重点关注胃肠道反应发生情况,并及时采取对症处理措施,控制胃肠道症状,或视具体情况停药.需注意的是,若在服用仑伐替尼过程中患者出现动脉血栓栓塞,则应永久停用仑伐替尼.本研究局限性在于,纳入样本少、随访时间短,可能造成数据偏移,需扩大样本量、延长随访时间,以获取更为全面的数据支持.
4 结论
综上可知,仑伐替尼联合TACE治疗中晚期肝癌能提高疾病缓解率,降低血清Ki-67、PCNA、GP73、GPC-3、CA199及AFP水平,减轻肿瘤恶性程度,提高生存率,且不增加肝功能损伤风险与药物不良反应.
文章亮点
实验背景
肝癌是全球最常见的恶性肿瘤之一,病死率较高,肝切除治疗后5年总存活率约50%,但临床实际工作中仅10%-30%患者符合切除术指征.目前中晚期肝癌多采用放化疗、免疫治疗、靶向药物治疗等,但单一方法疗效不理想.本研究联合化疗、药物治疗,旨在提高临床疗效.
实验动机
探究仑伐替尼联合肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)治疗中晚期肝癌的的疗效,拟分析该联合治疗方案对增殖指标Ki-67、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、高尔基体蛋白73(golgi protein 73,GP73)、磷脂酰肌醇蛋白聚糖(glypicans-3,GPC-3)水平的影响,从肿瘤增殖、浸润、转移方面观察对中晚期肝癌的治疗效果,为临床治疗提供新思路.
实验目标
观察仑伐替尼、TACE联合应用对中晚期肝癌肿瘤标志物、血清Ki-67、PCNA、GP73、GPC-3水平的影响,发现该方案可有效降低上述指标水平,在常规肿瘤标志物以外发现了抗肿瘤过程中的新型标志物.
实验方法
研究中以治疗方案不同进行分组,检测两组肿瘤标志物、肝功能及相关血清指标,随访12 mo观察治疗后生存率,创新性探究仑伐替尼联合TACE用于中晚期肝癌的影响.
实验结果
研究结果表明仑伐替尼、TACE联合治疗确能提高中晚期肝癌疾病缓解率,在不增加肝功能损伤及不良反应的前提下,可有效调节病情进展过程中相关因子(AFP、CA199、Ki-67、PCNA、GP73、GPC-3)的异常表达;对临床延长患者生存期具有重要指导意义.
实验结论
研究在现有化疗、药物抗肿瘤的中晚期肝癌治疗方法基础上,进行仑伐替尼、TACE联合的应用,发现二者联合应用的效果优于单独化疗疗效,为中晚期肝癌治疗提供了新思路,从消杀恶性肿瘤细胞、一致肿瘤血管生成两个方面发挥协同作用,可能对未来临床抗肿瘤工作具有一定指导作用.
展望前景
未来进一步研究可吸取经验,多渠道纳入病例,进行大样本量研究,病延长随访时间,观察远期预后,进一步证实抗血管药物与化疗联合方案的抗肿瘤效果.

