川芎嗪对胃癌细胞增殖、迁移、侵袭及糖酵解的调控作用
王韩英,陈 勇,朱双媚
王韩英,陈勇,朱双媚,丽水市人民医院肿瘤放化疗科 浙江省丽水市 323000
王韩英,主治医师,主要从事肿瘤方面的基础与临床研究.
0 引言
据国家癌症中心2022年发布的全国癌症统计学数据显示,胃癌作为常见的消化系统肿瘤,其发病例数和死亡率均位居第三[1].临床上胃癌早期筛出率较低,常见为中晚期胃癌患者,手术及放化疗效果有限[2,3],寻找高效的抗肿瘤药物及靶点依旧是临床胃癌辅助治疗的重点研究领域.2000年和2011年Weinberg及其研究伙伴[4,5]总结了包括能量代谢异常、持续的增殖信号、逃避生长抑制以及侵袭转移等在内的肿瘤十大特征.能量代谢在肿瘤细胞的恶性增殖过程中具有重要的作用,研究显示,胃癌细胞的糖酵解代谢十分活跃,符合Warburg效应的代谢特征[3,6].抑制肿瘤细胞的糖酵解代谢对抑制肿瘤的生长具有重要的意义,也为抗肿瘤药物的研发提供了新的方向和思路.中医药在肿瘤的治疗上具有独特的优势,川芎嗪(tetramethylpyrazine,TMP)是中药川芎的主要活性成分,目前常用于辅助治疗心脑血管疾病.但现代药理学研究显示,TMP具有抗氧化、抗炎、抗肿瘤等多效作用,且对机体多个系统均具有调节效应,临床应用前景广阔[7-9].本研究以胃癌细胞株为对象,评估TMP对其增殖、迁移的影响,并从葡萄糖代谢的角度初步探讨其可能的作用机制,为TMP的临床应用提供一定理论基础.
1 材料和方法
1.1 材料 细胞培养用RPMI-1640培养基购自美国Invitrogen公司;川芎嗪(TMP,纯度>98%)购自上海源叶生物科技有限公司;胃癌细胞株AGS和SGC7901购自武汉中国典型培养物保藏中心;蛋白激酶B(protein kinase B,AKT)、p-AKT和β-actin抗体购自美国Cell Signaling公司;葡萄糖转运蛋白1(glucose transporter-1,GLUT1)、己糖激酶2(hexokinase 2,HK2)及乳酸脱氢酶A(lactate dehydrogenase A,LDHA)抗体购自美国Abcam公司;CCK-8细胞增殖检测试剂盒购自上海莼试生物技术有限公司;葡萄糖(glucose,GLU)、乳酸(lactic acid,LD)、己糖激酶(hexokinase,HK)及乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自南京建成生物工程研究所;其余试剂均为国产市售分析纯.
1.2 方法
1.2.1 细胞培养及CCK-8细胞活力测定: 胃癌细胞株AGS和SGC7901生长于含10%胎牛血清、100 U/mL青霉素及100 U/mL链霉素的RPMI-1640细胞培养基中,培养条件: 5%二氧化碳、37 ℃细胞培养箱,定期更换培养基并传代,维持细胞良好的生长状态.将消化后的AGS和SGC7901细胞(5000个/孔)分别接种至细胞培养皿中,同步化处理后加TMP浓度梯度设置: (0、5、10、20、40、80) μM分别干预24 h、48 h、72 h.每孔中加入10 μL的CCK-8试剂,孵育2 h后经酶标仪检测450 nm波长处各孔的吸光度值(OD).每组均设置三个复孔,结果取其均值,同时设不加细胞的单孔作为空白对照;绘制细胞生长曲线.实验重复3次(n=3).
1.2.2 细胞增殖检测: 采用细胞克隆形成实验检测细胞增殖情况.将生长良好的细胞接种至培养皿中,贴壁同步化后,依据实验分组加药干预至实验预定的时间.吸弃培养基,加4%多聚甲醛固定后,结晶紫染色并于显微镜下拍照计数细胞克隆数,计算细胞克隆形成率.细胞分组设置: 对照组(control,Ctrl)、低剂量TMP组(TMP-L,培养基中TMP浓度为10 μM)、中剂量TMP组(TMP-M,培养基中TMP浓度为20 μM)、高剂量TMP组(TMP-H,培养基中TMP浓度为40 μM).
1.2.3 细胞迁移检测: 采用transwell细胞迁移实验检测细胞的迁移.依据实验分组设计,将AGS和SGC7901细胞对应的各自的细胞悬液加入transwell小室的上室中,下室中加入相应的培养基,置于细胞培养箱中继续培养48 h.移除上室表面未迁移的细胞,迁移细胞经甲醇固定后加结晶紫染液染色,置于显微镜下拍照观察并计算细胞迁移率.
1.2.4 细胞侵袭检测: 采用transwell细胞侵袭实验检测细胞的侵袭能力.预先将Matrigel胶均匀铺至Transwell小室底部膜的上室面,37 ℃培养箱中孵育,使基质胶聚合成薄膜,用以模拟细胞外基质;而后将各组处理的AGS和SGC7901细胞对应的各自的细胞悬液加入transwell小室的上室中,操作步骤同1.2.3,最后经结晶紫染色,并置于显微镜下拍照观察并计算细胞侵袭率.
1.2.5 细胞葡萄糖代谢指标检测: AGS和SGC7901细胞分别经相应的上述分组处理后,均依据公司提供的试剂盒说明书进行GLU摄取、LD产量、HK及LDH指标的检测操作.
1.2.6 氧消耗速率(oxygen consumption rate,OCR)及细胞外酸化率(extra-cellular acidification rate,ECAR)检测: 采用细胞能量分析仪(Seahorse XF24,美国Seahorse Bioscience公司)检测细胞经TMP干预后OCR以及ECAR.将胃癌细胞株AGS和SGC7901细胞分别接种至专用培养板(10000个/孔).依据说明书操作如下: 贴壁后更换细胞培养基为检测液,先监测基础条件下的OCR和ECAR,依次加药(寡霉素、解偶联剂FCCP、抗霉素A)后检测并分析OCR和ECAR的结果.
1.2.7 细胞相关蛋白表达水平检测: 采用western blot实验检测各组胃癌细胞株AGS和SGC7901经TMP干预后葡萄糖代谢相关蛋白的表达以及AKT/GLUT1信号通路的活性.RIPA裂解并离心收集细胞蛋白,BCA蛋白定量法对细胞蛋白进行定量后,采用SDS-PAGE蛋白凝胶电泳上样并分离目的蛋白,之后通过电转法将目的蛋白转移至PVDF膜上.5%的脱脂牛奶孵育封闭后,按说明书要求依次加入相应的一抗和二抗孵育,暗室中利用ECL化学发光液显影,定影并对结果进行灰度半定量分析.
统计学处理所得数据录入GraphPad 8.3软件中进行统计学分析.实验结果以均数±标准差(mean±SD)表示,多组间的比较采用方差分析,各组均数间的两两比较用Bonferroni校正的t检验,P<0.05表示有显著差异.
2 结果
2.1 TMP对胃癌细胞活力的影响 CCK-8法检测细胞活力的结果显示如图1所示,随TMP浓度及作用时间增加,胃癌细胞AGS和SGC7901的活力均逐步降低.本实验后续选取10 μM、20 μM和40 μM的TMP处理胃癌细胞48 h分别作为低、中、高剂量处理组.

图1 川芎嗪对胃癌细胞增殖活力的影响. A: CCK-8法检测的梯度浓度(0 μM、5 μM、10 μM、20 μM、40 μM和80 μM)TMP干预AGS细胞不同时间(24 h、48 h、72 h)后的细胞活力数据的统计结果;B: CCK-8法检测的梯度浓度(0 μM、5 μM、10 μM、20 μM、40 μM和80 μM)TMP干预SGC7901细胞不同时间(24 h、48 h、72 h)后的细胞活力数据的统计结果.TMP: 川芎嗪.n=3.
2.2 TMP对胃癌细胞增殖和迁移的影响 克隆形成实验检测胃癌细胞的增殖情况,结果如图2A所示,TMP可剂量依赖性抑制AGS和SGC7901细胞增殖形成的细胞群落;统计学结果显示,中、高剂量组克隆形成数显著低于对照组(P<0.05).
Transwell细胞迁移及侵袭实验检测胃癌细胞AGS和SGC7901的迁移情况及侵袭情况,结果如图2B和C所示,TMP可剂量依赖性抑制AGS和SGC7901细胞迁移及侵袭;统计学分析表明,中、高剂量组细胞迁移率和侵袭率均显著低于对照组(P<0.05).
2.3 TMP对胃癌细胞葡萄糖代谢的影响 检测结果如表1所示,中、高剂量的TMP可显著抑制胃癌细胞对葡萄糖的利用,并抑制细胞内乳酸生成;同时中、高剂量TMP组的OCR和ECAR值较对照组显著降低.
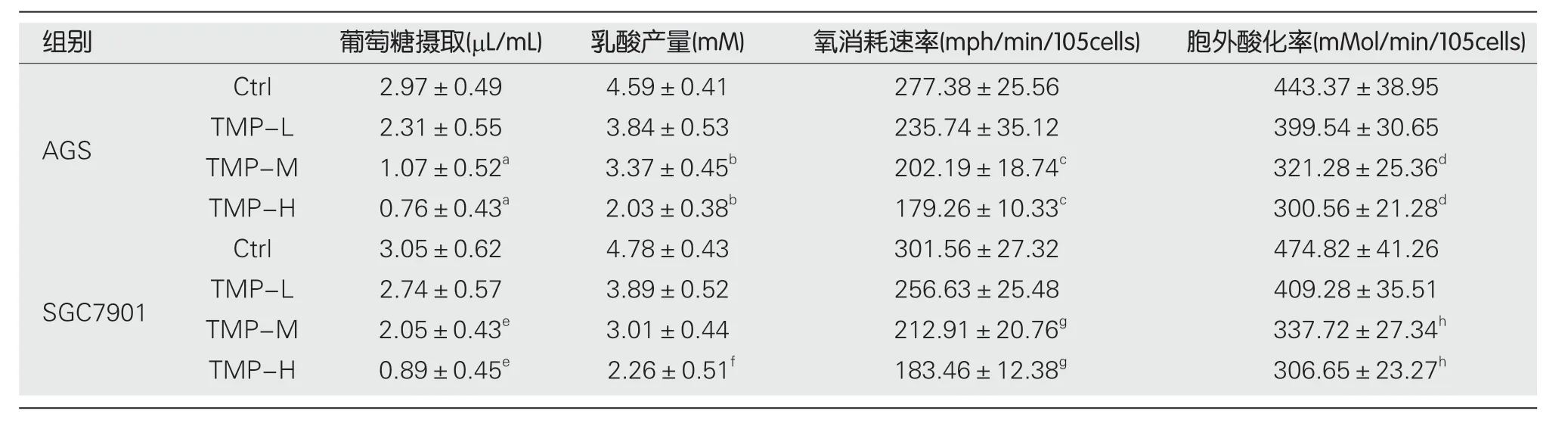
表1 川芎嗪对胃癌细胞葡萄糖代谢的影响
2.4 TMP对胃癌细胞葡萄糖代谢过程中关键酶活性的影响 进一步检测TMP对胃癌细胞葡萄糖代谢过程中关键酶HK、LDH活性的影响,结果显示(图3),高剂量TMP可显著抑制HK和LDH的活性,差异有统计学意义(P<0.05).

图3 川芎嗪对胃癌细胞葡萄糖代谢过程中关键酶活性的影响.A: HK活性的统计学结果,n=3,mean±SD,aP<0.05,bP<0.01 vs Ctrl组AGS细胞;cP<0.01 vs Ctrl组SGC7901细胞.B: LDH活性的统计学结果;n=3,mean±SD,aP<0.05 vs Ctrl组AGS细胞;bP<0.05 vs Ctrl组SGC7901细胞.Ctrl: 对照组;TMP-L: 低剂量川芎嗪组;TMP-M: 中剂量川芎嗪组;TMP-H: 高剂量川芎嗪组;HK: 己糖激酶;LDH: 乳酸脱氢酶.
2.5 TMP对胃癌细胞AKT/GLUT1信号及葡萄糖代谢相关蛋白的影响 Western blot检测结果如图4所示,与对照组相比,TMP孵育可显著降低胃癌AGS及SGC7901细胞中磷酸化AKT的水平,总AKT蛋白表达不变;同时可抑制AGS及SGC7901细胞中GLUT1、HK2及LDHA的蛋白表达水平.

图4 川芎嗪对胃癌细胞AKT/GLUT1信号及葡萄糖代谢相关蛋白的影响. A: AGS细胞,n=3,mean±SD,aP<0.05,cP<0.05,eP<0.05,gP<0.05,bP<0.01,dP<0.01,fP<0.01,gP<0.01 vs Ctrl组;B: SGC7901细胞,aP<0.05,eP<0.05,bP<0.01,cP<0.05,dP<0.01,fP<0.01 vs Ctrl组.Ctrl: 对照组;TMP-L: 低剂量川芎嗪组;TMP-M: 中剂量川芎嗪组;TMP-H: 高剂量川芎嗪组.
3 讨论
TMP具有抗肿瘤活性,在胃癌中的研究显示,TMP可通过激活ROS/AMPK通路促进SGC7901胃癌细胞经线粒体途径凋亡[9].另一项研究也同样表明[10],在SGC7901胃癌细胞中TMP可通过核因子κB及周期调控因子发挥抑制增殖及促凋亡的效应.本研究旨在探讨TMP对AGS及SGC7901胃癌细胞增殖及迁移能力的影响以及其中涉及的能量代谢异常问题.结果显示TMP可浓度依赖性降低AGS及SGC7901胃癌细胞活力,并抑制其增殖及迁移.
本实验进一步从能量代谢的角度研究了TMP抑制胃癌细胞生长可能涉及的作用机制.依据Warburg效应,AGS和SGC7901胃癌细胞与其他肿瘤细胞类似,以有氧糖酵解代谢为主要的能量来源;为维持自身无限增殖的信号,胃癌细胞对一方面培养环境中葡萄糖的需求量较大,另一方面有氧糖酵解代谢会生成大量的乳酸,维持其生存所需的酸性微环境[11,12].故而本研究首先检测了胃癌细胞及培养体系中葡萄糖的消耗量和乳酸的生成量,结果显示经TMP干预后,AGS细胞及SGC7901细胞消耗的葡萄糖量及乳酸的生成量显著降低.OCR测量细胞的耗氧量可以反应线粒体的氧化磷酸化作用,ECAR测定的培养基酸化速率也是一种检测葡萄糖代谢的方法.检测结果表明TMP可降低胃癌细胞的耗氧量和培养基酸化速率;这些结果均提示TMP可抑制AGS及SGC7901胃癌细胞利用葡萄糖进行有氧糖酵解代谢,能量代谢异常可能是导致肿瘤细胞增殖及迁移能力下降的原因之一.
肿瘤细胞有氧糖酵解代谢过程中同样需要己糖激酶、乳酸脱氢酶等关键酶的催化.胃癌细胞中HK2表达上调与细胞的恶性生物学行为密切相关[13];HK2水平降低可阻碍细胞利用葡萄糖,抑制糖酵解的顺利进行.作为乳酸生成的关键酶之一,LDHA在胃癌组织中表达显著高于癌旁正常对照组织,且LDHA的高表达与胃癌患者的不良预后密切相关[14,15].故而本研究进一步检测了胃癌细胞中,HK2和LDH的表达以及活性.结果显示,TMP可显著抑胃癌细胞中HK2和LDH的活性,同时抑制HK2和LDHA的蛋白表达.AKT信号已被证实参与调节肿瘤生长代谢,磷酸化激活AKT之后可促进肿瘤细胞膜上葡萄糖转运蛋白的表达以及转位,进而增加细胞摄取葡萄糖的速度,促进肿瘤细胞的有氧糖酵解代谢和肿瘤的生长[16,17].本研究的检测结果显示,TMP可显著抑制胃癌细胞中AKT的磷酸化和GLUT1的蛋白表达水平.以上结果提示TMP可抑制AKT/GLUT1信号轴,下调糖酵解代谢关键酶HK2和LDHA的表达,进而抑制胃癌细胞的有氧糖酵解代谢;然而该信号轴是否会对胃癌细胞其他相关的生物学行为产生影响,所涉及的具体机制如何,还需进一步的研究.
4 结论
综上所述,TMP可抑制AGS及SGC7901胃癌细胞增殖及迁移,并通过AKT/GULT1信号轴抑制胃癌细胞有氧糖酵解代谢.
文章亮点
实验背景
川芎嗪具有多种抗癌作用,而其对胃癌细胞的增殖、迁移和侵袭的影响和潜在的细胞学机制尚不完全清楚.
实验动机
糖酵解在胃癌细胞的生长以及转移中发挥巨大作用,川芎嗪抑制胃癌细胞的增殖、迁移与侵袭的过程中是否涉及抑制糖酵解并不清楚.
实验目标
评估川芎嗪对胃癌细胞增殖、迁移和侵袭的影响,并以糖酵解的角度初步探讨其涉及的细胞学机制.
实验方法
用10 μM、20 μM和40 μM川芎嗪处理胃癌细胞后,检测细胞活性、迁移与侵袭、葡萄糖代谢指标、葡萄糖代谢关键酶活性的变化;并用Western blot分析糖酵解相关蛋白的表达和蛋白激酶B/葡萄糖转运蛋白1信号活性.
实验结果
川芎嗪抑制胃癌细胞糖酵解、增殖、迁移、侵袭和蛋白激酶B/葡萄糖转运蛋白1信号活性.
实验结论
川芎嗪抑制胃癌细胞增殖及转移的作用可能涉及到抑制蛋白激酶B/葡萄糖转运蛋白1信号轴介导的糖酵解.
展望前景
川芎嗪可能是潜在的抗胃癌药剂.

