IC-离子选择电极法联测高卤废水中氟、氯和溴
于乐,韩强强,汪恒
(江西华赣瑞林稀贵金属科技有限公司,江西丰城 331100)
含卤废水是工业中常见的生产废水,其中含有大量的卤盐如氯化钠、溴化钠等,有的还含有一定量的氟离子。如果不对此类含卤废水加以处理回收,一方面会造成卤盐资源和水资源的浪费,另一方面还会造成管道的腐蚀、破坏以及水生环境的污染[1]。 含卤工业废水的成分复杂、种类多样,各种成分含量和分布变化很大,因此目前国内依旧缺少针对含卤工业废水的科学的分析方法,尤其是对废水中的氟、氯、溴等有害元素的测定方法探究较少。对含卤工业废水的分析处理往往只能通过经验总结来实现,这严重影响到对含卤工业废水的高效处理回收和利用。随着含卤工业废水处理需求量的急剧增加,亟需制定一种能准确测定高卤废水中氟、氯、溴元素的分析方法, 从而科学系统地指导处理废水回收蒸发盐以及资源循环利用。 考虑到采用传统的分析方法难以准确测定氟、氯和溴的含量[2-9],本文针对含卤工业废水氟质量浓度低,氯、溴质量浓度高的特性,探索出一种通过将试样稀释为不同的稀释倍数,利用IC-离子选择电极法联测高卤废水中氟、氯和溴量的实验方法。
1 实验部分
1.1 仪器与工作条件
本试验采用:1)PXSJ-216F 型离子选择电极(上海雷磁仪器有限公司)。环境温度为20 ℃,电极斜率为90%~100%,PF-202 氟离子复合电极,232-01 型参比电极。 2)Aquion-1200 型离子色谱仪(赛默飞世尔科技有限公司)。 阴离子色谱柱和保护柱,柱温箱温度30 ℃; 抑制器电流为112 mA; 淋洗液流速为1.0 mL/min;淋洗液浓度为45 mmol/L。
1.2 试剂及配制方法
本实验主要试剂包括:1)盐酸(ρ盐酸=1.19 g/mL);2)硝酸(ρ硝酸=1.42 g/mL);3)氢氧化钠溶液(ρ氢氧化钠=50 g/L);4)盐酸(1+1);5)总离子强度缓冲溶液(TISABI);6)氟化钠(PT);7)氯化钠(PT);8)溴化钾(PT)。 除非另有说明,本实验仅使用确认为优级纯的试剂和一级水。
试剂配制方法:1)氢氧化钠溶液的配制。称取5 g 分析纯氢氧化钠于烧杯中,用水稀释至100 mL,置于试剂瓶中。2)盐酸(1+1)的配制。称取50 mL 分析纯盐酸于烧杯中,用水稀释至100 mL,置于试剂瓶中。3)总离子强度缓冲溶液的配制。称取58.8 g 分析纯二水柠檬酸钠和85 g 硝酸钠于烧杯中, 加水溶解,用盐酸调节至中性,用水稀释至1 000 mL 容量瓶中,稀释至容量瓶刻度并摇匀。
1.3 实验方法
摇匀工业废水水样, 移取100 mL 的工业废水,用氢氧化钠溶液或者盐酸调至中性,平均分成两份。一份稀释50 倍,加入10 mL 总离子强度调节缓冲溶液,转移40 mL 至50 mL 的容量瓶,加水稀释至刻度并混匀,放置于离子选择电极上。在选定的仪器工作条件下, 各元素的校正曲线与标准系列溶液进行测定。 另一份稀释5 000 倍,转移100 mL 至100 mL的容量瓶中混匀,经预处理柱有效去除阳离子后,将其放置于Aquion-1200 型离子色谱仪上, 在选定的仪器工作条件下, 按各元素的校正曲线与标准系列溶液同时进行测定。
1.4 混合标准系列溶液的配制
1)氟标准储备液的配制。 将基准物质氟化钠在100~105 ℃的条件下烘干至恒重, 准确称取2.211 0 g溶于适量水中,然后将其全部转移至1 000 mL 的容量瓶中,用去离子水稀释至刻度,摇匀,再移入干燥的塑料瓶中贮存。此配制溶液中,氟的质量浓度为1000 μg/mL;亦可购买市售有证标准物质。
2)氯标准储备液的配制。 将基准物质氯化钠在500~600 ℃的条件下灼烧至恒重, 准确称取1.648 5 g溶于适量水中,然后将其全部转移至1 000 mL 的容量瓶中,用去离子水稀释至刻度,摇匀,再移入干燥的塑料瓶中贮存。此配制溶液中,氯的质量浓度为1000 μg/mL;亦可购买市售有证标准物质。
3)溴标准储备液的配制。 将基准物质溴化钾在100~105 ℃的条件下烘干至恒重, 准确称取1.490 0 g溶于适量水中,然后将其全部转移至1 000 mL 的容量瓶中,用去离子水稀释至刻度,摇匀,再移入干燥的棕色瓶中贮存。此配制溶液中,溴的质量浓度为1000 μg/mL;亦可购买市售有证标准物质。
4)氟标准溶液的配制。 准确移取10 mL 氟标准储备液于100 mL 的容量瓶中,用去离子水稀释至刻度,混匀。 此溶液中,氟的质量浓度为100 μg/mL。
5)氯、溴混合标准溶液的配制。 准确移取10 mL氯标准储备液和10 mL 溴标准储备液于100 mL 容量瓶中,用去离子水稀释至刻度混匀。此溶液中,氯、溴的质量浓度均为100 μg/mL。
6)氟标准系列溶液的配制。 分别移取0 mL、0.50 mL、1.00 mL、2.00 mL、5.00 mL、10.00 mL、20.00mL 氟标准溶液,依次对应置于同一组50 mL 容量瓶中,用去离子水稀释至刻度,混匀定容。
7)氯溴混合标准系列溶液的配制。 分别移取0 mL、0.50 mL、1.00 mL、2.00 mL、5.00 mL、10.00 mL、20.00 mL 氯、溴混合标准溶液,依次对应置于同一组100 mL 容量瓶中,用去离子水稀释至刻度,混匀定容。 7 组标准溶液分别标记为空白、标准1、标准2、标准3、标准4、标准5、标准6。此混合标准系列溶液中各元素的质量浓度见表1。

表1 混合标准系列溶液中各元素的质量浓度μg/mL
2 结果与讨论
2.1 仪器参数条件的选择
用氟元素标准系列溶液和试样溶液, 用所选电极依次检测,观察屏幕上显示的读数。比较被测氟元素的灵敏度及干扰情况,最终确定干扰小、背景低、信噪比高的条件为离子选择电极参数条件。
用各单元素标准溶液、 混合标准溶液和试样溶液,在所选各元素的分析线处依次扫描,观察屏幕上显示的色谱轮廓图像。 比较被测元素各谱图的灵敏度及色谱干扰情况,最终确定干扰小、背景低、信噪比高的条件为离子色谱仪参数条件。
2.2 校正曲线线性和检出限
在选定的仪器和仪器工作条件下, 使用氟标准系列溶液及氯溴混合标准系列溶液,建立校正曲线,连续测定11 次试剂空白溶液,以3 倍标准偏差计算方法检出限,10 倍标准偏差计算方法测定下限,结果见表2。

表2 校正曲线参数和检出限μg/mL
2.3 测定条件的选择
1)取样体积。在其他条件不变的情况下,分别取样10 mL、30 mL、50 mL、70 mL、100 mL 进行测定实验,根据所测定元素的代表性情况,确定最适宜的取样体积。 实验结果见表3。
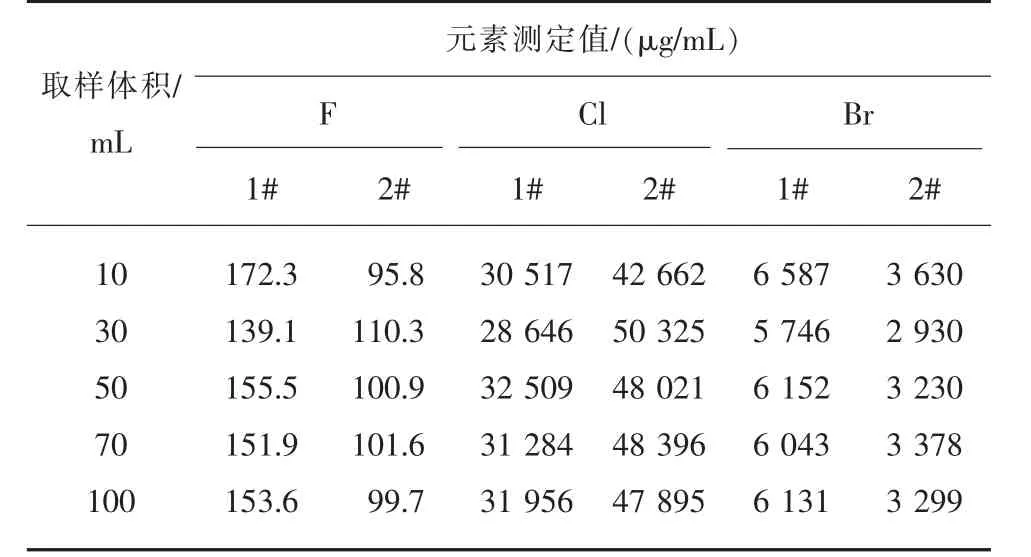
表3 取样体积对测定的影响
由表3 可知,随着取样体积的减少,样本代表性随之降低,氟、氯和溴的测定结果不稳定。 当取样体积超过50 mL 时,样品杂质偏低不影响测量,氟、氯和溴测定结果更好。考虑到离子选择电极操作方便,本文选定取样体积为50 mL。
2)溶液pH 值。 在其他条件不变的情况下,分别选择pH 值为3、5、7、9、11 的溶液进行测定实验,根据测定结果,确定最佳的溶液酸度。 实验结果见表4。
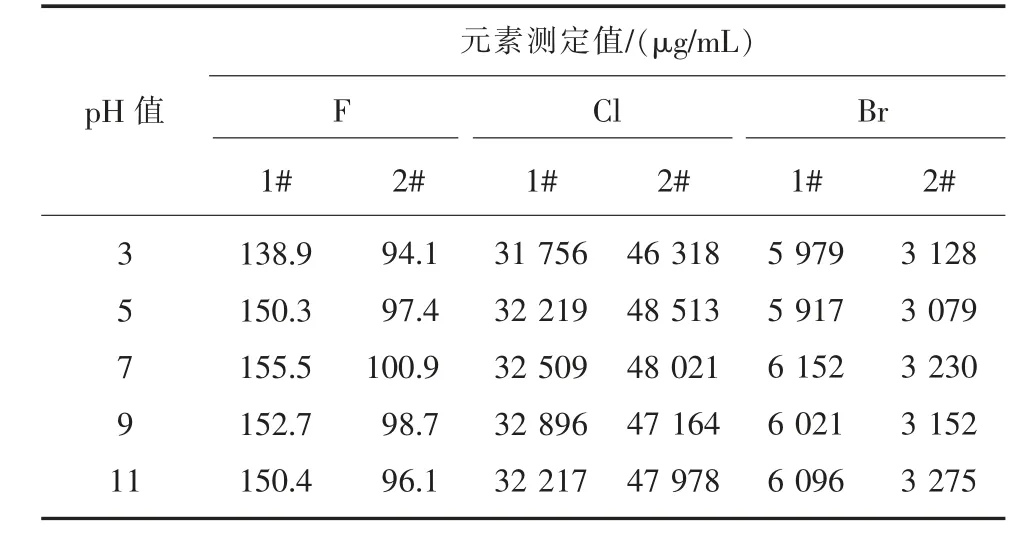
表4 酸度对测定的影响
由表4 可知,在酸性溶液中,H+离子与部分F-离子形成HF 或HF2-,会降低F-离子的质量浓度;在碱性溶液中, 电极LaF3薄膜与OH-离子发生反应而使溶液中F-离子浓度增加。 当pH=7 时,氟的测定结果最好,因此本文选定溶液pH=7。
3)温度。在其他条件不变的情况下,分别在16 ℃、18 ℃、20 ℃、22 ℃、25 ℃的温度下进行实验。根据测定结果,确定最佳的实验温度。 实验结果见表5。

表5 温度对测定的影响
由表5 可知, 温度对氟离子电极的电势有一定影响。温度每升高10 ℃,电势斜率值大约增加2 mV左右。温度在20 ℃时,氟、氯、溴测定值基本一致,本实验选定温度为20 ℃(室温)。
2.4 预处理后溶液阳离子实验
在其他条件不变的情况下, 分别选择离子选择电极和离子色谱仪的待测溶液进行ICP-OES 离子测定实验,实验结果见表6。
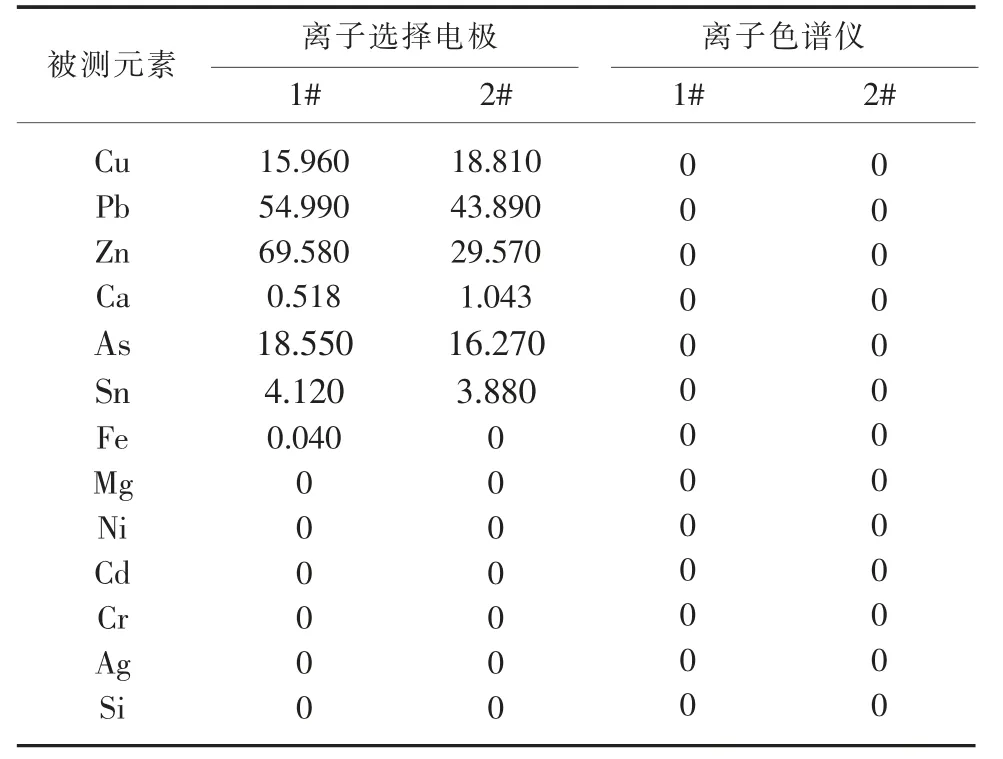
表6 溶液阳离子试验μg/mL
在离子选择电极氟的测定中, 加入总离子强度调节缓冲液,可以控制溶液的pH,消除溶液间离子强度差异对电位的影响。由于稀释倍数足够,预处理后这些离子含量很低,对离子色谱法氯,溴测定结果基本没有影响。
2.5 盐浓度的影响
在其他条件不变的情况下,分别选择TISABI 体积分数为0%、0.50%、1.00%、2.00%、5.00%、10.00%的溶液进行测定实验,实验结果见表7。

表7 盐浓度对测定的影响
由表7 可知,由于稀释倍数足够,盐浓度对电极及离子色谱交换树脂的影响可忽略不计,对氟、氯、溴测定结果趋于稳定。
2.6 精密度试验
按照实验方法分析1#、2#样品,所得结果见表8。相对标准偏差(RSD,n=7)为0.643%~1.588%,可见本方法精密度高。

表8 精密度试验结果(n=7)
2.7 加标回收试验
用1#、2#样品按实验方法进行标准加入回收试验,其结果见表9。 加标回收率在95.9%~104.8%之间,可见本方法准确度高。

表9 标准加入回收试验结果(n=3)
3 结论
通过对试样的处理、测定介质、基体元素对测定元素的影响及工作曲线线性等进行了试验,选择了最佳测定条件,并在此条件下进行方法精密度和标准加入回收率的考察,证明本方法精密度好,准确度高,适用于联测高卤废水中氟、氯和溴的测定。
——一个解释欧姆表刻度不均匀的好方法

