抗菌植物挥发油及其递送系统研究进展
钱雪 ,李海涛,陈斌 ,陈刚, ,黄晓德**
(1. 南京中医药大学药学院,江苏 南京 210023;2.南京野生植物综合利用研究院,江苏 南京 211111;3.扬州大学兽医学院/比较医学研究院,江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
挥发油是从植物中获得的一种挥发性芳香物质,是植物体内的次生代谢产物,主要由萜类化合物、脂肪族化合物和其他分子组成[1]。研究表明,挥发油具有抗氧化、抗炎、抗病毒及抗菌等多种作用[2-4]。其中,挥发油作为一种具有良好抑菌活性的天然生物活性物质被广泛用于医药、食品、农业和化妆品中[5]。然而挥发油在氧气、光照、高温条件下化学性质不稳定,活性组分会快速挥发和氧化,致药效明显下降。此外,挥发油有一定的刺激性,易引起不良反应。因此,本文重点讨论水凝胶、微囊、脂质体、纳米乳、皮克林乳液和环糊精包合物等载药系统在挥发油组分中的应用,以期为更合理有效地利用挥发油组分提供参考。
1 植物挥发油的提取方法
植物挥发油提取率的高低将直接影响其临床疗效的发挥[6]。目前,提取挥发油的方法有水蒸气蒸馏法、超临界CO2萃取法、同时蒸馏萃取法、微波萃取法等[7]。其中,水蒸气蒸馏法已成为提取植物挥发油的常用方法[8];超临界CO2流体萃取法近几年成为研究热点,但大型生产应用受到一定的限制;同时蒸馏萃取法是近20多年发展起来的新型挥发油提取方法,对于小分子易挥发化合物如单萜等和水溶性较好的化合物如醇类等有较高的提取率[9];微波萃取法借助先进仪器设备大大提高了萃取速度和效率[7]。植物挥发油各种提取方法的优缺点如表1概述[10-14]。

表1 植物挥发油提取方法及优缺点Table 1 Extraction methods of plant volatile oil and its advantages and disadvantages
2 植物挥发油的抑菌活性
植物挥发油能够有效抑制细菌、真菌等微生物,其抑菌作用及优势逐渐被重视。细菌类病原微生物如大肠埃希菌可引起尿道炎、膀胱炎、肾盂肾炎、腹膜炎、胆囊炎和阑尾炎等疾病;金黄色葡萄球菌可引起局部化脓感染、肺炎、伪膜性肠炎、心包炎、败血症和脓毒症等疾病。真菌类病原微生物例如白色念珠菌可引起口角炎、口腔炎和膀胱炎等疾病;犬小孢子菌可引起体藓、白藓、脓藓和头藓等疾病。单核细胞增生李斯特菌、芽枝霉和镰刀菌等病原菌还存在于食物中,也可引起不同的疾病。挥发油可抑制细菌和真菌病原微生物的生长繁殖。图1是在Pubmed中以volatile oil和antibacterial为关键词进行检索,展示了近10年来有关挥发油抑菌作用文章数量的年度统计图,可见由于挥发油的独特抑菌作用,关于挥发油抑菌的研究越来越多。

图1 Pubmed中关于挥发油抑菌文章数量的年度统计图Figure 1 Annual statistics of the number of articles on volatile oil antibacterial effects in Pubmed
植物挥发油成分组成非常复杂,主要有酚类、萜类、醛酮类、醇类、酸类及芳香族化合物(见表2)。其中,酚类、萜烯类和醛酮类化合物为主要抑菌成分,如甲基丁香酚、α-蒎烯、石竹烯、柠檬烯、肉桂醛和香芹酮等。此外,醇类、酸类和烃类化合物,如桉树醇、芳樟醇、松油醇、对伞花烃和十六烷酸也起到一定抑菌作用。
2.1 抑制细菌作用
针对不同类型的细菌,不同的挥发油表现出各自的优势。Li等[27]研究表明,佛手挥发油含有柠檬烯、γ-萜品烯和十二烷酸等主要成分,对大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌和黄斑微球菌等表现出中等程度的抗菌活性。Meng等[28]采用超临界CO2流体萃取技术提取了杜松叶挥发油,其主要化学成分石竹烯、氧化石竹烯和反式橙花叔醇等对肺炎克雷伯菌具有潜在的抗菌活性。Radünz等[29]采用水蒸气蒸馏法提取的丁香挥发油对金黄色葡萄球菌、大肠埃希菌、单核细胞增生李斯特氏菌和鼠伤寒链球菌具有体外抑制和杀菌作用。其中,丁香酚是丁香挥发油主要成分,被认为是丁香挥发油抗菌特性的原因[30]。可见,植物挥发油抑制细菌的类型多种多样,抑制细菌范围较广。
2.2 抑制真菌作用
植物挥发油在抑制真菌方面同样表现出了较强的优势。Chen等[31]研究显示,莳萝种子挥发油抑菌作用归因于主要化学成分香芹酮和柠檬烯,莳萝种子挥发油可破坏白色念珠菌的细胞膜,导致真菌死亡。Boukhatem等[32]研究表明,柠檬草挥发油含有柠檬醛、β-月桂烯和醋酸香叶酯等主要化学成分,对白色念珠菌、热带念珠菌和黑曲霉具有良好的抑制真菌作用。Bedoya-Serna等[33]研究显示,牛至挥发油主要由香芹酚、百里酚、伞花烃和萜品烯组成,对芽枝霉、镰刀菌、青霉菌具有显著的抑制作用。综上所述,挥发油抑制真菌的类型多种多样,抑制真菌范围较广(见表3)。

表3 挥发油抑制真菌类型Table 3 Kinds of fungi inhibited by volatile oil
3 植物挥发油递药系统
挥发油具有多种化学成分和强大的药理作用,但是挥发油在氧气、光照、高温条件下化学性质不稳定,活性组分会快速挥发、降解或氧化,药效明显下降。此外,挥发油有一定的刺激性,易引起不良反应,挥发油的这些局限性使得其在临床上的应用受到了限制[42]。因此,将挥发油制备成各种制剂可以克服直接使用挥发油存在的不足,并且可以提高挥发油的抑菌作用并延长抑菌时间,这对挥发油的合理开发及应用具有深远的意义。图2是在Pubmed中以volatile oil和delivery system为关键词进行检索,展示了近10年来有关挥发油递药系统应用的文章数量的年度统计图,可见由于挥发油的独特性质,将挥发油封装于不同载药系统的研究越来越多。

图2 Pubmed中关于挥发油制剂文章数量的年度统计图Figure 2 Annual statistical graph of the number of published papers about formulations of volatile oil in Pubmed
3.1 水凝胶
水凝胶是一种三维高分子材料,其紧密编织的性质允许生物活性分子(如抑菌剂和杀菌剂)通过皮肤,同时防止细菌进入[43]。水凝胶作为薄膜形式的局部伤口处理制剂和药物输送载体受到了极大的关注[44]。水凝胶作为创面敷料具有良好的生物相容性、较低的免疫应答性、生物降解性和无毒性等特点。然而,挥发油往往是疏水性的,水凝胶所负载的挥发油很少。因此,还需利用其他手段提高水凝胶对挥发油的负载量。Low等[45]开发了一种水凝胶制剂作为茶树油和金属离子(Ag+)结合递送的控释系统,该制剂可用于输送茶树油和Ag+作为治疗急性伤口的抑菌剂;该水凝胶能增强茶树油杀灭铜绿假单胞菌、金黄色葡萄球菌和白色念珠菌的活性,可促进伤口愈合,无皮肤刺激性。Kaur等[46]制备了一种肉桂挥发油纳米海绵凝胶,与纯肉桂油相比,该凝胶对金黄色葡萄球菌具有更好地抗菌活性,而皮肤样品的形态学和组织病理学评估显示,皮肤没有显著的水肿、发红或毒性病理变化。
多肽水凝胶是一种主要由多肽和水形成的凝胶。近年来,多肽水凝胶的研究较多[47]。张琳等[48]利用N-(9-芴甲氧羰基)-L-苯丙氨酸(Fmoc-F)多肽水凝胶包埋丁香挥发油,研究了Fmoc-F凝胶对丁香挥发油的控释作用和Fmoc-F凝胶-丁香挥发油包埋产物对大肠埃希菌的抑菌作用(见图3);结果表明,Fmoc-F凝胶延迟了丁香挥发油的挥发并实现了对丁香挥发油的控制释放,且当致病菌增多,环境pH值下降时,因为Fmoc-F分子带正电荷,过多的正电荷使分子间斥力增大,Fmoc-F纤维与纤维间缠结解体,导致Fmoc-F凝胶解体,Fmoc-F分子被释放到溶液中,进而发挥长效、高效地抑制大肠埃希菌作用。

图3 Fmoc-F凝胶形成示意图Figure 3 Schematic diagram of Fmoc-F gel formation
3.2 微囊
微囊是指使用天然或合成的高分子材料(统称为囊材)作为胶囊壁,将固体或液体药物包裹在微囊中获得的制剂。微囊克服了传统植物挥发油易挥发、不稳定、难储运和水溶性差等问题,但是微囊的生产缺乏简单的并适用于所有囊心物的包囊方法,不利于联动化生产且成本较高。龙门等[49]以三聚磷酸钠为交联剂,通过离子凝胶法制备茶树精油-壳聚糖微囊,显著提高了茶树油的稳定性;与茶树油相比,制备的茶树精油-壳聚糖微囊具有更高效的体外杀伤金黄色葡萄球菌和大肠埃希菌的作用。于红红等[50]以β-环糊精为芯材包埋百里香挥发油制备百里香微囊,研究了百里香微囊对产组胺摩根氏菌和变形杆菌的生长情况的影响;结果表明,百里香挥发油经微囊化后对上述病原菌的抑制作用更加显著。Zhang等[51]以天然多糖壳聚糖和海藻酸钠为壳材,采用层层组装的方法制备了百里香挥发油微囊;结果表明,百里香挥发油微囊对枯草杆菌、金黄色葡萄球菌和大肠埃希菌均有较好的抑菌作用,并且在相对高温和极端pH条件下,微囊的抑菌效果远大于百里香挥发油,也可改善皮肤刺激性问题。de Araújo Lopes等[52]以甲基丙烯酸和甲基丙烯酸甲酯组成的阴离子共聚物为囊材制备了丁香酚聚合物纳米胶囊,从而阻止了其在角质形成细胞中的细胞毒性。
3.3 脂质体
脂质体是脂类分子在水溶液中形成的具有双分子层结构的微小囊泡,可同时包裹油溶性物质和水溶性物质[53]。脂质体的运用克服了挥发油水溶性差、易挥发及刺激性大等缺点,使挥发油免受不利环境的影响,从而提高挥发油的稳定性、生物利用度和安全性,并实现缓释与控释,但是脂质体具有包封率低、稳定性差和制备工艺复杂等问题。另外,制备脂质体过程中使用的有机试剂难以完全除去,潜在的细胞毒性使其临床应用受到限制。肉桂醛是植物挥发油的有效成分,具有广泛的抑菌活性。然而,肉桂醛的强挥发性和不稳定性限制了其应用。Chen等[54]采用脂质体包裹肉桂醛,脂质体中包裹的肉桂醛能够通过破坏细胞膜的完整性来抑制金黄色葡萄球菌活性,并且持久性要优于纯肉桂醛。胡一晨等[55]采用乙醇注入结合超声乳化法制备了姜黄挥发油脂质体,其能有效抑制黄曲霉菌,并且脂质体的稳定性要优于姜黄挥发油加入增溶剂后的乳浊液。Manconi等[56]将挥发油与卵磷脂、水混合制备脂质体,使用含有百里香挥发油的脂质体作为抗菌抗氧化剂漱口液治疗口腔疾病;该脂质体具有生物相容性,能够防止氧化应激,有利于角质形成细胞的伤口修复,降低了直接使用挥发油对口腔的刺激性;另外,挥发油及其脂质体均对共生血源性链球菌、致龋变形链球菌和嗜酸乳杆菌具有抗菌活性。
3.4 纳米乳液
纳米乳液是一种粒径为10 ~ 100 nm的胶体分散体系,主要由油、水、表面活性剂和助表面活性剂组成。纳米乳具有质量稳定、不易挥发、保存时间长、可长久留香、挥发油功效作用持久等,但是无毒无害的表面活性剂的选取至关重要。Moraes-Lovison等[57]通过相变温度法制备包封牛至挥发油的纳米乳液,与纯挥发油相比,纳米乳化的牛至挥发油对大肠埃希菌和金黄色葡萄球菌具有更好的抑菌作用。程作慧等[58]运用超声技术制备香茅挥发油微乳液,其抑菌效果明显优于香茅挥发油本身。Sundararajan等[59]利用聚山梨酯80对罗勒叶挥发油进行包埋制备纳米乳,并对纳米乳的抑菌、抗氧化和杀幼虫活性进行了评价;结果表明,该纳米乳剂对粪肠球菌、金黄色葡萄球菌、甲型副伤寒沙门氏菌和肺炎克雷伯菌等肠道致病菌表现出更强的抑菌活性。Nirmal等[60]采用超声乳化法制备了柠檬香桃木挥发油纳米乳液,其具有比单独柠檬香桃木挥发油更高地抑制金黄色葡萄球菌、单核细胞增多性李斯特菌和大肠埃希菌的活性。Mohammadifar等[61]通过自发乳化制备了一种含有薄荷和迷迭香精油的纳米乳,并评估了纳米乳的皮肤刺激性和毒性;结果表明,含有薄荷和迷迭香精油的纳米乳液不会对兔子皮肤造成任何刺激,不会对雄性和雌性大鼠造成任何皮肤毒性和生化、血液学参数的变化,提高了薄荷和迷迭香精油的安全性。
3.5 皮克林乳液
皮克林乳液是一种新型的水/油界面吸附固体颗粒稳定的乳液。皮克林乳液作为一种由胶体颗粒而不是表面活性剂稳定的乳液越来越受到人们的关注[62]。皮克林乳液可以提高挥发油的分散性、实现挥发油的固体化,并且还具有环保、可生物相容性等优点。同时,由于皮克林乳液未使用表面活性剂,可避免其对人体的刺激性等。然而皮克林乳液仍然存在设计具有合适的表面润湿性与粒径大小的纳米颗粒、无法快速过渡到产业化生产等问题。Liu等[63]通过皮克林乳液固定法制备了载有大豆可溶性多糖的牛至挥发油的薄膜;该固定策略可有效防止牛至挥发油快速蒸发,从而大大改善了其长期的抑制大肠埃希菌、金黄色葡萄球菌和铜绿假单胞菌的性能。Li等[64]制备了玉米醇溶蛋白/阿拉伯胶纳米颗粒来稳定皮克林乳状液的油水界面;结果表明,阿拉伯胶纳米颗粒-百里酚皮克林乳液表现出百里香酚的控释效应,且对大肠埃希菌具有更强的抑菌活性。王龑等[65]制备了肉桂醛皮克林乳液,该乳液可有效抑制赭曲霉的生长和毒性,效果好且安全。
3.6 环糊精包合物
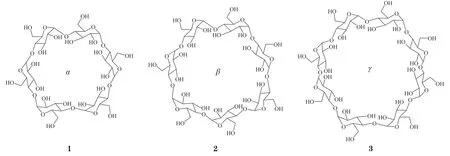
环糊精(cyclodextrin,CD)是直链淀粉在由芽孢杆菌产生的环糊精葡萄糖基转移酶作用下生成的一系列环状低聚糖的总称,通常含有6 ~ 12个D-吡喃葡萄糖单元,最常见的自然形成的环糊精包括α-CD(1)、β-CD(2)、γ-CD(3)这3种构型[66],其中β-环糊精来源广泛,价格较为低廉,最为常用。β-CD是由D-葡萄糖分子以1,4-糖苷键连接而成的环状低聚糖,具有特殊的空腔结构,此空腔对脂溶性物质的亲和力很强,因此环糊精在挥发油包合中具有显著优势[67]。环糊精包合后可增加挥发油溶解度和溶出度、降低刺激性、避免挥发油的挥发、提高有效成分的保留率等优点。然而挥发油在环糊精包合前后化学成分基本相同,各成分的比例却会发生不同程度的变化,而且包合物中挥发油的溶出速率难以保证,可能无法达到和其他中药成分协同发挥药效的作用[68]。Das等[69]以随意甲基化-β-环糊精为壁材包封挥发油,结果表明,与未包封的挥发油相比,环糊精包封使挥发油抑制微生物活性提高了2 ~ 4倍。Zhang等[70]研究显示,羟丙基-β-环糊精的包封显著降低了八角茴香挥发油的刺激性气味,并使包合物具有持续释放作用;此外,在抑菌测试中,羟丙基-β-环糊精的选择性包封改善了八角茴香挥发油对根霉、酿酒酵母和大肠埃希菌的抑制作用,并在24 h内具有抑菌稳定性。Kumar等[71]以碳酸二苯酯交联的β-环糊精纳米材料包封补骨脂挥发油,与纯挥发油相比,该纳米海绵显著提高了补骨脂挥发油对铜绿假单胞菌、大肠埃希菌和金黄色葡萄球菌的抑菌活性。
4 结语
植物挥发油具有的生物活性多种多样,其应用不仅仅局限于传统的医药、食品、烟酒和日化等方面,挥发油在抑菌中展现出突出优势,开辟了植物挥发油作为一种新型植物源抑菌剂的广阔市场。然而,挥发油易挥发、易氧化分解及易变质,因此,将给药载体运用于挥发油可以提高挥发油的溶解度和稳定性,赋予其靶向、缓释和控释的特性,从而提高了挥发油的功效和生物利用度。然而,随着载体的广泛应用,一些问题也随之而来。首先,植物挥发油并不是单一的化学成分,其化学成分含量多样,可达上百种。挥发油给药系统的粒径、载药量、包封率和稳定性研究较多,但对已进行包封的挥发油成分研究较少,对于包封后的挥发油成分是否与载体材料发生反应,从而导致化学成分的改变尚不清楚[72]。这就要求必须选择合适的挥发油载体,同时对于挥发油纳米给药系统进行全方位的评价[73]。其次,将挥发油制备成纳米给药系统的优点包括防止挥发油的挥发、促进挥发油的体内吸收等,但大多停留在实验室层面,只有少部分在动物体内模型中进行了检测,临床应用也较少[27]。同时,挥发油纳米给药系统的释放给药机制尚不明确,因此是否会对人体产生毒副作用也尚不明确,这主要因为缺乏对载体材料的安全性、生物相容性和可降解性进行评估的方法。在投入临床使用前,必须对材料本身和载体的药代动力学和长期毒性等进行全方面考察[74]。因此,需建立一套系统性评价方法,以促进递送载体的应用,但毋庸置疑的是载体在挥发油产品研究中存在巨大优势,将给挥发油的应用带来更大的帮助。

