肿瘤生物模型及其功能性检测的转化潜能和应用
花威,毕臻乐,林琳,胡凯猛,闻丹忆
(上海立迪生物技术股份有限公司,上海 201203)
过去几十年来,随着肿瘤相关研究的突破,抗肿瘤药物的数量激增[1]。肿瘤患者的生存期也因此得到一定程度的延长,然而大多数肿瘤患者的发病率和死亡率仍较高[2]。靶向抗癌药物和免疫治疗的研究近年来取得了显著进展,但药物疗效、安全性和耐药问题仍然存在。相比其他疾病的治疗药物,Ⅰ期临床抗肿瘤新药获得最终上市批准的可能性非常低[3],其主要原因之一是临床前肿瘤模型与临床患者之间存在差异性。缺乏合适的研究模型不仅在一定程度上限制了新药研发,而且阻碍了精准医疗的发展[4-5]。目前,肿瘤的发生、发展通常被认为与遗传因素、表观遗传改变以及环境因素等相关,而肿瘤生物模型可以模拟肿瘤发生和发展,有助于进行肿瘤的机制研究,可为肿瘤患者提供更好的治疗选择。本文旨在探讨各类临床前肿瘤模型的特征、效用及优缺点,并针对患者的精准治疗,阐述基于肿瘤生物模型的功能性检测平台的发展情况,并就其在体外诊断(in vitrodiagnostics,IVD)中应用前景进行展望。
1 肿瘤生物模型概况
肿瘤生物模型包括体内培养模型和体外培养模型,是用于进一步研究肿瘤细胞或组织的可扩增生物模型。体外模型包括细胞系、条件性重编程(conditional reprogramming,CR)细胞、类器官(organoids);体内模型包括同源肿瘤模型、细胞源性或人源性肿瘤模型等,基于这些肿瘤生物模型的功能性检测各有特点(见表1)。
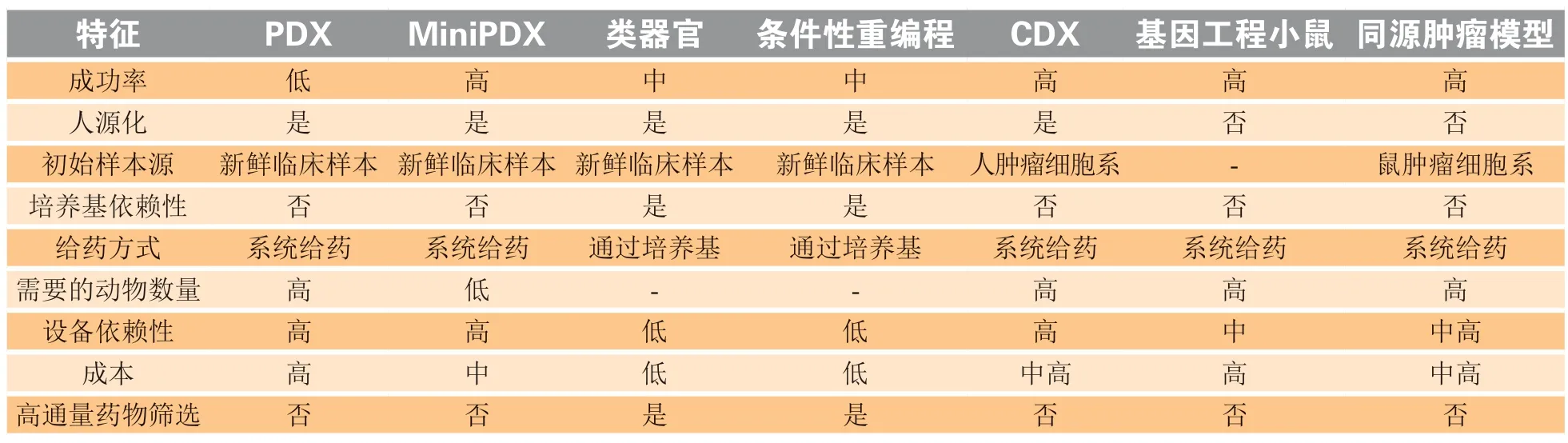
表1 功能性检测平台的特征Table 1 Characteristics of functional assays
1.1 体外培养模型
1.1.1 肿瘤细胞系 传统的肿瘤细胞系作为体内外研究工具,在癌症研究和药物研发中的应用时间较长,发挥着重要作用[6]。美国国家癌症研究所(National Cancer Institute,NCI)和Hamon治疗肿瘤学研究所建成了大量的原代细胞系。除了美国模式培养物保藏所(American Type Culture Collection,ATCC),全球亦有其他细胞库保存有多种细胞系[7]。
1.1.2 条件性重编程细胞 传统细胞系等体外模型也是癌症研究的重要工具,但原发肿瘤细胞很难在体外进行扩增,建立肿瘤细胞系的成功率低至1% ~10%[8]。然而CR技术有效提高了原代细胞培养和细胞系建立的成功率,一个关键因素是使用饲养细胞和Rho相关卷曲螺旋蛋白激酶(Rho-associated coiled-coil containing kinases,ROCK)抑制剂来帮助肿瘤细胞和其他上皮细胞在体外持续扩增(见图1A)[9]。目前,大量肿瘤细胞通过CR技术建立,包括腺囊癌[10]、乳腺癌[11]、前列腺癌[12]、胰腺癌[13]、直肠癌[14]、肺癌[15]、宫颈癌[16]等。此外,CR细胞可使用人源肿瘤异种移植(patient-derived xenograft,PDX)模型和人源肿瘤类器官(patient derived organoid,PDO)建立[17],其在传代超过200代次的同时,还可保留肿瘤细胞异质性[18]。CR细胞作为一种合适的体外药效检测工具,已应用于药物研发和精准医疗[19-20]。Mimoto等[20]建立了复发性雌孕激素受体阳性(HR+)和人表皮生长因子受体阴性(HER2-)的乳腺癌CR细胞,检测了肿瘤细胞异质性和药物敏感性:CR细胞的突变状态和病理特征保持不变,但RNA表达与原发肿瘤细胞不同;雌激素受体阳性(ER+)/孕激素受体阳性(PgR+)/HER2-的肝转移CR细胞对224种药物的反应结果显示,其中66种化合物降低了细胞活力,包括选择性雌激素受体降解剂(SERD)和细胞周期依赖性激酶4/6(CDK4/6)抑制剂;在转移切除术后使用SERD和CDK4/6抑制剂治疗的患者13个月无复发,与CR细胞药物筛选结果一致。另一项研究从7例前列腺癌患者中提取了CR细胞,其包括原发性前列腺癌到晚期去势抵抗性前列腺癌(castrationresistant prostate cancer,CRPC)等不同时期患者;通过对306种新兴的抗癌药物和临床抗癌药物的高通量筛选,确定了Bcl-2家族抑制剂navitoclax以及紫杉烷、美帕辛和类维生素A是抗CRPC CR细胞有效药物,其中navitoclax最有效[21]。

图1 CR细胞、类器官、PDX和MiniPDX流程图Figure 1 Schematic of CR cells, organoids, MiniPDX and PDX
CR细胞可以通过二维(2D)培养、细胞球体模型或类器官培养[12]。CR细胞也可以接种到小鼠体内以建立PDX模型[22]。这为建立性能更好的模型提供了一种新方法,包括乳腺癌PDX模型和其他成功率较低的肿瘤模型。CR细胞或任何其他体外模型的一个主要缺点是无法评估药物的药代动力学和药效动力学(pharmacokinetics and pharmacodynamics,PK/PD)特性,因为被测药物的浓度通常是恒定的,而药物在体内经过吸收、分布、代谢和排泄(ADME)过程,浓度是动态变化的。此外,体外肿瘤模型一般不适用于前药的评估。例如,替加氟作为5-氟尿嘧啶(5-FU)的前药,在肝脏中缓慢代谢为5-FU,因此毒性低于5-FU[23],而替加氟在临床上被广泛应用于治疗各类肿瘤,但在缺乏代谢酶的情况下,无法在体外直接评估其抗肿瘤作用[24]。
1.1.3 类器官模型 类器官是一种在体外环境下培养而成的具备三维(3D)结构的微器官。首个类器官就是利用Lgr5+小鼠肠道干细胞构建的小肠类器官[25]。和细胞球不同的是,类器官是在3D结构中生长的细胞,在组织学和遗传学上均与原始组织相似,并且类器官还保留了再生能力[26]。
应用类器官技术可将患者肿瘤组织和循环肿瘤细胞中分离的细胞培养成类器官(见图1B)[27]。患者来源的类器官可以在体外扩增,长期低温保存。除了能够扩增之外,类器官还可以保留肿瘤的异质性。一些诱变技术如成簇的规律间隔的短回文重复序列(CRISPR)/CRISPR相关蛋白9(Cas9)已被发现并被用于诱导肿瘤组织发展成肿瘤类器官[28]。生成类器官所需的时间随肿瘤种类的不同而有所差异[29]。根据已建立的各种PDOs发现不同瘤种的建模成功率也不同,其中非小细胞肺癌(non-small-cell lung cancer,NSCLC)成功率最高达88%[30],而肝细胞癌(HCC)类器官的建模成功率仅为19%[31]。然而,体外模型共有的缺点同样存在于类器官,其无法评估需要经过代谢的药物和抗血管生成药物,但类器官同样可以移植,从而实现体内模型的建立和体内药效研究。
1.2 肿瘤体内模型
1.2.1 同源肿瘤模型 同源肿瘤模型是通过将体外扩增的小鼠肿瘤细胞系皮下或原位注射到免疫功能缺陷的小鼠体内建立。同源肿瘤模型在癌症研究和药物开发中的应用已超过50年,涉及肺癌、乳腺癌、肠癌、胃癌和恶性黑色素瘤等癌种[32]。同源肿瘤模型于免疫小鼠体内建立,因此适用于检测影响免疫功能的药物。有研究在一组常用的小鼠同源肿瘤模型(包括4T1、MC38、B16F10 AP-3、CT26和LL/2)中检测了抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)和抗程序性死亡配体1(PD-L1)治疗的反应,这些同源肿瘤模型对免疫治疗表现出不同的反应,在不同模型中基因表达存在显著差异,这与肿瘤免疫浸润相关;这类模型有“inflamed”表型和“non-inflamed”表型2种,选择合适的模型用于免疫治疗至关重要[33]。细胞系可快速在体外扩增,同源小鼠模型也具有建模快、费用低、易传代的优点。然而,细胞系建模缺乏基因组、表观遗传和微环境异质性,无法很好地模拟患者体内的复杂环境[34];另一个缺点是仅有少数细胞系可用来建立同源小鼠模型,限制了这些模型的应用。
1.2.2 细胞源性异种移植模型 和同源肿瘤模型一样,细胞源性异种移植(cell line-derived xenograft,CDX)建模也是通过体外扩增细胞系,随后注射到小鼠体内来完成。基于CDX模型易于传代、建模周期短、可用性强和传代费用低等优点,CDX被大量用于药物研发中的药效、PK、PD研究[35]。Suzawa等[36]检测了阿法替尼(一种不可逆的EGFR/HER2抑制剂)在几种NSCLC细胞系(包括A549、Calu-3、HCC827、NCI-H1299、NCI-H1781、NCI-H1975、NCIH1993和NCI-H2170)中的抗肿瘤活性,探讨细胞遗传改变与细胞对阿法替尼敏感的相关性;发现HER2突变的细胞系(H2170、Calu-3和H1781)对阿法替尼敏感,而非HER2突变或表皮生长因子受体(EGFR)的NSCLC细胞系则对阿法替尼不敏感。然而,CDX模型也存在一些显著的缺点:1)体外传代后细胞生物特征可能会改变,致使不同实验室使用的细胞系在致瘤性、基因组和表观遗传特性方面存在差异;2)与原发肿瘤相比,CDX异质性较低;3)CDX是在免疫缺陷小鼠中建立,这限制了CDX在免疫治疗和免疫调节药物研究中的应用[37-38]。
1.2.3 基因工程小鼠模型 基因工程小鼠模型(genetically engineered mouse model,GEMM)是原位肿瘤模型,通过基因改造技术使致癌基因表达或抑癌基因缺失。致癌基因相关研究和基因改造技术的发展促成了基因改造小鼠的出现。这些模型主要使用组织特异性启动子来驱动致癌基因的表达或使用组织特异性重组酶来驱动抑癌基因的缺失[39]。GEMM是一种自发模型,可以模拟癌前病变和肿瘤发生的整个过程。该模型已用于卵巢癌生物标志物的开发[40]、肿瘤机制研究和临床前药物试验[41]。例如,小鼠前列腺转基因腺癌模型(transgenic adenocarcinoma mouse prostate,TRAMP)即经雄激素调节的前列腺癌模型,该模型可发展为进行性、多病灶、异质性前列腺癌,与性成熟度相关,与临床疾病高度相似[42]。此外,GEMM也适用于研究免疫治疗和免疫相关药物。GEMM的优点包括原位性、具有完整的免疫系统和微环境等。然而,通过改变肿瘤驱动基因建立的肿瘤模型并不能完全模拟真实人体体内复杂的肿瘤环境。另外,通过基因敲除或点突变技术建立的基因工程小鼠模型,往往会对其他基因和生物学过程产生影响,这些影响可能并非研究者预期的。由于动物本身的异质性,GEMM肿瘤形成具有不确定性,潜伏期相较其他移植模型更长,因此,建模需要大量的小鼠和更长的建模周期。此外,GEMM往往只是单基因变异的模型,在模拟人类疾病的复杂性方面存在的局限性限制了该技术在癌症研究中的运用。
1.2.4 人源肿瘤异种移植模型 PDX是通过皮下或原位植入手术将活检肿瘤组织块移植到免疫缺陷小鼠体内(见图1C)[43]。从胸腹水和循环肿瘤细胞中富集的肿瘤细胞也可用于PDX建模[44]。植入后,PDX模型成瘤潜伏期为几周到几个月不等,这与癌种、建模方法和原发肿瘤的生长特征有关[45]。PDX经体内连续传代,可长期保存,也可用于药效学研究[46]。目前,已成功建立不同癌种的PDX模型,包括肺癌[47]、乳腺癌[48]、胰腺癌[49]、结直肠癌[50]、胃癌[51]、卵巢癌[52]、肝细胞癌[53]、前列腺癌[54]、脑肿瘤[55]、黑色素瘤[56]、头颈部肿瘤[57]等。不同癌种的建模成功率为10% ~ 100%。大量研究证明,PDX可以维持原发肿瘤的基因谱、基因表达模式、组织学和药物反应,以及原发性肿瘤的分子和细胞异质性[58]。此外,PDX模型也显示出预测转移潜能和药物反应的可能性[59]。当前,PDX模型被广泛认为是比CDX更具有生理相关性的临床前模型,广泛应用于癌症机制的研究和抗肿瘤药物的发现[60]。Gao等[60]建立了约1 000例具有多驱动基因突变的PDX模型,评估了6个癌种对62种不同治疗的反应,确定了基因型与药物反应间有相关性,在阐明耐药机制和候选治疗方案方面取得了突破性进展。尽管PDX具有显著的优势,但其建模周期长,PDX建模和药效研究通常需要6 ~ 8个月的时间,且费用高,不适合用于大量筛药和个性化精准医疗[61]。免疫缺陷小鼠PDX模型由于自身的免疫缺陷,不适用于免疫调节剂疗效评价。此外,研究表明,人类基质细胞在PDX连续传代过程中会逐渐减少,并逐渐被小鼠成分取代,这意味着代次越靠后PDX越偏向鼠源,也就无法保留原代肿瘤细胞的异质性[62]。
除了上述生物模型以外,斑马鱼、线虫、果蝇等生物模型也广泛应用于转化医学的研究领域。肿瘤生物模型的转化研究一直是近几年研究的热点。肿瘤的精准治疗已进入到依赖于功能性检测的时代,功能性检测的基础就是各类肿瘤生物模型。基于肿瘤生物模型的研究进展,功能性检测的平台也在不断更新。
2 基于肿瘤生物模型的功能性检测
2.1 传统的肿瘤治疗敏感性和耐药性分析
预测性的功能性检测特别是肿瘤治疗的敏感性和耐药分析(chemosensitivity and resistance assays,CSRA)已被研究了几十年[63]。这些测试依赖于从医疗过程中获得的病理合格样本,包括诊断活检、原发病灶或转移灶、积液、腹水、含有循环肿瘤细胞的血液等,进而对患者肿瘤进行建模,包括上述提及的CR细胞培养、PDX模型和PDO模型。这些模型总体而言在不同程度上保留了患者的遗传转录特征及肿瘤异质性,在暴露于目标治疗后,可以较为精准地提供肿瘤治疗药物的敏感性和耐药性功能特征。功能性检测不在于确定疾病表型的根源,而是在于捕捉所有生物学变量之间的相互作用产生的对药物的最终反应。功能性检测最终被整合到临床决策过程中,为癌症患者接受个体化治疗提供参考[64]。最早的化疗敏感性测定方法是在20世纪70年代末设计的,其主要基于肿瘤的克隆性,但仍显示出有前景的结果。近年来,随着不断改进,基于各种药敏检测结果挑选的化疗方案达到了较高的准确性[65]。大多数情况下,这些功能性检测常见步骤如下:1)分离肿瘤标本和肿瘤细胞;2)在化疗药物管理下进行原代细胞培养;3)测定肿瘤细胞活力、死亡率;4)分析数据以产生化疗敏感性特征。
一项meta分析纳入了1991—2019年的42项研究,文献中针对泛癌种的药敏结果证实了功能性检测在多个癌种的准确性、敏感性和特异性:其中细胞培养的成功率均值为88.2%,各种功能性检测的平均灵敏度在80%以上,阳性预测值中位数为83%,阴性预测值中位数为82.9%,准确率中位数为77.8%[64]。使用功能性检测还可以为患者带来临床获益,但仍需通过更可靠的干预性随机研究来证实。传统功能性检测在肿瘤原代细胞的异质性保留和肿瘤的微环境变化方面依然存在极大的改进空间。2015年,研究人员提出了“下一代功能性检测”的概念,类似于二代测序(next-generation sequencing,NGS)[66],包括2D离体药物毒性测试、PDX、PDO等技术。这些功能性检测的核心目的是解决基因配对治疗癌症的局限性。
2.2 创新型功能性检测平台
2.2.1 患者来源类器官药敏检测 Kopper等[67]从32例患者身上获取肿瘤组织,建立了56个肿瘤类器官模型,包含了卵巢癌的所有主要亚型,这些类器官概括了卵巢癌的特征和肿瘤异质性,并表现出患者内和患者间的异质性,药敏试验发现不同卵巢癌亚型对金标准铂类药物化疗的反应不同。与PDX相比,类器官的实验周期更短,成本更低,可用于中高通量药物筛选。因此,建立患者来源类器官评估抗癌药物,是功能性检测的方法之一。Pauli等[68]从769例患者中建立了56种肿瘤来源的类器官和19种PDX模型,类器官用于高通量药物筛选,PDX模型用于验证药物方案;该研究将基因组数据与个性化体外和体内肿瘤模型的药物筛选相结合,指导癌症精准护理并推动进一步研究。Yao等[69]研究发现,患者的放化疗反应与直肠癌类器官(RCO)反应高度匹配,准确率为84.43%,敏感性为78.01%,特异性为91.97%。Tiriac等[70]从入组新辅助放化疗(NACR)Ⅲ期临床试验的患者中收集了112个局部进展期直肠癌(LARC)的活检组织,并建立了96例PDOs;PDOs的放化疗反应与患者的临床反应一致,准确性为84.43%,敏感性为78.01%,特异性为91.97%。提示,PDO可以预测LARC患者在临床中的反应,并可能用作直肠癌治疗的伴随诊断(companion diagnostics,CDx)工具。值得注意的是,类器官也可以移植,进行体内建模和药效研究[67]。
尽管类器官建模速度快且费用低,但其在癌症研究中的应用仍存在局限性。类器官的细胞在培养过程中会逐渐减少,异质性较PDX低。此外,类器官只能在体外给药,因此不适合评估需要进行代谢后才能发挥作用的药物[8]。
2.2.2 MiniPDX检测 MiniPDX是一种体内类器官技术,旨在提供更快速、更准确的药效测试,指导个性化癌症治疗[71]。从患者身上获取新鲜肿瘤样本,包括手术样本、活检样本、穿刺样本以及胸腹水样本,消化成单细胞悬液,随后注入MiniPDX胶囊管中,植入免疫缺陷小鼠皮下,连续给药7天后,取出胶囊管,使用相对光单位(relative light unit,RLU)测定肿瘤细胞增殖情况抑制率(tumor cellular growth inhibitor,TCGI),可显示该模型对各组治疗方案的反应(见图1D)。
MiniPDX药敏检测的优点为周期短、体内药敏检测结果与临床治疗具有高度一致性。MiniPDX药敏检测10天可出结果,不仅可用于抗肿瘤药物临床前研究,还可为临床患者提供快速准确的药敏检测结果。一位子宫内膜间质肉瘤患者术后化疗2个疗程后发生肺转移,取转移病灶进行MiniPDX药敏检测结果显示,该患者对阿帕替尼、阿帕替尼+奥拉帕尼2组药物敏感,经过4个月改进治疗后,该患者肺转移灶逐渐消退[71]。一项针对胆囊癌的研究用MiniPDX检测了以吉西他滨、奥沙利铂、5-FU、纳米颗粒白蛋白结合型(NAB)紫杉醇和伊立替康等45种最常用的化疗药物的敏感性,MiniPDX药敏检测指导的术后辅助化疗方案显著延长了其生存期,其中中位总生存期从13.9个月延长到18.6个月,疾病无进展生存期从12个月延长到17.6个月[72]。另一项转移性十二指肠腺癌的研究将MiniPDX与NGS相结合,在揭示关键基因突变的同时进行MiniPDX快速药敏检测,NGS测序结果对MiniPDX的药敏测试结果提供了进一步支持,患者无病生存期达到34个月[73]。一项研究利用MiniPDX药敏检测结果指导铂耐药卵巢癌患者治疗,其临床治疗获益率高达75%[74]。Wang等[75]对NSCLC治疗进行研究显示,MniPDX给药组患者总生存期(OS)和无进展生存期(PFS)优于常规给药组。Li等[76]在MiniPDX模型上验证了遗传学、蛋白质组学和磷酸化蛋白质组学预测的药物反应,建立了从大型组学数据集生成到结直肠癌体内药物试验模型的整个工作流程。Yang等[77]选取42例肝癌患者使用MiniPDX筛选最敏感的抗肿瘤药物方案进行肝部分切除术后的预防性治疗,其与对照(索拉非尼)组相比,显著延长了肝癌患者的生存期。有研究在患者来源的MiniPDX上证明了靶向神经酰胺通路的中间体1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)是治疗转录组雄激素受体(LAR)肿瘤的一种有前景的方法,其结果与患者来源的类器官一致,提示在某些情况下,MiniPDX能够作为基础研究的验证工具[78]。由于MiniPDX药敏试验结果与各类肿瘤患者的临床反应基本一致,MiniPDX模型在指导癌症个体化治疗方面显示出巨大潜力。功能性检测是有价值的体外诊断工具,已超越了概念验证阶段,其不仅本身可发挥用药指导的作用,在结合分子诊断后也更能进一步推动精准医疗的发展。
虽然 MiniPDX 药敏检测模型在临床实践中的应用取得了较大进展,但由于MiniPDX 模型使用免疫缺陷小鼠,其无法用于常规检测肿瘤免疫治疗药物。目前针对免疫治疗的MiniPDX也初步研发成功,该体系称为肿瘤免疫快速体内疗效试验(immunooncology fastin vivoefficacy test,IO-FIVE),在常规MiniPDX测试阶段较好地保留了人源免疫细胞,并可在10天左右完成测试。目前已完成超过100例临床样本的IO-FIVE测试,可较好地区分免疫药物及免疫治疗方案的敏感性和耐药性。
目前,功能性检测仍应用于转化医学的场景中,IVD技术为医疗领域用于诊断、监测、预防疾病的重要工具。然而,鉴于功能性检测特殊性以及目前管理政策的影响,功能性检测朝着IVD转化仍然面临着诸多挑战。
3 功能性检测的IVD之路面临的挑战
IVD归类为医疗器械。美国食品和药品监督管理局(FDA)进一步定义IVD作为医疗器械的子集,包含“旨在用于疾病或其他状况诊断的试剂、仪器和系统,包括健康状况的确定,目的是为了治愈、缓解、处理、预防疾病或其后遗症”。随着IVD技术的迅猛发展,检测层面从基因水平的基因测序、点突变基因诊断、单核苷酸多态性(single nucleotide polymorphisms,SNP)检测,到蛋白水平的各种生物标志物检测,到细胞水平的循环肿瘤细胞(circulating tumor cell,CTC)检测、循环肿瘤DNA(circulating tumor DNA,ctDNA)检测、薄层液基细胞学检测(thinprep cytologic test,TCT)等,到组织水平上的正电子发射断层显像(PET)/计算机断层扫描(CT)等,再到药敏层面的功能性检测技术。总之,IVD正在向着更简便、更快捷、非侵入性、多信息化的方向发展。
功能性诊断(也称功能性检测)技术主要基于肿瘤患者的临床组织样本,进行原代肿瘤细胞系(patient-derived cell,PDC)、PDO和PDX的构建,进而依托构建的模型进行肿瘤药物的敏感性测试,为肿瘤患者的精准诊断和治疗策略提供重要的线索和依据。从概念而言,功能性检测完全符合IVD概念中患者样本、体外检测分析、指导临床的三大核心内涵,是一种新型的IVD技术平台。这些功能性检测可独立发挥重要作用,也可与分子诊断学(如NGS)结合以提供更加综合的信息。目前,功能性检测在规范化等方面仍需进一步完善,以整合于IVD,从而使其进入临床常规路径。
3.1 功能性检测作为伴随诊断和补充诊断发挥作用
目前,大部分CDx属于IVD范畴。CDx和补充诊断(complementary diagnostics,CoDx)的定义很宽泛,前者是将患者体内的特定生物标志物(无论是单个或一组突变,还是蛋白质产物)与特定药物相关联,后者能够使用所有CDx使用的技术和方法,对于患者用药不是必需的。二者使用性质有一定差异,CDx为必须进行的检测,以决定是否适合使用特定的药物,而CoDx是选择性的,为治疗方案提供信息和依据,但与用药无关。然而,另一种类型的CoDx经常被忽视,即功能性检测。功能性检测可将临床前体外/体内试验(由研究对候选药物的应答的特定模型引导)转化到临床适用的体外实验;实际上,功能性检测在治疗开始的上游,即患者自己的细胞或基于患者的细胞进行培养或移植,可针对特定适应证的可用疗法而进行药敏试验。对于无已知敏感性或克服耐药性药物的患者来说,功能性检测结果可作为生物标志物检测的替代策略,根据功能性检测结果指导患者用药。因此,功能性检测可能为包括化疗、靶向治疗等在内的全身性治疗提供个体化的药物使用方法。
CDx和CoDx可能直接影响患者的治疗过程,因此,它们需要受到严格的监管,其生产和执行也需要遵循严格的质量管理框架。功能性检测由于其性质上属于CoDx之一,其结果针对给定适应证的特定治疗有推荐和指导属性;医疗团队根据这些信息和病理特征,最终决定最佳的治疗策略。然而,与传统的CDx或CoDx不同,功能性检测可同时预测几种药物的疗效,而非单一治疗方案。适用于CoDx的监管框架也适用于功能性检测[64]。
3.2 功能性检测的方向
3.2.1 内在检测效能的提高和论证 CDx和CoDx所选治疗方案的风险和获益依赖于检测结果与临床的一致性。为了获得足够的可靠性,必须对功能性检测的稳定性、可重复性和临床获益进行严格的论证。与CDx和CoDx一样,功能性检测的诊断效能也需3个方面的验证:分析验证、临床验证和临床应用[66]。分析验证依赖于几个参数:重复性(同一样品的连续测量之间的一致性),再现性(同一测量的几个样品之间的一致性),精确度(测量结果与真实值的接近性),准确度(测量的重复性程度)和检测限(为产生可靠结果而评估的物质的最小量)。患者的临床应答是评估这些功能性检测技术优劣的金标准。因此,上述多数参数必须来源于直接涉及临床患者的研究。目前,关于生物标志物检测的总体可重复性尚无通用规则;然而,低于15%的变异系数被认为可达到目标[79]。准确性可在早期发展阶段通过易于获得的体外模型(如细胞系)进行研究。
3.2.2 标准操作流程和自动化 完善的标准操作程序、对操作人员的充分培训、检测材料的质量(耗材和试剂的批量控制,限制使用具有完全受控配方的标准化试剂)[80]、适当的仪器控制和维护是对重现性产生积极影响的因素。自动化(液体处理、终点测量)也是非常需要的,以确保整个操作流程能够满足在临床诊断规模下的通量与样本周转需求,以及整个过程的可信性和可重复性,从而促进整个流程符合监管要求。目前,对于在基质中生长的3D肿瘤模型尚未有统一的基质处理标准流程,因此限制了其普遍适用性[81]。目前,提供功能性检测服务的实验室就其技术性能进行交流较少,这可能也是相关技术普及的障碍之一。
3.2.3 样本收集处理时间窗 在功能性检测流程中,必须处理活细胞或细胞提取物,因此样本收集、运输和处理是关键步骤之一[82]。研究认为,可以开发特定的缓冲液和程序来确保整个功能性检测过程的标准化,从而进行流程控制[83]。样品质量取决于可用的材料,应该包含足够的肿瘤组织,而将不需要的区域(坏死、纤维、脂肪、黏液或含有血凝块)减少到最小。样品收集与运输方面的主要问题是从床旁采样到IVD实验室处理之间的时间窗。样品收集与运输需注意:1)保存样品完整性的最大延迟时间为72 h;2)在不迟于取样后48 h内处理的样品可获得最佳样品完整性;3)样本冷冻保存是不可取的,因为它既降低了可用于检测的细胞数量,又减弱了它们对细胞毒性药物的反应。由于技术和法律风险,这种受限的时间窗在一定程度上阻碍了样品的长途运输和跨境运输;样本如要直接进入目标国家,还需要继续研发,在延长样本收集时间的情况下保证检测的成功性和准确性。
3.2.4 诊断性临床试验 通过适当的控制设计和性能测试,进而评估IVD的临床有效性,其目的是证明其“识别、测量或预测的结果是否存在易感性”的能力,即临床诊断效能[66]。诊断性研究的关键参数包括诊断灵敏度、诊断特异度、阳性预测值(positive predict value,PPV)和阴性预测值(negative predict value,NPV)[84]。对于功能性检测而言,终点值至关重要,用于预测对特定药物有无应答。同时,还应全面评估分析功能性检测过程中的限制因素,特别是关于采样和运输等的限制因素。最后,临床效用能够证明该功能性检测的结果与临床使用结果相比,能否提高患者从个性化治疗中获得的治疗效益。根据美国临床肿瘤协会(American Society of Clinical Oncology,ASCO)的最新建议[85],临床效用的评估需要开展大型、随机、前瞻性临床试验,在检测指导的治疗或肿瘤科医师选择的治疗后,研究患者治疗结局(缓解率、无进展生存期、总生存期)。
目前,随着针对大量适应证的不同方案的开发,肿瘤药物敏感性检测方法也随之增加。从技术差异的角度来看,每种上市的抗PD-1/PD-L1抗体均有其配套的CDx,如PD-L1表达、dd错配修复(mismatch repair,MMR)、微卫星不稳定(microsatellite instability,MSI)检测等。临床试验确定了上述诊断技术的具体临界值,疗效明确[86]。然而,这些检测方法不能相互替代,需要实验室进行一系列测试,以适应医生对一种药物或另一种药物的偏好。尽管如此,可以预见的是,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)的CDx在未来将具备一定的互换性,因为它们均依赖于共诊断的准确性[87]。然而,由于其技术上的极端异质性,这些诊断技术与功能性检测技术进行系统矫正和互换的可能性较低。对于特定的病理类型,功能性检测仍然需要找到其适配的瘤种和药品类型。
4 结语与展望
目前,IVD已广泛应用于医疗、药物研发、疾病诊断和监测等领域,其主要优势在于可以快速、准确地检测生物标志物并提供个体化信息。随着分子诊断技术、纳米技术、生物信息学、人工智能等领域的不断发展,IVD技术也在不断创新。肿瘤的功能性检测是通过体外模型或体内模型进行的,用于评估肿瘤对特定治疗方案的响应情况。将肿瘤的功能性检测转化为IVD需要大量的实验和临床验证,并且需要遵循一系列监管要求和标准。用于肿瘤研究和抗癌药物研发的模型有多种,这些模型的实验方法和研究机制大同小异。根据不同的研究需求选择最佳模型对研究的开展至关重要。体外模型(例如类器官)速度快、费用低,适用于高通量筛选,但这类模型缺少治疗相关给药剂量和PK/PD相关性,只适用于评估部分药物。另一些体内模型如同源肿瘤异体移植小鼠模型和GEMM则适用于肿瘤免疫相关研究,但人、鼠生理特征之间的较大差异限制了其应用。CDX模型来源于患者肿瘤细胞系,由于传统细胞系类型有限,这类模型缺乏异质性。PDX模型则具有较高的准确性,连续传代后仍具有高度异质性,但是PDX建模周期长,更适合用于药效研发而非精准治疗。目前,基于MiniPDX的临床应用正在持续增多,MiniPDX相关的回顾性分析也证明了其用于药物方案筛选的潜力。MiniPDX独特的优势包括检测快、费用低、成功率高、样本来源广、临床一致性高,其不仅能够对肿瘤药物研究起到重要作用,更是推动精准医学进一步在临床上造福患者的有效工具。就目前政策来看,以MiniPDX技术为代表的功能性检测申报IVD还有待更多、更有说服力的循证医学证据的支持,同时也需要进一步明确申报门槛和路径,以实现在临床上得到更多应用,推动肿瘤精准治疗的进一步发展和提高。

