上调c-Ski基因表达对青光眼兔术后瘢痕形成及TGF-β、RhoA/Rock信号通路的影响
刘莉莉 招志毅 曾招荣
(广西医科大学第四附属医院柳州市工人医院眼科,广西柳州市 545005)
青光眼是眼压升高后视觉神经受损而导致视力降低的眼科疾病。流行病学调查显示,我国青光眼患病人数超过2 000万,约占全球患病人数的28%,以中老年人群多见[1]。临床上,青光眼的治疗以药物治疗和手术治疗为主,但部分患者对药物治疗不耐受,须选择手术治疗。其中过滤性手术因具有机械损伤小等优点被广泛应用于临床。研究显示,过滤性手术后青光眼病灶出现纤维细胞分化和胶原沉淀,加快滤过道瘢痕形成[2],从而影响眼内房水的自然流动,导致眼压升高,进一步损伤视神经,最终导致视力丧失。青光眼术后瘢痕形成与多种信号通路有关,转化生长因子(transforming growth factor,TGF)-β通过介导结缔组织形成及细胞生长相关信号表达,在青光眼术后瘢痕形成过程中促进基质沉淀[3]。Rho相关激酶(Rho-associated kinase,Rock)是Ras同源家族成员A(Ras homolog family member A,RhoA)激酶,是Rho 家族的鸟苷三磷酸酶主要效应系统,其在非神经系统中高表达,具有多种生物活性,能够促进黏附斑形成[4]。正常人视神经乳头中RhoA呈低表达,但是在人工培养的青光眼视神经乳头星形胶质细胞中RhoA表达显著升高,因此我们推测RhoA/Rock信号通路的激活可能导致青光眼视神经损伤[5]。c-Ski是TGF-β/Smad信号通路中的负性调节因子,其通过干扰Smad蛋白的磷酸化和TGF-β靶基因的激活,抑制组织纤维化,进而减少瘢痕形成[6]。研究显示,c-Ski可以减少胶原沉积,促进青光眼术后伤口愈合[7],但相关机制尚未清楚。因此,本研究分析上调c-Ski基因表达对青光眼术后瘢痕形成及TGF-β、RhoA/Rock信号通路的影响。
1 材料与方法
1.1 实验动物 新西兰大白兔30只,均为雄性,体重2.0~2.5 kg,购自重庆威斯腾生物医药科技有限责任公司[动物生产许可证号:SYXK(渝)2021-0006]。按照实验动物规则进行常规饲养,手术前3 d采用CT-800非接触式眼压计(TOPCON公司)检测大白兔双眼眼压,确定为正常眼压后进行常规眼科检测,排除其他眼科疾病后进行后续试验。
1.2 主要试剂与仪器 c-Ski质粒及空白质粒由第三军医大学周元国教授赠予;TGF-β1抗体、Rock抗体、RhoA抗体购自Abcam公司(批号:gr3252552-1、gr3211461-5、gr198717/24);HE染色试剂购自生工生物工程(上海)股份有限公司(批号:1902250101);TRIzol试剂购自上海联迈生物工程有限公司(批号:LM-0010);RIPA裂解缓冲液购自上海创赛科技有限公司(批号:PM12142);二喹啉甲酸试剂盒购自上海酶联生物科技有限公司(批号:20180501);电化学发光液购自上海碧云天生物技术有限公司(批号:P0018FM);多聚甲醛购自江苏普乐司生物科技有限公司(批号:20130104)。KM1-DYCZ-24蛋白电泳仪购自北京六一生物科技有限公司;VT1200S振动切片机购自Leica Biosystems公司;Stemi-508光学显微镜购自美谷生物科技(浙江)有限公司。
1.3 建模方法和手术方法
1.3.1 青光眼兔模型的建立:所有大鼠均取右眼进行实验。造模前1 d采用氯霉素滴眼进行清洁消毒,1~2次/d。造模时,给予0.15 mL/kg速眠新肌肉注射进行麻醉,并给予眼部表面麻醉,用氯霉素冲洗结膜囊,于9:00方位沿角巩膜缘内1 mm用注射器刺入前房,抽出房水0.2 mL,然后在相同位置注入1%甲基纤维素0.1 mL。术后2 d持续监测眼压,兔眼压>24 mmHg(1 mmHg≈0.133 kPa)表明模型构建成功。本研究所有大白兔均造模成功。
1.3.2 青光眼兔滤过手术:造模成功后,给予0.15 mL/kg速眠新肌肉注射进行麻醉,然后用氯霉素冲洗结膜囊,以鼻上端角膜缘为底部制作结膜瓣,暴露巩膜,做4 mm×3 mm、深度达1/2巩膜厚度的巩膜切口,用镊子夹住角巩膜深层组织的游离边缘向后翻转,然后用剪刀剪除角巩膜深层组织1.5 mm×1 mm或2 mm×1.5 mm,使用金霉素眼膏和阿托品眼膏涂抹患眼,术后滴用氯霉素眼药水,1~2滴/次,1~2次/d,连续使用3 d。本研究所有大白兔均顺利完成手术。
1.4 动物分组及处理 将30只青光眼兔随机分为A组、B组、C组、D组和E组,每组6只。术后3 d后,C组、D组和E组均在术眼结膜下分别注射100 μg c-Ski质粒、200 μg c-Ski质粒、400 μg c-Ski质粒,B组在术眼结膜下注射400 μg空白质粒,A组在术眼结膜下注射0.5 mL PBS。
1.5 眼压检测 分别于造模前及术后2 d、4 d、7 d、14 d、28 d,采用CT-800非接触式眼压计分别检测各组兔眼压,重复检测3次,取平均值。
1.6 滤过道组织中Ⅰ型和Ⅱ型胶原面积的检测 术后2 d、4 d、7 d、14 d、28 d,取各组兔适量滤过道组织制作石蜡切片,常规脱蜡、脱水后,采用PBS冲洗3次,5 min/次,37 ℃下用羊血清封闭60 min,加入一抗,4 ℃下孵育24 h,加入二抗,37 ℃下孵育30 min,冲洗后加入50 μL链霉亲和素-生物素复合物,用二氨基联苯胺显色,冲洗,终止显色,透明、封片。将切片置于光学显微镜下,随机选择不重叠的5个高倍镜视野,采用Image-Pro Plus软件分析滤过道组织中Ⅰ型胶原面积占比和Ⅱ型胶原面积占比,即Ⅰ型胶原或Ⅱ型胶原面积与滤过道组织面积的比值,取平均值。
1.7 实时荧光定量PCR检测滤过道组织中c-Ski、TGF-β1、Rock、RhoA 的mRNA表达水平 术后28 d,取各组兔滤过道组织100 g,用眼科无菌剪剪碎,研磨,过100目筛。加入胰蛋白酶进行消化,取细胞重悬液,用Tween-Tris缓冲盐水冲洗3次,5 min/次,然后置于无菌试管,采用TRIzol试剂提取总RNA,采用紫外分光光度计法测定RNA浓度,反转录获得cDNA后,以cDNA为模板,进行实时荧光定量PCR。PCR的反应体系:SYBR Green PCR Master Mix(2×)12.5 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,模板cDNA 2 μL,加入ddH2O至总体积为25 μL。引物序列见表1。PCR的反应条件:98 ℃预变性6 min;98 ℃变性28 s,75 ℃退火30 s,80 ℃延伸4 min,共55个循环。
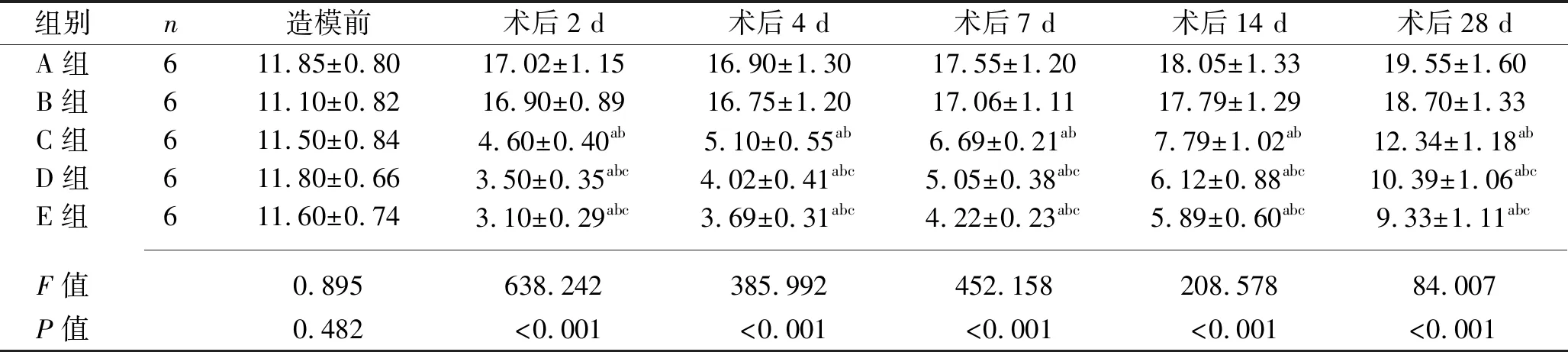
表1 不同时间点各组兔眼压的比较(x±s,mmHg)

表1 引物序列
1.8 HE染色观察滤过道组织病理学表现 术后28 d取各组兔滤过道组织,使用10%甲醛溶液固定1 d,并使用10%乙二胺四乙酸进行脱钙处理,12 d后取出,经过梯度乙醇脱水、石蜡包埋、切片后,加入1%二甲苯和纯酒精混合液浸泡6 min,采用碱性苏木精染色10 min后,采用PBS冲洗过多的染液,然后用80%酒精分化处理15 min,用PBS充分冲洗后,用0.5%酸性伊红染色5 min,用PBS透明2次后,在显微镜下进行观察。
1.9 Western blot检测滤过道组织中TGF-β1、Rock、RhoA的蛋白表达水平 术后28 d取各组兔滤过道组织,采用RIPA裂解缓冲液进行裂解,提取总蛋白,采用二喹啉甲酸试剂盒检测总蛋白浓度,将蛋白溶液和缓冲溶液按照4 ∶1的比例混匀后煮沸,使蛋白质变性,4 ℃下以12 000 r/min离心10 min,取上清液加入上样孔,进行SDS-PAGE分离蛋白,然后通过电转印将蛋白转至PVDF膜,采用Tris缓冲盐溶液浸泡PVDF膜10 min,用PBS反复冲洗后,分别加入一抗TGF-β1、Rock及RhoA抗体(稀释比例均为1 ∶500)各20 μL/mL,4 ℃孵育过夜。用TBST洗涤3次,5 min/次,然后加入20 μL的辣根过氧化物酶标记的山羊抗兔IgG二抗(稀释比例为1 ∶500),杂交5 min后采用PBS冲洗3次,5 min/次,然后放入电化学发光液中,用二氨基联苯胺显色后照相。用Image J软件分析蛋白条带的灰度值,以GAPDH(稀释比例均为1 ∶5 000)为内参,计算目的蛋白的相对表达水平。
1.10 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验;重复测量资料的比较采用重复测量方差分析。以P<0.05表示差异有统计学意义。
2 结 果
2.1 不同时间点各组兔眼压的比较 主效应分析结果显示,5组兔眼压差异具有统计学意义(F组间=105.900,P组间<0.001),5组兔眼压有随时间变化的趋势(F时间=1 020.000,P时间<0.001)。兔眼压的分组与时间有交互效应(F交互=47.950,P交互<0.001),故应对兔眼压进一步行分组因素和时间因素的单独效应分析。结果显示,术后2 d、4 d、7 d、14 d、28 d,与A组及B组比较,C组、D组、E组兔眼压均降低,与C组比较,D组和E组兔眼压均降低(均P<0.05)。随着术后时间的延长,5组兔眼压总体呈升高趋势。见表1。
2.2 术后各组兔滤过道组织中Ⅰ型和Ⅱ型胶原面积占比的比较 主效应分析结果显示,5组兔Ⅰ型胶原面积占比差异具有统计学意义(F组间=258.700,P组间<0.001),5组兔Ⅰ型胶原面积占比有随时间变化的趋势(F时间=141.100,P时间<0.001)。Ⅰ型胶原面积占比的分组与时间有交互效应(F交互=3.815,P交互<0.001),故应对兔Ⅰ型胶原面积占比进一步行分组因素和时间因素的单独效应分析。结果显示,术后2 d、4 d、7 d、14 d、28 d,与A组及B组比较,C组、D组、E组兔Ⅰ型胶原面积占比均降低,且C组、D组、E组兔Ⅰ型胶原面积占比依次降低(均P<0.05)。随着术后时间的延长,5组兔Ⅰ型胶原面积占比逐渐升高。见表2。
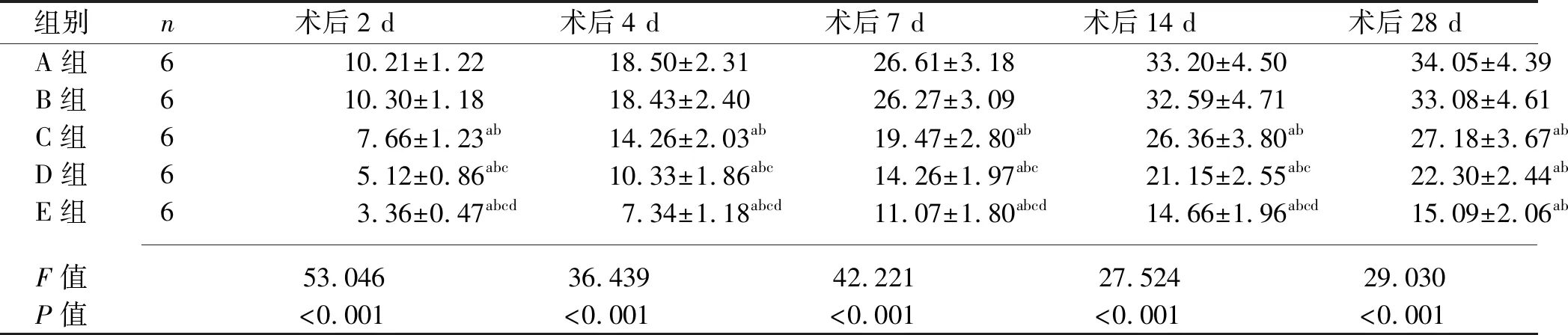
表2 术后各组兔滤过道组织中Ⅰ型胶原面积占比的比较(x±s,%)
主效应分析结果显示,5组兔Ⅱ型胶原面积占比差异具有统计学意义(F组间=45.280,P组间<0.001),5组兔Ⅱ型胶原面积占比有随时间变化的趋势(F时间=6.694,P时间<0.001)。Ⅱ型胶原面积占比的分组与时间有交互效应(F交互=6.694,P交互<0.001),故应对兔Ⅱ型胶原面积占比进一步行分组因素和时间因素的单独效应分析。结果显示,术后14 d,与A组及B组比较,C组、D组、E组兔Ⅱ型胶原面积占比均降低,且C组、D组、E组兔Ⅱ型胶原面积占比依次降低(均P<0.05)。随着术后时间的延长,5组兔Ⅱ型胶原面积占比先升高后降低。见表3。
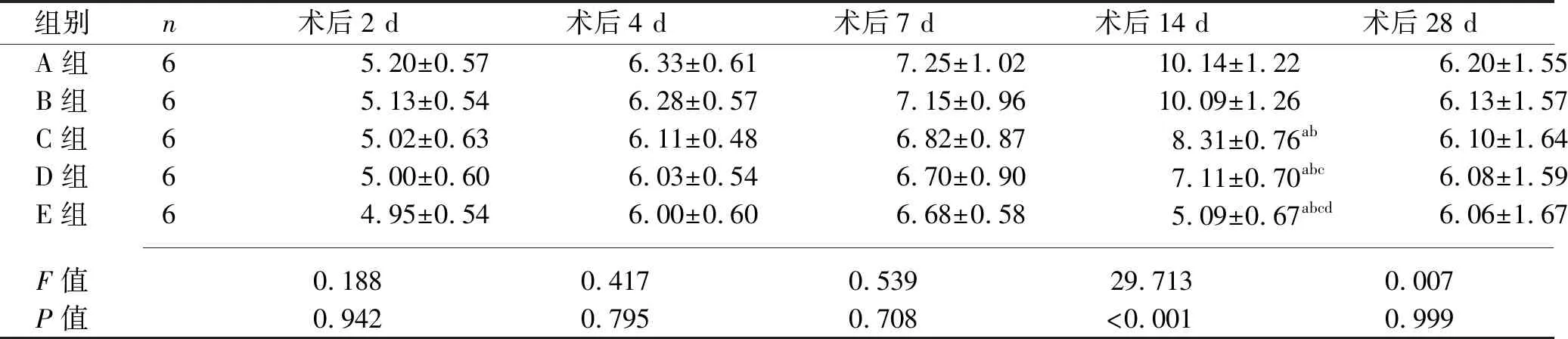
表3 术后各组兔滤过道组织中Ⅱ型胶原面积占比的比较(x±s,%)
2.3 术后28 d各组兔滤过道组织中c-Ski、TGF-β1、Rock及RhoA mRNA表达水平的比较 与A组和B组相比,C组、D组、E组兔滤过道组织中c-Ski mRNA表达水平升高,TGF-β1、Rock及RhoA mRNA表达水平均降低,且C组、D组、E组c-Ski mRNA表达水平依次升高,TGF-β1、Rock及RhoA mRNA表达水平依次降低(均P<0.05)。见表4。

表4 术后28 d各组兔滤过道组织中c-Ski、TGF-β1、Rock及RhoA mRNA相对表达水平的比较(x±s)
2.4 术后28 d各组兔滤过道组织的病理学表现 术后28 d,在A组和B组的滤过道组织中可见大量胶原纤维,组织排列紊乱,炎症细胞浸润;在C组、D组和E组滤过道组织中胶原纤维减少,组织排列及边界清晰,炎症细胞浸润减少,无新生胶原纤维。见图1。
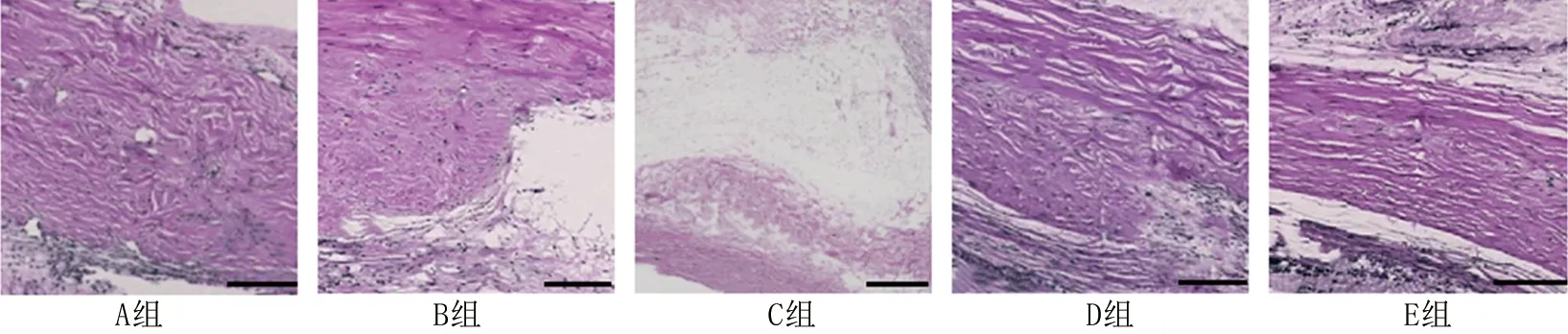
图1 各组兔滤过道组织的病理学表现(HE染色,×200)
2.5 术后28 d各组兔滤过道组织中TGF-β1、Rock及RhoA蛋白表达水平的比较 与A组和B组相比,C组、D组、E组兔滤过道组织中TGF-β1、Rock及RhoA蛋白表达水平降低,且C组、D组、E组上述蛋白表达水平依次降低(均P<0.05)。见表5和图2。
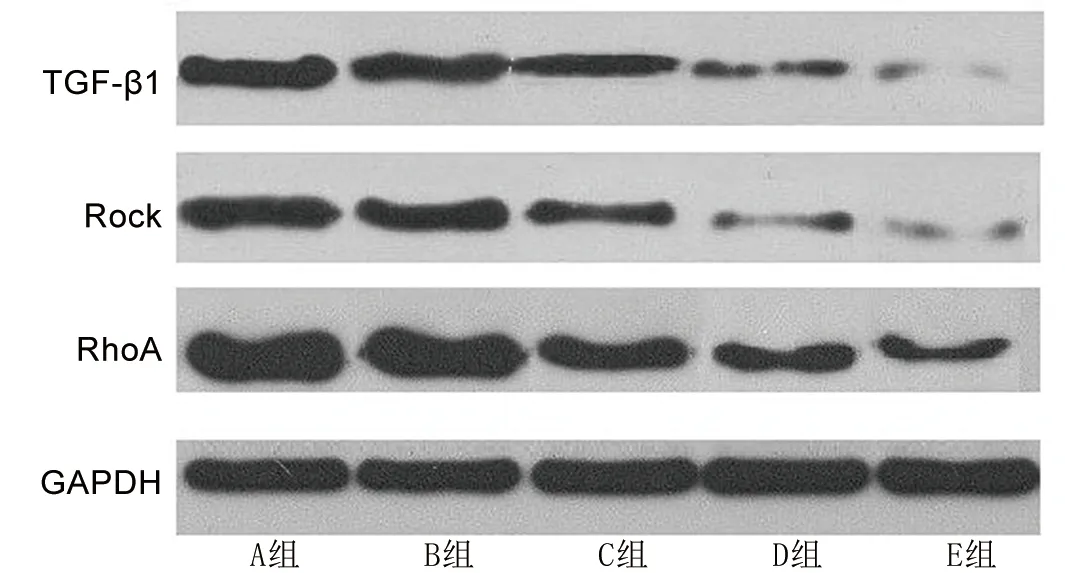
图2 各组兔滤过道组织中TGF-β1、Rock及RhoA蛋白电泳图
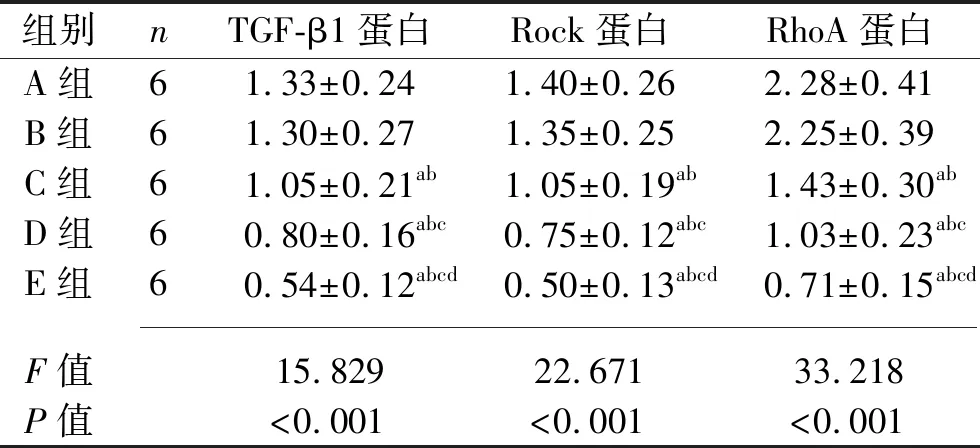
表5 术后28 d各组兔滤过道组织中TGF-β1、Rock及RhoA 蛋白相对表达水平的比较(x±s)
3 讨 论
外科手术是治疗青光眼患者的有效方法,而滤过性手术后瘢痕形成是导致手术失败的主要原因[8]。青光眼术后瘢痕形成与眼压升高、眼部组织损伤、炎症细胞及成纤维细胞增多有关[9]。成纤维细胞活性增强会加快胶原蛋白合成,导致滤过道瘢痕形成[10]。成纤维细胞自身还可分泌Ⅰ型胶原,Ⅰ型胶原沉积是瘢痕组织纤维化的基础[11]。c-Ski基因广泛存在于胚胎组织,参与细胞生长的调节及信号因子的转移[12]。有研究显示,c-Ski的过表达能够促进细胞增殖,有利于组织创伤修复[13]。然而c-Ski具有多重生物活性,对纤维细胞的作用较复杂,上调c-Ski表达能够降低眼压及Ⅰ型胶原面积占比,且呈剂量依赖性[14],还能减少炎症因子的分泌,稳定滤过泡,具有改善青光眼病情的作用[15]。c-Ski的过表达还能够减少纤维增生及Ⅰ型胶原合成,达到治疗青光眼的目的[16],这可能与上调c-Ski基因能够通过阻止Smad2/3信号转录,抑制滤过道瘢痕形成有关[17]。本研究结果显示,术后2 d、4 d、7 d、14 d、28 d,C组、D组及E组兔眼压均低于A组和B组,D组和E组兔眼压均低于C组(均P<0.05),E组兔眼压略低于D组,但两组间差异无统计学意义(P>0.05);与A组和B组相比,C组、D组、E组Ⅰ型胶原面积占比降低,且C组、D组、E组Ⅰ型胶原面积占比依次降低(均P<0.05)。提示术后兔眼压水平、Ⅰ型胶原面积占比与c-Ski的表达水平总体上呈现负相关。而术后2 d、4 d、7 d、28 d,各组兔滤过组织中Ⅱ型胶原蛋白面积占比差异均无统计学意义(均P>0.05),这可能与Ⅱ型胶原在青光眼术后滤过道组织中的占比较小、作用较弱[18]有关。上述结果说明上调c-Ski表达能降低青光眼兔术后的眼压,减少胶原合成,对青光眼术后瘢痕的形成有抑制作用,并呈现浓度依赖性。这与Pokrajac等[19]的研究结果相似。
研究显示,青光眼患者房水TGF-β1水平升高,TGF-β1能够促进纤维细胞生成,参与伤口愈合过程[20]。青光眼术后,TGF-β1能够调节细胞外基质(如纤维连接蛋白),促进青光眼术后瘢痕形成[21],而TGF-β1受体能够激活Smad3发生磷酸化,抑制瘢痕愈合[22]。有学者认为,降低TGF-β1活性能够抑制青光眼大鼠纤维细胞增殖和瘢痕形成[23]。RhoA是一种鸟苷三磷酸酶,在循环系统中发挥信号通路开关的作用。除对纤维细胞有调节作用外,RhoA还参与细胞黏附及细胞迁移。Rock属于蛋白激酶,在接收到RhoA信号后其表达水平升高并参与氨基酸磷酸化,调节细胞运动[24]。近年有学者指出,RhoA/Rock信号通路参与纤维化病变的发生过程,在青光眼术后瘢痕中RhoA和Rock mRNA表达水平升高,表明RhoA/Rock参与瘢痕的发生和发展[25]。Liu等[26]的研究显示,TGF-β1能够刺激RhoA/Rock蛋白表达,促进瘢痕形成,RhoA/Rock信号通路有可能成为治疗瘢痕的靶点之一。本研究结果显示,与A组和B组相比,C组、D组、E组兔滤过道组织中TGF-β1、Rock及RhoA 的mRNA和蛋白表达水平均降低,且C组、D组、E组的上述指标依次降低(均P<0.05)。说明上调c-Ski表达能抑制RhoA、Rock和TGF-β1的表达,进而改善青光眼术后瘢痕形成。
本研究存在一定局限性,如未建立空白对照组、RhoA/Rock和TGF-β1抑制剂组进行对照分析,c-Ski干预时间及干预次数还需要完善。今后还应进一步完善实验方法。
综上所述,上调c-Ski基因表达能够降低青光眼兔术后的眼压,减少胶原合成,抑制瘢痕形成,这可能与其抑制TGF-β1及RhoA/RocK信号通路有关。

