一株乳突赤壳属蕨麻致病菌的鉴定及生物学特性
王鑫慈, 李军乔, 李晨芹, 田甜, 曲俊儒
(青海民族大学生态环境与资源学院,青藏高原蕨麻产业研究院,西宁 810007)
蕨麻(Potentilla anserinaL.)属于蔷薇科(Rosacrae)委陵菜属(Potentilla)多年生匍匐草本植物,为鹅绒委陵菜(Potentilla anserinaL.)的变种。野生蕨麻主要分布于青藏高原地区,高品质资源主要集中于青海省。蕨麻是典型的匍匐茎克隆植物,其匍匐茎和分株在生长过程中能够迅速覆盖地面,具有优秀的气候适应性,且耐寒、耐旱、抗盐碱能力较强,因此可以蓄水保墒、防风固沙,具有一定的生态价值[1-2]。此外,蕨麻全草可入药,具有收敛止血、生津利痰、补血益气的功效,是藏药中的主要药材,有重要的药用价值和经济价值。近年来,众多学者对蕨麻的种质资源、繁殖栽培技术、药用成分等展开研究[2-6];蕨麻的人工栽培规模也日渐扩大,在青海、甘肃等地推广的3个审定品种其种植面积已达10万余亩(0.67万hm2),作为当地的新兴产业,带动当地农民脱贫致富。随着蕨麻的推广种植和连作年限的增加,近几年人工种植的蕨麻出现了块根腐败及黑斑的症状,对蕨麻的产量及品质产生了较大影响[7-8]。造成根腐病的病原有真菌、细菌及线虫,其中真菌是主要致病菌[9-10]。由真菌侵染感病的植株较健康植株生长缓慢,茎叶最初会变黄,然后逐渐枯萎,最后根部腐败[11-12]。目前国内外对蕨麻病害的相关研究较少,因此明确蕨麻根腐病病原菌的种类及生物学特性,进一步了解该病害的发病规律,可为制定蕨麻根腐病综合防治策略提供有效手段。
本研究以采自中国青海省西宁市门源回族自治县蕨麻人工种植基地的感染根腐病的块根中分离的1株菌株为研究对象,对该菌株进行生物学特性研究,主要包括病原菌的分离鉴定及在不同生长环境和营养条件下研究该菌株的生长速率及产孢量,以期为今后蕨麻根腐病的监测和治理提供一定的科学依据。
1 材料方法
1.1 试验材料
根腐病病原菌株MY-BSX4-1从青海省门源回族自治县蕨麻人工种植基地蕨麻根腐病发病部位分离纯化获得。回接植物材料为同一地点的健康蕨麻块根。
1.1.1 供试培养基 供试培养基包括马铃薯培养基(potato dextrose agar, PDA)、查氏(Czapek)培养基、pH梯度培养基、蕨麻煎汁培养基和LB培养基,各培养基的配制如下。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1000 mL,自然pH,121 ℃高压灭菌20 min。
查氏培养基:KCl 0.5 g,Fe2SO40.01 g,K2HPO41 g,MgSO4·7H2O 0.5 g,蔗糖30 g,NaNO32 g,琼脂粉20 g,蒸馏水1000 mL,在此基础上,用不同碳源替代蔗糖、不同氮源替代硝酸钠,作为不同营养条件处理。其中碳源包括缺碳对照、葡萄糖、蔗糖、乳糖、淀粉、果糖、甘露醇;氮源包括缺氮对照、甘氨酸、磷酸氢铵、硝酸铵、硫酸铵、蛋白胨、牛肉浸膏。
pH梯度培养基:将配好的PDA液体培养基每50 mL分装入100 mL锥形瓶,用0.1 mol·L-1的NaOH和HCl调节pH分别为3、4、5、6、7、8、9、10、11、12(用pH计进行测定),然后加入琼脂粉0.5 g·瓶-1。
蕨麻煎汁培养基:蕨麻块根200 g,琼脂20 g,蒸馏水1000 mL,自然pH,121℃高压灭菌20 min。其中加葡萄糖的蕨麻煎汁培养基添加20 g葡萄糖作为碳源;加硝酸钠的蕨麻煎汁培养基添加2 g硝酸钠作为氮源。
LB(Luria-Bertani)培养基:酵母提取物5 g,蛋白胨10 g,NaCl 5 g,琼脂粉20 g,蒸馏水1000 mL,pH 7.0。
1.1.2 供试试剂 Taq DNA Polymerase等扩增所用试剂均购自TaKaRa公司;PCR Purification Kit购自Promega;引物由华大基因合成;DNA提取试剂盒购自北京博友顺生物技术有限公司。
1.1.3 供试仪器 PCR仪为Biometra公司生产的Tgradient;测序仪3730为ABI公司生产;凝胶成像仪由DNR BIO IMAGING SYSTEM以色列DNR成像系统有限公司生产;荧光显微镜Nikon EXCLIPSEND为日本Nikon公司生产。
1.2 试验方法
1.2.1 分离与纯化 采用组织分离法[13-14]进行病原菌的分离纯化。首先将患病块根用自来水充分冲洗干净,滤纸吸干;然后切取病健交界处组织块,用75%乙醇进行块根的表面消毒5 s,无菌水充分冲洗3次后,置于PDA平板上,25 ℃培养4 d后挑取菌落边缘菌丝到新PDA平板,重复纯化操作2次;最后将纯化后菌株接种于PDA培养基,4 ℃保存备用。
1.2.2 分离物的形态学观察 用直径5 mm打孔器,从预培养4 d的菌落边缘打取菌饼,并接种到PDA平板中央位置,在25 ℃恒温条件下培养15 d,观察病原菌特征,主要观察菌落的形状、颜色、菌丝致密度等。首先在载玻片上滴加少量无菌水,用接种针分别在病原菌菌落边缘和中央挑取少量菌丝,置于载玻片上的无菌水中,将盖玻片盖在无菌水的位置制成临时玻片;然后在生物荧光相差显微镜(10×40)下观察分离物的分子孢子梗、分生孢子形态,并拍照记录[15]。
1.2.3 分离物的分子生物学鉴定 采用CTAB法提取病原菌DNA;然后以提取的DNA作为PCR模板,以真菌通用引物ITS1(5’-TCCGTAGGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)进行PCR扩增。PCR程序为:94 ℃ 3 min;94 ℃1 min,55 ℃ 1 min,72 ℃ 2 min,30个循环;72 ℃5 min。PCR产物经1.5 %琼脂糖凝胶电泳检测后由北京博友顺生物技术有限公司完成测序,测序结果在BLAST中进行序列比对,用MEGA软件中的neighbor joining(NJ)程序构建系统进化树。
1.2.4 分离物的致病性测定与再分离 采用孢子液涂抹接种法[16]进行致病性测定。首先用直径5 mm 打孔器,从预培养4 d的菌落边缘打取菌饼,并接种到PDA平板中央位置,在25 ℃恒温条件下培养7 d后,每个培养皿添加5 mL无菌水,利用涂布器使无菌水充分接触菌落,并刮取分生孢子,4层无菌纱布过滤后获得孢子悬液;然后利用血球计数板测定其含量,并将孢子悬液稀释至107个·mL-1;最后将孢子液均匀涂抹在蕨麻块根上,重复3次,每个重复接种5个块根,保湿并室温培养,观察发病情况。若接种块根发病则再分离致病菌,完成柯赫法则验证。
1.2.5 病原菌生物学特性研究 温度对病原菌生长速率和产孢量的影响:用直径5 mm 打孔器,从预培养4 d的菌落边缘打取菌饼,并接种到PDA平板中央位置,分别置于 5、10、15、20、25、28、30、35 ℃温度条件下,倒置培养,每个处理3次重复。分别在培养3、5 d时用直尺十字交叉法测量并记录菌落生长直径。培养5 d后用直径5 mm 打孔器在菌落上打取4个菌饼,将4个菌饼置于1.5 mL EP管中,加入1 mL ddH2O充分震荡,洗下孢子,用血球计数板计数法测定产孢量[17]。
光照对病原菌生长速率和产孢量的影响:接种方法同上,培养条件分别为24 h光照、12 h光照+12 h黑暗、24 h黑暗,温度设定为25 ℃,每个处理3次重复。菌落生长直径和产孢量的测定方法同上。
pH对病原菌生长速率和产孢量的影响:将配制好pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0的PDA培养基高压灭菌。接种方法同上,温度设定为25 ℃,每个处理3次重复。菌落生长直径和产孢量的测定方法同上。
碳源对病原菌生长速率和产孢量的影响:以查氏培养基为基础培养基,分别用等量葡萄糖、乳糖、淀粉、果糖、甘露醇替换基础培养基中的蔗糖。接种方法同上,温度设定为25 ℃,每个处理3次重复。菌落生长直径和产孢量的测定方法同上。
氮源对病原菌生长速率和产孢量的影响:以查氏培养基为基础培养基,分别用等量甘氨酸、磷酸氢铵、硝酸铵、硫酸铵、蛋白胨、牛肉浸膏替换基础培养基中的硝酸钾。接种方法同上,温度设定为25 ℃,每个处理3次重复。菌落生长直径和产孢量的测定方法同上。
1.3 数据分析
利用Origin 2021对数据进行图表制作,用SPSS 24对数据进行统计分析。
2 结果与分析
2.1 田间症状观察与病原菌分离
菌株MY-BSX4-1引起的蕨麻根腐病的主要症状部位为蕨麻的根部和茎基部。在发病初期,植株地上茎叶部分枯萎变黄,个别枝叶萎蔫枯死,病部表面常聚生大量黑色凸起小颗粒,茎基部和根部逐渐变为褐色、腐烂;后期植株茎叶枯萎变黄加重,甚至全株枯死,根部腐烂坏死(图1)。
2.2 形态学鉴定
在门源进行田间蕨麻根腐病病害调查时,发现病部后期表面常聚生大量黑色小颗粒(图2A)。将病原菌在PDA平板上培养,菌落初为白色,质地致密,之后菌落中心颜色逐渐加深呈红棕色,菌落背面外缘白色,中间为橙红色至红棕色(图2B和C)。

图2 菌株MY-BSX4-1的形态学鉴定Fig. 2 Morphological identification of MY-BSX4-1
经显微镜观察,可见子囊壳近球形,表面具粗糙疣状物,直径117~184 µm(图2D);菌丝为无隔菌丝,直径4.0~6.0 µm(图2E)。大型分生孢子呈镰刀形,中部细胞宽,顶胞渐尖,两端较钝,具2~4 个分隔,大小为(13.9~28.5) µm×(5.2~8.3) µm(图2F)。小型分生孢子多为单细胞,椭圆形,大小为(7.15~12.04) µm×(2.68~3.88) µm(图2G)。产孢方式为单瓶梗产孢,分生孢子梗树枝状(图2H)。根据病原菌的菌落形态特征、子囊壳及分生孢子的形态特征,初步鉴定该菌为Thelonectria属真菌。
2.3 分子生物学鉴定
采用真菌通用引物ITS1和ITS4进行PCR扩增,凝胶电泳后,在500 bp处得到1条清晰的条带(图3)。将扩增产物进行测序其大小为517 bp,利用BLAST对序列进行比对分析,选取相似性较高的序列,用MEGA构建系统发育树(图4),结合其形态学特征,进一步确定该病原菌为乳突赤壳属(Thelonectria olida)。
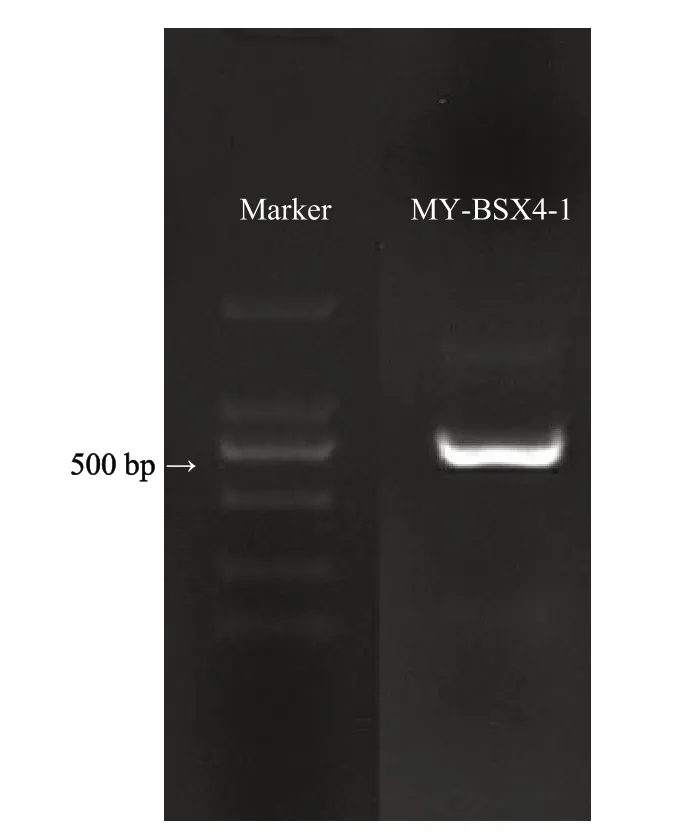
图3 PCR扩增产物电泳结果Fig. 3 Results of PCR amplification products

图4 菌株MY-BSX4-1的系统发育树Fig. 4 Phylogenetic tree of MY-BSX4-1
2.4 致病性与柯赫氏法则验证
将菌株分别接种于蕨麻离体块根部和活体蕨麻植株块根部,并将活体蕨麻植株土培,观察并记录发病情况。结果(图5)表明,将菌株MY-BSX4-1接种到离体的蕨麻块根上,与对照相比,有伤口和无伤口的蕨麻块根均具有发病症状,产生黑色病斑,并长出白色菌丝,块根出现腐烂(图5A~H)。将菌株MY-BSX4-1接种在盆栽蕨麻植株上,接种7~15 d后植株染病,逐渐萎蔫变黄,根部产生黑色斑点,发病症状与田间相似,对照不发病(图5I~N)。对离体和活体回接后发病病样的病健交界处再次分离,获得与原接种分离物一致的病原菌。根据柯赫氏法则可以确定菌株MY-BSX4-1为蕨麻根腐病的致病菌。

图5 人工接种MY-BSX4-1后蕨麻植株的发病症状Fig. 5 Symptoms of diseased plant after artificial inoculation of MY-BSX4-1
2.5 MY-BSX4-1 的生物学特性
2.5.1 不同温度、光照及pH对MY-BSX4-1生长速率和产孢量的影响 将病原菌在5~35 ℃培养5 d,结果表明病原菌具有较宽的温度适应范围。其中,在5~10 ℃温度范围内菌丝生长缓慢且未产孢;在10~35 ℃范围内菌丝均可较好生长,但在35 ℃时未产孢。25 ℃时菌丝生长速率最高,产孢量最大,因此最适生长和产孢温度均为25 ℃。5~25 ℃菌丝生长速率和产孢量随着培养温度的升高而增大,在25 ℃条件下达到峰值;当温度高于30 ℃后菌株的生长速率和产孢量呈下降趋势。
光照对病原菌有一定影响(图6B)。3种光照条件下病原菌均可生长和产孢,其中,在24 h光照条件下病原菌的菌丝生长及产孢量显著高于24 h黑暗。
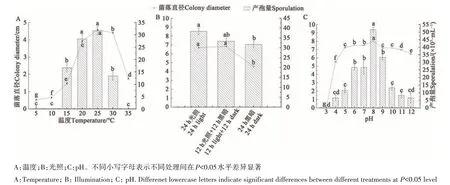
图6 不同生物学特性下MY-BSX4-1菌丝的生长和产孢Fig. 6 Mycelium growth and sporulation of MY-BSX4-1 under different biological characteristics
由图6C可知,病原菌pH适应范围较宽,在pH为4~12时均可生长,最适pH为6~9,表明病原菌在中性条件下生长活跃。pH在5~12时,菌落直径差异较小,但pH为3时,菌落生长受到明显抑制。菌株在pH 4~12时均可产孢,当pH为8时,产孢量达到峰值。
2.5.2 不同碳源、氮源及培养基对MY-BSX4-1生长速率和产孢量的影响 在不同碳源的培养基上,病原菌的生长速率和产孢量存在显著差异,其中最适生长碳源为可溶性淀粉;最适产孢碳源为乳糖(表1)。对不同碳源培养基进行比较,菌株的生长速率表现为可溶性淀粉>葡萄糖>蔗糖>乳糖>甘露醇>缺碳对照>果糖;产孢量表现为乳糖>葡萄糖>果糖>淀粉>缺碳对照>蔗糖>甘露醇。

表1 不同碳源下MY-BSX4-1的菌丝生长及产孢Table 1 Growth and sporulation of MY-BSX4-1 mycelium under different carbon source
在不同氮源的培养基上,病原菌的生长速率和产孢量差异显著,其中最适生长氮源为牛肉浸膏;最适产孢氮源为蛋白胨,而缺氮或以甘氨酸为氮源时不产孢(表2)。对不同氮源培养基进行比较,生长速率表现为牛肉浸膏>蛋白胨>硫酸铵、缺氮对照>甘氨酸>磷酸氢铵>硝酸铵;产孢量表现为蛋白胨>硫酸铵>牛肉浸膏>磷酸氢铵>硝酸铵。

表2 不同氮源下MY-BSX4-1的菌丝生长及产孢Table 2 Mycelium growth and sporulation of MY-BSX4-1 under different nitrogen source
由表3可知,在不同供试培养基上,病原菌的生长速率和产孢量显著不同,其中在蕨麻煎汁培养基和含硝酸钠的蕨麻煎汁培养基上,菌丝的生长速率和产孢量均显著优于其他培养基,25 ℃下培养5 d,菌落直径分别可达6.82和7.00 cm,产孢量分别为0.45×107和0.43×107个·mL-1。在含葡萄糖的蕨麻煎汁培养基上菌丝生长情况较好,但产孢量低于另2种蕨麻煎汁培养基。在LB、PDA和查氏培养基中,菌丝的生长情况表现为PDA培养基>查氏培养基>LB培养基,但这3种培养基对产孢量无显著影响(表3)。

表3 不同培养基下MY-BSX4-1菌丝生长及产孢Table 3 Mycelium growth and sporulation of MY-BSX4-1 under different mediums
2.5.3 菌丝致死温度测定 MY-BSX4-1的菌丝经过35~45 ℃恒温水浴10 min处理后,菌丝尚有活性,能够在PDA培养基上继续生长;当恒温水浴温度高于50 ℃后,菌丝失活,不能在培养基上继续生长。由此能够初步确定,MY-BSX4-1菌丝的致死温度在45~50 ℃之间。在45~50 ℃范围内,以1 ℃为梯度,设置6个温度梯度继续恒温水浴处理,结果(图7)显示,在45~47 ℃菌丝能够继续生长,高于47 ℃菌丝不能继续生长,因此可以确定MY-BSX4-1菌丝致死温度为47 ℃(10 min)。
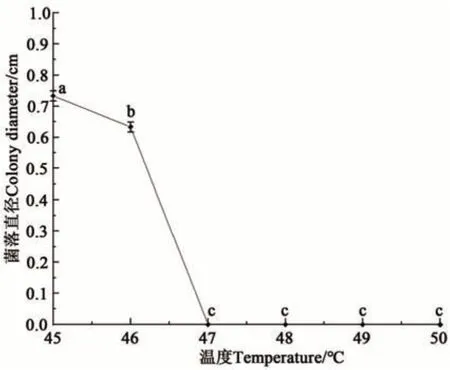
图7 MY-BSX4-1的菌丝致死温度Fig. 7 Fatal temperature of MY-BSX4-1 mycelium
3 讨论
蕨麻是青藏高原地区特有的植物,具有较高的经济价值与生态价值,由于其地域局限性较大,所以栽培面积有限。前人对蕨麻病害的研究较少,种植者对其病害的防治也不够重视。目前对真菌引起的植物根腐病研究较多,如紫花苜蓿、地黄、黄芪、三七、丹参等物种上已有较多相关报道[18-23]。明确病原是研究病害发生规律和制定有效防治措施的前提。李晨芹等[24]研究发现,镰孢菌(Fusarium perseae)可引起蕨麻根腐病,该病原引起的病害典型症状是植株生长缓慢,且茎叶枯萎变黄,根部腐烂坏死。本实验室从青海省门源回族自治县蕨麻人工种植基地蕨麻根腐病发病部位分离纯化获得1株原菌株MY-BSX4-1,该菌株引发的病害特征为患病处外表皮会附着黑色斑点,随着时间的延长黑斑多,根部逐渐腐烂坏死。结合形态学、分子生物学和致病性验证方法将其鉴定为乳突赤壳属(Thelonectria olida)病原真菌。人工接种该菌株后,蕨麻发病症状与蕨麻根腐病田间症状一致,且该菌株在蕨麻损伤和非损伤情况下均能对蕨麻块根致病。据报道,乳突赤壳属真菌主要分布于热带、亚热带及温带地区,部分种类是植物病原菌,能够导致植物溃疡[25]。乳突赤壳属真菌还能够引起葡萄黑根病、阔叶树及灌木的一些病害[26-27],该病害的高发期为6-7月。本研究表明,菌株MY-BSX4-1的适宜生长温度为25~30 ℃;合理光照更有利于菌丝体生长,但对孢子萌发无显著影响;pH 6~9时有利于菌丝体生长和孢子萌发;该菌株的可利用碳源和氮源也较为广泛,其中最有利于该菌生长的碳源为可溶性淀粉和葡萄糖,最适氮源为牛肉浸膏。病原菌生物学特性的研究为防治药剂的筛选和田间管理提供了理论依据。

