钙、镁缺乏对香蕉幼苗生长及养分吸收的影响*
林姜岑,王子豪,2,王子琨,范声浓,王烁衡,葛梅红,林 电
(1 海南大学,海口 570228)(2 中国农业大学)
香蕉在我国有2 000 多年的栽培历史,随着香蕉产业的不断发展,我国现已成为世界第二大香蕉生产国和消费国[1-2]。据FAO(联合国粮食及农业组织)统计,2019 年我国香蕉收获面积34.40 万hm2,占世界香蕉总收获面积的6.67%,香蕉总产量1 165.57 万t,仅次于印度[3]。然而在海南省,自2014年起香蕉产量逐年下降,截至2019 年,海南省香蕉产量与2014 年相比降低了26.96%[4]。海南省香蕉产量降低,除病害因素导致种植面积缩减外,营养问题始终是制约香蕉产量增长的重要因素之一。海南省常年高温多雨,土壤养分极易流失[5],加之海南省香蕉种植区域分散,以个体户经营为主,且蕉农种植技术水平较低[6],因此,在香蕉种植过程中营养失调问题非常严重。
目前,对香蕉的营养研究主要集中在氮、磷、钾等大量元素[7-9],尚缺乏对钙、镁胁迫下香蕉生长及生理生化指标变化的研究,而且钙、镁胁迫对香蕉各器官养分含量变化、累积、分配及养分平衡状况的影响尚不清晰。
为探讨钙、镁缺乏对香蕉幼苗生理生化指标及养分吸收、运输及分配的影响,更好地指导香蕉营养诊断施肥,本研究采用沙砾培养的方法,探讨钙、镁营养胁迫对香蕉幼苗生理生化指标、生长、形态及根系等的影响[6],并通过对不同组织养分含量的分析,探讨钙、镁缺乏对香蕉养分含量、累积量的影响,以期为大田香蕉营养诊断与科学施肥提供理论依据。
1 材料与方法
1.1 试验材料
宝岛蕉(Musa acuminateL.AAA Cavendish.cv.Formosana)幼苗在沙床中炼苗至四叶一心后假植到供试容器中,每盆1 株。
选用0.2~1.0 mm 的细沙(主要成分SiO2),使用之前先用自来水浸泡并反复冲洗,除去黏土、有机质等杂质,直至洗涤的水呈无色透明。再用3%盐酸溶液浸泡1 周(除去其中的碳酸钙),1 周后用蒸馏水冲洗,直至洗出的水无明显的氯离子反应,暴晒晾干后装盆[10]。移植前,浇灌每盆介质最大持水量2 倍的蒸馏水,以代换细沙中残留的离子。
供试容器(上口直径×底部直径×高:15.5 cm×12.0 cm×15.0 cm)为底部带有排水孔的聚乙烯塑料盆(可装细沙2.5 kg)。
1.2 试验设计
试验时间为2021 年3 月19 日至6 月10 日(历时13 周),地点位于海南省海口市海南大学农科楼东附楼3 楼实验室,该地光热资源充足,年平均气温24.4 ℃,平均年空气相对湿度85%,属热带季风性气候。
试验共设置3 个处理:正常处理(CK),采用完全营养液;缺钙处理(-Ca),采用缺钙营养液;缺镁处理(-Mg),采用缺镁营养液。营养液具体组成如表1 所示。1 盆(每盆1 株)宝岛蕉幼苗为1 次重复,每个处理3 次重复。移苗后用去离子水缓苗7 d,而后采用改良的霍格兰营养液进行培养,根据天气和苗生长情况每天浇灌1~2 次,每次浇灌至盆底有少量水渗出。

表1 改良的霍格兰营养液组成
1.3 测定项目与方法
1.3.1农艺性状测定
宝岛蕉幼苗定植后,每7 d 对幼苗株高、茎粗、叶片数、SPAD 值进行1 次测量和记录,测量方法:株高,用直尺测量植株基部到最新完全展开叶与株茎交叉点的距离;茎粗,用游标卡尺测量距介质表面2 cm 处香蕉假植苗茎秆直径;总叶片数,记录香蕉苗总共抽生的叶片数;SPAD 值,用叶绿素计(SPAD-502 Plus)测定。13 周培养结束后,用SCAN-GXY-A 根系扫描仪进行根系扫描得出根系二维数据。
1.3.2光合作用测定
13 周培养结束后,用Li-6400 光合作用测定仪测定香蕉苗的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)。测定时温度30 ℃,光照强度1 600 μmol·m-2·s-1,CO2浓度440 μmol/mol,流速500 μmol/s,每个处理选择3 片完全展开的功能叶进行测定。
1.3.3养分含量测定
将不同处理宝岛蕉苗的根、茎、叶分开称取鲜重,再分别装入信封放入烘箱,105 ℃杀青0.5 h之后70 ℃烘干至恒重,分别称取干重[11]。粉碎上述干样品,装入密封袋待用,测定样品中的氮(N)、磷(P)、钾(K)、钙(Ca)、镁(Mg)含量,具体方法如表2 所示[11]。

表2 N、P、K、Ca、Mg 养分含量测定方法
1.4 数据分析
采用Microsoft Excel 2013、SPSS Statistics 20.0、Canoco 5 和Origin 8.0 软件进行数据处理和制图。
2 结果与分析
2.1 钙、镁缺乏对宝岛蕉幼苗生长动态的影响
由图1 可知,钙、镁缺乏基本不影响宝岛蕉幼苗的茎粗和叶片数。镁胁迫对宝岛蕉幼苗株高没有显著影响,钙胁迫对宝岛蕉幼苗株高有影响,并且胁迫时间越长,影响越明显,培养第91 d 缺钙处理宝岛蕉幼苗株高比正常处理低5.76%,但尚未达到显著水平。
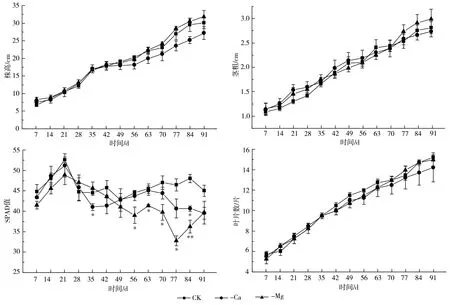
图1 钙、镁缺乏对宝岛蕉幼苗生长的影响
镁胁迫极显著降低了宝岛蕉幼苗叶片叶绿素含量,培养第21 d 叶片叶绿素含量开始呈下降趋势,第42 d 叶片叶绿素含量开始明显低于正常处理(降低了4.11%~29.56%),第70 d 宝岛蕉幼苗下部叶片出现脉间失绿症状,逐渐转为干枯,而新叶基本不受影响。钙胁迫对叶片叶绿素含量的影响在幼苗培养前期不显著,但在第70 d 后幼苗新叶沿叶片边缘出现枯斑,同时叶片叶绿素含量开始明显低于正常处理,且呈继续下降的趋势(图1)。
2.2 钙、镁缺乏对宝岛蕉幼苗光合作用的影响
宝岛蕉幼苗的株高、叶面积、叶片数及生物量的积累分配均受光合作用的影响,研究钙、镁缺乏对宝岛蕉幼苗光合作用的影响,有助于揭示养分吸收、运输及分配的作用机制。如表3 所示,与正常处理相比,缺钙、缺镁处理宝岛蕉幼苗的净光合速率分别降低了54.55%、67.68%,气孔导度分别降低了28.57%、76.19%,蒸腾速率分别降低了25.68%、79.73%。钙、镁缺乏显著降低了宝岛蕉幼苗的净光合速率,尤其是在镁胁迫的情况下,幼苗的气孔导度、蒸腾速率均显著降低,这与钙、镁元素在香蕉内重要的生理作用密不可分。钙元素作为细胞结构成分及第二信使的作用参与植物光合作用中的电子传递、光合磷酸化[12],对光合作用具有重要的影响;镁元素处于叶绿素分子结构的中心位置,直接参与叶绿素的合成,并且作为辅助因素活化磷酸化过程中的酶[13],是植物光合作用的核心。

表3 钙、镁缺乏对宝岛蕉幼苗光合作用的影响
2.3 钙、镁缺乏对宝岛蕉幼苗干物质积累和根系生长的影响
如表4 所示,缺钙处理的宝岛蕉幼苗叶、茎部干重比正常处理分别降低了8.06%、20.74%,而根部干重显著增加了64.04%。缺镁处理叶、茎部干重比正常处理分别降低了11.68%、18.05%,而根部干重增加了11.89%。另外,正常处理的根、茎、叶部含水量分别为91.95%、94.63%、86.42%,缺镁处理的根、茎部含水量分别为95.68%、95.77%,均显著高于正常处理,且叶部含水量仅为74.88%,显著低于正常处理,这与表3 所示缺镁处理宝岛蕉幼苗极低的气孔导度和蒸腾速率相符。
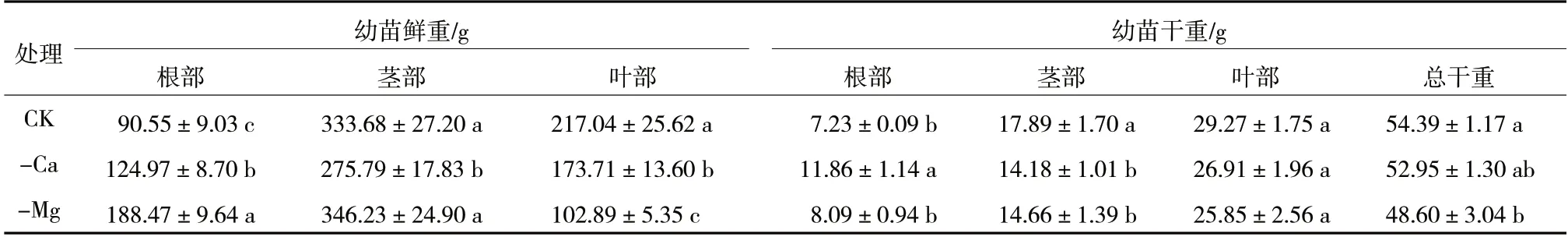
表4 钙、镁缺乏对宝岛蕉幼苗鲜重及干重的影响
如表5 所示,钙、镁胁迫对宝岛蕉幼苗各部位干物质积累量的影响一致,均抑制宝岛蕉幼苗叶部和茎部的生长、促进根部的生长,导致根冠比增加。镁胁迫对根系生长的促进作用主要表现在增加总根长,而钙胁迫对促进根部生长的影响主要表现在增加根部干物质积累量。
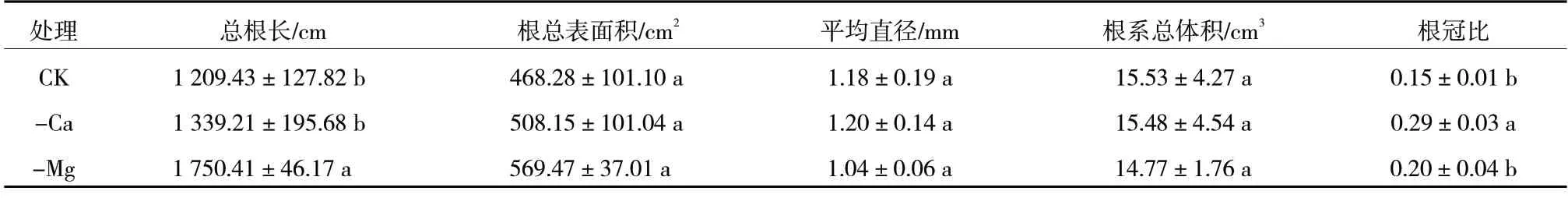
表5 钙、镁缺乏对宝岛蕉幼苗根系生长的影响
2.4 钙、镁缺乏对宝岛蕉幼苗养分吸收及分配的影响
2.4.1钙、镁缺乏对宝岛蕉幼苗养分吸收的影响
如图2 所示,与正常处理相比,缺钙处理显著降低了宝岛蕉幼苗各部位的Ca 含量,其中根部降幅最大,仅为正常处理的7.9%,茎、叶部分别降低了66.7%、62.1%;缺镁处理显著降低了各部位的Mg 含量,其中茎部降幅最大,为82.2%。钙胁迫条件下,对各部位K 含量的影响最小,茎部K 含量不降反升,与正常处理相比增加了18.5%;缺钙对宝岛蕉幼苗各部位N 含量的影响较大,根、茎、叶部N 含量分别降低了39.7%、21.1%、28.9%。缺钙还引起根部P、Mg 含量显著降低,与正常处理相比分别降低了53.6%、29.6%,但茎部P 含量增加了92.2%,叶部Mg 含量增加了52.7%。镁胁迫条件下,根部N、P、Ca 含量以及叶部N 含量均显著降低,而根、茎、叶部K 含量分别增加了54.7%、20.8%、21.5%。

图2 钙、镁缺乏对宝岛蕉幼苗各部位养分含量的影响
2.4.2钙、镁缺乏对宝岛蕉幼苗养分累积的影响
如表6 所示,与正常处理相比,缺钙处理均显著降低了N、Ca 积累量,显著增加了Mg 积累量(增加了16.81%),增加了P 积累量,但差异不显著,对K 积累量影响很小。缺镁处理均显著降低了N、P、Ca、Mg 积累量,但显著增加了K 积累量。
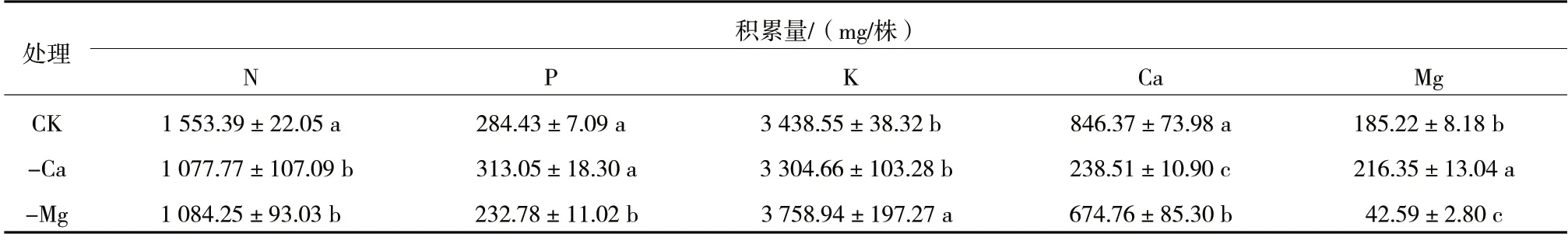
表6 钙、镁缺乏对宝岛蕉幼苗养分积累量的影响
如图3 所示,钙胁迫对宝岛蕉幼苗中N、K 积累量分配比例的影响相似,均会降低叶部的分配比例,而增加根部的比例,对茎部影响较小;另外,缺钙处理还会降低叶部P 积累量的分配比例,同时根部P 积累量的分配比例也会降低,茎部有所增加。钙胁迫还会导致叶部的Ca、Mg 积累量分配比例明显增加,同时根部的Ca 积累量、茎部的Mg 积累量分配比例会明显减少。镁胁迫时,基本不影响各部位N、P 积累量的分配比例,但Mg 积累量的分配比例发生了改变,即根部和叶部的分配比例明显增加,而茎部分配比例明显减少;此外,镁胁迫还会减少根部Ca 积累量的分配,增加茎部Ca 积累量的分配比例,与此相反,茎部K 积累量有所减少,而根部K 积累量明显增加。
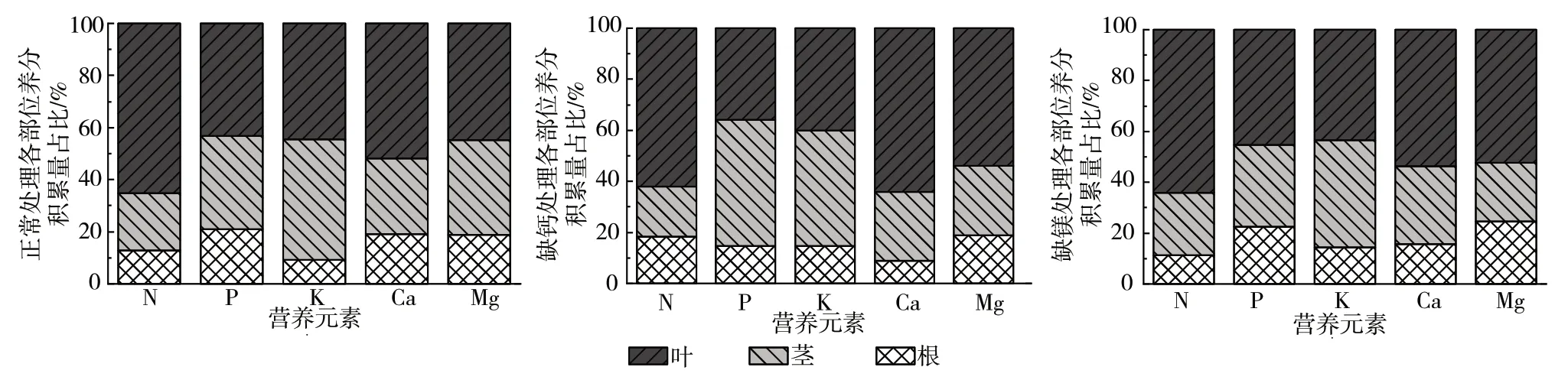
图3 钙、镁缺乏对宝岛蕉幼苗各部位养分积累量占比的影响
3 讨论
(1)叶片是对钙、镁胁迫发生响应最敏感的部位,但外观症状不同。钙胁迫先在新叶出现缺素症状,沿叶边缘出现枯斑;镁胁迫则先在下部叶片出现叶脉之间失绿黄化的症状。这是因为钙易与植物体内的有机酸形成难溶解的有机酸钙沉淀,难以移动到达生长点等需钙部位,而镁能够在植物韧皮部中移动,轻微缺镁时会表现在老叶上,随后才逐渐发展到新叶上。在试验培养过程中,钙、镁缺乏没有显著影响宝岛蕉幼苗茎粗和叶片数,这与陈海斌[6]的研究结果相同。缺镁处理对宝岛蕉幼苗株高的影响不显著,可能是因为香蕉缺镁胁迫的响应较慢,试验为期91 d 的培养不足以在株高上表现出来,陈海斌[6]研究显示,随着镁胁迫时间的延长,香蕉株高的生长也会受到抑制,表现在株高平均生长速率的显著降低。
(2)钙、镁缺乏均显著影响宝岛蕉幼苗的光合作用。通常将限制光合作用的因素分为气孔因素和非气孔因素[14-17]。缺钙处理的宝岛蕉幼苗净光合速率显著降低,而胞间CO2浓度却高于正常处理,可以得出钙胁迫时限制幼苗光合作用的主要是非气孔因素,可能是因为钙缺乏而使叶片中光合作用相关的矿质元素含量下降,导致叶片光合性能的减弱[18]。镁处于叶绿素分子结构的中心位置,是叶绿体正常结构所必需的成分,一旦缺镁,一方面叶绿素的形成受到阻碍,另一方面,也会促进叶绿素的分解而降低含量,甚至使叶片失绿,并最终失去光合作用能力[13]。本试验中,宝岛蕉幼苗在镁胁迫条件下,气孔导度和胞间CO2浓度均显著低于正常处理,并且幼苗叶片含水量也显著低于正常处理,可以得出镁胁迫对光合作用的限制来自气孔因素。同时,培养过程中测得宝岛蕉幼苗叶片SPAD 值显著降低,镁胁迫时,光合作用首先受到非气孔因素的限制,当叶片表现出明显的缺镁症状后,叶片失绿黄化并且进一步干枯,水势降低造成气孔开度减小,CO2进入叶片受阻,导致幼苗由于光合底物CO2不足而引起光合速率下降,此时光合作用不仅受到非气孔因素的限制,还同时受到气孔因素的限制。
(3)钙、镁缺乏均降低宝岛蕉幼苗全株的干物质积累,并且缺镁的影响更大,这是因为镁胁迫对幼苗光合作用的影响更大。并且钙、镁胁迫都会抑制宝岛蕉幼苗叶部和茎部的生长、促进根部的生长,导致根冠比增加,这可能是养分胁迫条件下香蕉对养分分配的主动调控,优先供给根系生长以尽可能多地汲取土壤中的营养元素,适应胁迫环境。
(4)钙、镁胁迫导致香蕉出现严重的钙、镁素亏缺,并且钙、镁胁迫时K 都会相对过剩,特别是在镁胁迫的情况下,根、茎、叶部3 个部位的K含量均显著高于正常处理。香蕉是嗜钾作物[19],在香蕉的种植过程中重施钾肥是果农的普遍做法,但李国良等[20]研究表明,在香蕉栽培过程中仅提高钾肥用量会降低产量,必须同时提高镁肥用量才能获得高产。
另外,钙胁迫显著抑制宝岛蕉幼苗对N 的吸收和积累,镁胁迫抑制除钾素外其他元素的吸收和积累,因此宝岛蕉钙、镁肥的施用要合理搭配,即施用氮、磷、钾肥的同时要注意增施钙肥和镁肥,否则会影响香蕉对氮、磷、钾肥的吸收,造成肥料浪费和经济效益下降。在香蕉出现缺素症状时,应先确定缺素对香蕉其他养分含量的影响,减少相对过剩的养分肥料施用量,增加缺乏的养分肥料施用量,以免造成新的养分失衡,这样既能保证香蕉快速恢复到健康生长状态,又能减少肥料的浪费,节约成本。
4 结论
(1)叶片是最早对钙、镁胁迫发生响应的最敏感部位。钙胁迫先在新叶出现缺素症状,沿叶边缘出现枯斑;镁胁迫则先在下部叶出现叶脉之间失绿黄化的症状。钙、镁缺乏均没有显著影响幼苗的茎粗和叶片数,但显著降低叶片叶绿素含量。缺钙会抑制幼苗株高的生长。
(2)钙、镁缺乏均显著降低宝岛蕉幼苗的光合作用强度,钙胁迫下光合作用的限制因素是非气孔因素,而镁胁迫下光合作用同时受到气孔因素和非气孔因素的限制。
(3)钙、镁缺乏均抑制宝岛蕉幼苗全株的干物质积累量,缺镁的影响更大;钙、镁胁迫还会改变香蕉幼苗养分分配,缺钙抑制N、P、K 向叶部运输,缺镁抑制K、Mg 在茎部的积累,最终抑制宝岛蕉幼苗叶部和茎部的生长、促进根部的生长,导致根冠比增加。
(4)钙、镁缺乏均不利于香蕉幼苗对其他养分的吸收,在实际栽培过程中,除了要合理施用氮、磷、钾肥外,还需要混合使用钙、镁肥才能获得更高的产量。
——缺镁对柑橘光合作用及相关生理生化的影响

