N3系脂肪酸干预对炎症性肠病病人复发风险的影响
李研研,关平,杨欣,梁瑶,邢一丹
作者单位:沧州市人民医院营养科,河北 沧州 061000
炎症性肠病已成为全球性疾病,如果不进行最佳干预,可导致严重并发症和残疾[1]。饮食习惯的改变导致n-6/n-3 多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)的比例失衡。尤其在西方饮食结构中,这些不断变化的饮食习惯与近年来全球炎症性肠病发病率的增加相吻合[2-3]。长链膳食n-3PU⁃FA 是n-3 鱼油的主要成分,为N3 系脂肪酸,已被证明在哮喘[4]、类风湿性关节炎[5]等炎症疾病中具有抗炎特性。最新的流行数据表明[6],n-3PUFA 在炎症性肠病具有潜在的有益效果,特别是在溃疡性结肠炎中,大量摄入n-3PUFA 可能会降低溃疡性结肠炎的发病率;一项动物实验显示[7],饮食中的n-3PU⁃FA 可以通过调节过氧化物酶增殖物激活受体-γ(Peroxidase proliferator-activated receptor-gamma,PPAR-γ)/ T 细胞核转录因子(T cell nuclear tran⁃scription factor,NFAT)信号转导途径的表达和活性减弱三硝基苯磺酸诱导大鼠实验克罗恩病,这些结果为克罗恩病在内的炎症性肠病的治疗和预防复发提供潜在的依据。为此,笔者团队对炎症性肠病病人采用N3系脂肪酸干预,并分析其对复发风险的影响,旨在为炎性肠病的复发提供理论依据,报告如下。
1 资料与方法
1.1 一般资料
1.1.1 样本量估算本研究为随机对照试验,对照组为予以常规饮食干预;干预组为在对照组基础上予以N3 系脂肪酸干预。以炎症性肠病复发为主要观察的结局指标,根据既往文献报道,估计对照组复发比例为40%,干预组为25%。设置α=0.05(双侧),把握度=0.90。利用PASS 11 软件计算总样本量为194 例,考虑10%的脱失率,计算公式为N/(1-脱落率),即共需216 例,每组需要108 例。最终对照组纳入研究对象108例,干预组纳入108例。
1.1.2 临床基线资料纳入标准:①符合炎性肠病的诊断标准[8],以持续或反复发作的黏液和或血便、腹痛、里急后重等为主要表现处于活动期;②既往无肠道手术史;③凝血功能正常。排除标准:①入组前接受相关治疗;②合并出血性疾病、胃肠道恶性肿瘤;③严重进食障碍;④慢性肠道感染。前瞻性选取2018 年1 月至2020 年5 月沧州市人民医院收治的216 例炎性肠病病人为研究对象,病人或其近亲属对研究方案签署知情同意书。本研究符合《世界医学协会赫尔辛基宣言》相关要求。采用分层区组随机化方法,选取合适段长。借助 SAS 统计软件,产生216例受试者所接受处理(干预组和对照组)的随机安排,即列出流水号L001~L216所对应的治疗分配(即随机编码表),按照1∶1 比例随机分配干预组和对照组,每组108 例。两组一般资料对比差异无统计学意义(P>0.05),见表1。
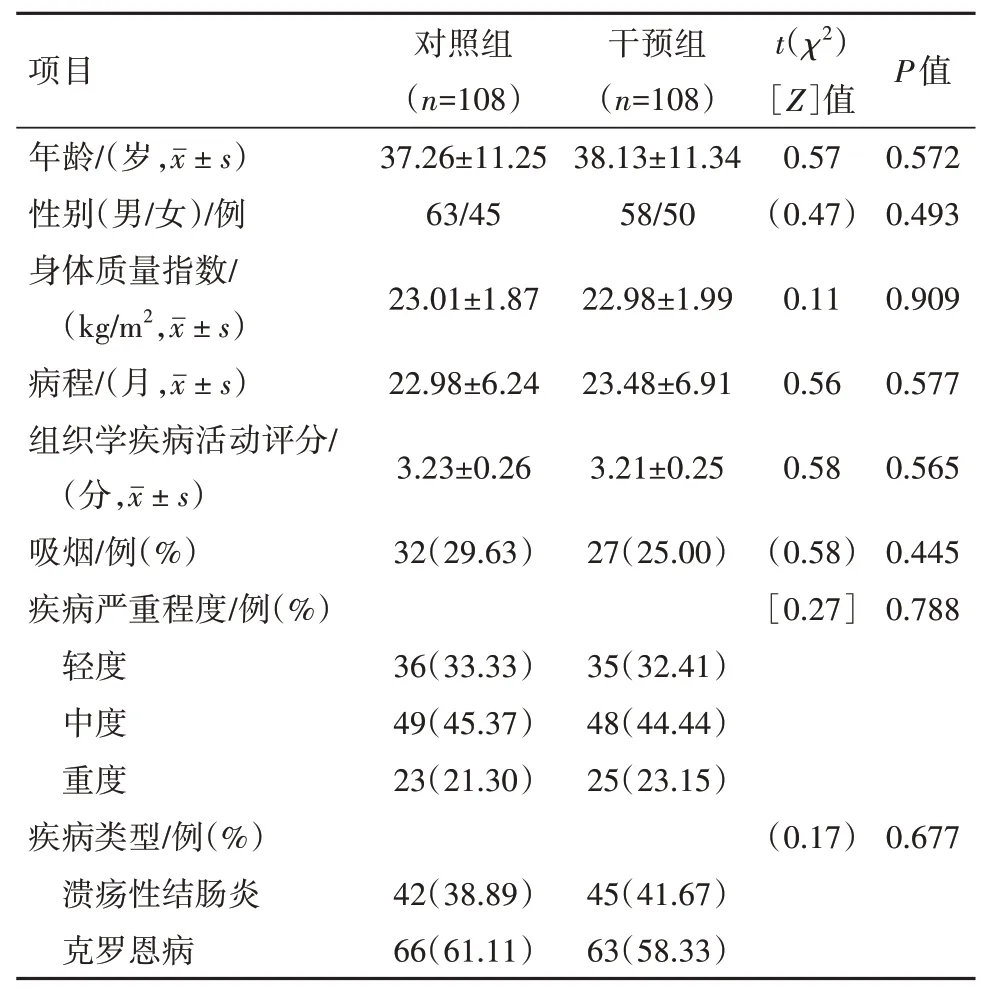
表1 炎性肠病216例一般资料比较
1.2 方法
1.2.1 一般资料收集收集病人一般资料(性别、年龄、空腹血糖、体质量指数、病程、组织学疾病活动评分、疾病严重程度、病变部位和肠外表现、吸烟等)。
1.2.2 实验室资料收集抽取空腹静脉血4 mL,EDlA 抗凝,3 000 r/min,离心10 min,于−70 ℃冰箱保存,采用AU5800 型全自动生化仪(美国R&D 公司)以酶联免疫法检测C-反应蛋白(C-reactive pro⁃tein,CRP)、白细胞介素(interleukin,IL)-17、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α);采用BC6800 全自动血球分析仪检测血小板(blood plate⁃let,PLT);采用血沉分析仪(ESR-2020 型)测量红细胞沉降率(erythrocyte sedimentation rate,ESR);采用TSQ Vantage 三重四极杆质谱仪(QqQ-MS/MS)测量氧化三甲胺(trimethylamine N-oxide,TMAO);采集粪便标本,采用定量酶联免疫吸附测定法测定粪便钙卫蛋白;采用邻联甲苯胺法进行大便隐血试验,记录粪便隐血试验(fecal occult blood test,FOBT)(+)例数,以上步骤均需严格按照说明书进行。
1.2.3 治疗方案两组予以疾病健康知识宣教,并行常规内科治疗至有效缓解(临床症状消失,肠镜提示黏膜大致正常或改良Mayo 评分≤2 分)。期间予以饮食干预。
对照组予以常规饮食干预:①指导合理饮食,饮食宜清淡易消化,进食流质或半流质食物,避免忌食牛奶、乳制品、咖啡、巧克力等易引起肠道炎症反应的食物;②饮食有节律,宜少量多餐;③严格注意饮食卫生。
干预组在对照组基础上予以N3系脂肪酸干预:静脉滴注ω-3 鱼油脂肪乳注射液(费森尤斯卡比华瑞制药,批号16PK9392、16PK9417、16NC3643) 治疗,每天1次,每次100 mL,连续1周。
1.3 随访两组均干预12 个月,每月通过电话或微信随访,记录病人复发情况(主要终点指标)、相关实验室指标(次要终点指标),随访截止时间为2021年6月1日。
1.4 复发评价标准复发标准[9]:经综合治疗进入缓解期后再次出现腹痛、便血等症状且改良Mayo评分≥3分,内镜显示肠黏膜血管纹理模糊、紊乱,黏膜充血水肿等。
1.5 统计学方法使用SPSS 22.0 软件分析,计数资料采用例(%)表示,采用χ2检验;等级资料采用Wilcoxon秩和检验;计量资料以表示,采用独立样本t检验;应用Kaplan-Meier 法绘制复发曲线,logrank 检验比较组间差异;采用逐步纳入的Cox 回归分析炎性肠病病人复发风险的影响因素;设检验水准为0.05,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料对比随访12 个月,中位随访时间7个月(2~12 个月),无1 例失访,共75 例病人出现复发,复发率34.72%。复发组和非复发组性别、年龄、空腹血糖、体质量指数、病程、组织学疾病活动评分、疾病严重程度、病变部位和肠外表现比例对比差异无统计学意义(P>0.05),吸烟、N3 系脂肪酸干预比例对比差异有统计学意义(P<0.05)。见表2。
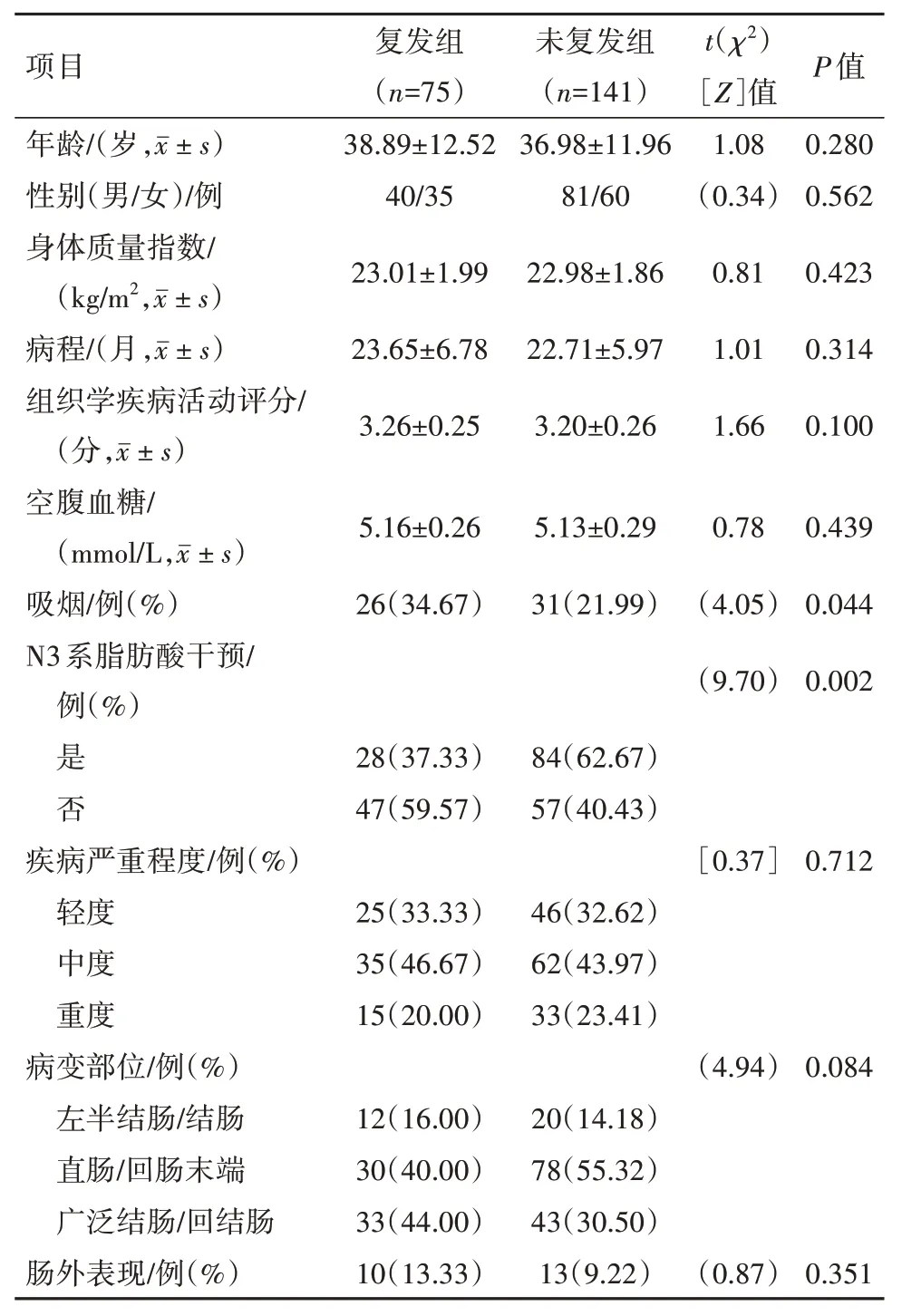
表2 炎性肠病216例复发组和未复发组一般资料对比
2.2 实验室指标对比复发组和非复发组PLT、IL-17、IL-6、FOBT(+)对比差异无统计学意义(P>0.05),CRP、ESR、TNF-α、TMAO、粪便钙卫蛋白对比差异有统计学意义(P<0.05),见表3。
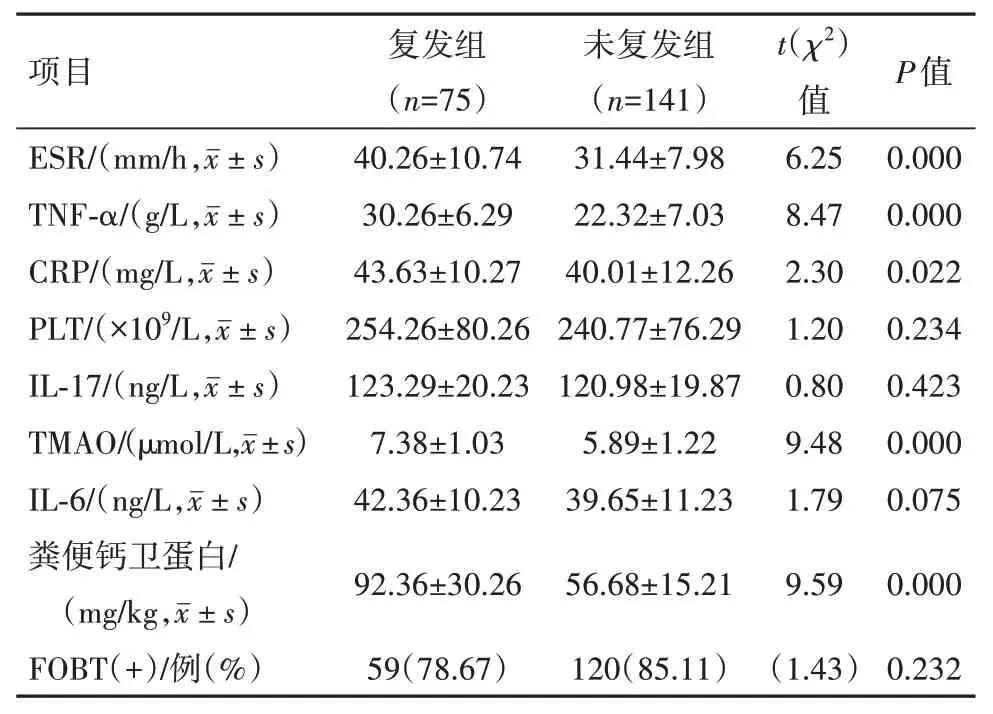
表3 炎性肠病216例复发组和非复发组实验室指标对比
2.3 两组随访期间复发率对比干预组30 例复发,复发率(27.78%)较对照组45 例复发,复发率(41.67%)低(log-rankχ2=6.91,P=0.009)。
2.4 炎性肠病病人复发风险相关因素 Cox 回归分析将复发情况作为因变量(1=复发,0=未复发),Cox 回归分析显示:ESR[HR=1.03,95%CI:(1.01,1.05)]、TNF-α[HR=1.05,95%CI:(1.03,1.07)]、粪便钙卫蛋白[HR=1.03,95%CI:(1.02,1.03)]、TMAO[HR=1.38,95%CI:(1.12,1.71)]为炎性肠病复发危险因素(均P<0.05),N3 系脂肪酸干预[HR=0.56,95%CI:(0.35,0.90)]为炎性肠病复发的保护因素(均P<0.05)。见表4,5。

表4 Cox回归分析量化赋值表
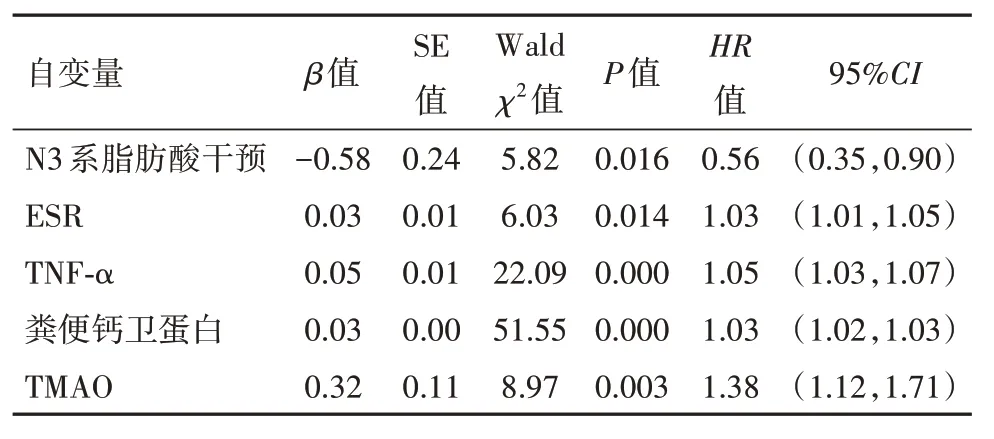
表5 炎性肠病复发风险Cox 回归分析
3 讨论
炎症性肠炎遵循反复发作的临床过程,缓解期与活跃炎症期交替出现。一般来说,即使经治疗缓解后,仍有部分病人会复发[10]。尽管过去10年在揭示克罗恩病和溃疡性结肠炎的遗传风险方面取得了进展,但炎症性肠病复发机制不能仅用遗传易感性来解释。事实上,刺激炎症反应的环境如饮食结构、生活环境等触发因素也是炎症性肠病复发的重要原因。本研究对216 例炎症性肠炎病人随访12个月发现,75 例(34.72%)复发,与Hercun 等[11]学者的33.0%、Anyane-Yeboa 等[12]学者36.0%研究相符,提示维持临床缓解状态是预防炎症性肠病复发的关键目标。长期以来,饮食模式和成分一直被认为是促进慢性腹泻和炎症性肠炎发生发展的重要因素,“西化”带来的饮食结构变化成为重点关注的对象,包括膳食纤维的减少和动物蛋白质和脂肪消耗的增加,特别是饱和脂肪和n-3PUFA,故了解N3 系脂肪酸对炎症性肠病病人复发风险的影响,或许可为炎症性肠病复发干预提供理论依据。
膳食脂肪酸在炎症性肠病发病机制中的作用得到其作为许多促炎和抗炎截止的前体作用的合理性的支持[13]。流行病学趋势表明炎症性肠病发病率及复发率的增加,与n-6 PUFA 摄入量的增加和n-3 PUFA 摄入量的减少有关[14]。在几项观察性研究中调查了膳食脂肪酸摄入和炎症性肠病风险之间的关系,一项荟萃分析显示[15]证明了富含长链n-3 PUFA 和摄入n-3/n-6 PUFA 的饮食与溃疡性结肠炎的风险呈负相关;同样,在已确定的克罗恩病中补充n-3 PUFA 的随机对照试验能证明在维持缓解方面优于安慰剂[16];Ananthakrishnan 等[17]的研究中显示高摄入n3:n6 PUFA(高于中位数)表明了溃疡性结肠炎风险降低的趋势[HR=0.71,95%CI:(0.47,1.09),P=0.11];Ajabnoor 等[18]研究中显示,增加n-3 PUFA 可降低炎症性肠病复发[RR=0.85,95%CI:(0.72,1.01)]和IBD 恶化[RR=0.85,95%CI:(0.71,1.03)]的风险。本研究显示,N3 系脂肪酸干预后复发率显著低于对照组,且经Cox 回归分析显示N3 系脂肪酸干预[HR=0.56,95%CI:(0.35,0.90)]为炎性肠病复发风险的保护因素。其可能与n-3 PUFA 通过产生分解素和脂氧素发挥抗炎作用,还可通过受体介导的机制和翻译后修饰下调炎症,进而降低炎性肠病复发风险有关。这也提示针对炎症性肠病病人除基础治疗外,还应予以合理的饮食管理,特别注意n-3 PUFA的补充。
炎症反应在炎症性肠病病人复发中占据重要地位[19]。CRP、TNF-α、ESR 是参与炎症性肠病发生发展的重要因子,TMAO 可引发NLRP3 炎症小体和核因子-κB 参与炎症反应也成为预测炎症性肠病复发风险的关键指标。Song 等[20]研究显示,抗TNF-α药物治疗的克罗恩病启动时的CRP 水平可能是复发的预测指标[OR=4.34,95%CI:(1.06,17.83)];Alper 等[21]研究显示,ESR 与小儿炎症性肠病相关;Ma 等[22]研究显示,TMAO 水平的增加与溃疡性结肠炎病人活动的增加相关。本研究中,TNF-α、ESR、TMAO 为炎性肠病复发风险的危险因素,也说明炎症因子在炎症性肠病复发中的重要性。但CRP 未进入Cox 回归分析中,可能与CRP 在机体受到感染或组织损伤均存在一定程度的表达,导致其在炎症性肠病病人疾病进展中不具有特异性。同时,两组吸烟比例对比差异有统计学意义,但吸烟未纳入Cox 回归方程中,可能与入组后予以健康知识宣教,让病人了解吸烟的危害,并鼓励病人戒烟有关。
粪便钙卫蛋白因容易在粪便样本中确定,并在克罗恩病和溃疡性结肠炎中显示出与内镜炎症相当好的相关性[23]。不仅如此,钙卫蛋白水平升高也可以用组织学评估中检测到的低度炎症来解释。早期研究表明,钙卫蛋白水平升高可以预测临床缓解病人随访期间的复发,总灵敏度为78%,特异度为73%[24];Cerrillo 等[25]研究中显示,相较于维持缓解的病人而言,复发病人基线时的粪便钙卫蛋白中值水平显著升高(284 mg/kg 比37 mg/kg;P<0.01)。本研究发现,粪便钙卫蛋白水平与炎症性肠病病人复发风险相关,这可能与粪便钙卫蛋白是源于肠道炎性标志物,能与钙离子结合且在粪便中极稳定有关。
综上所述,N3系脂肪酸干预有助于降低炎症性肠病病人复发风险。本研究也存在一定的局限性,首先炎症性肠病包括溃疡性结肠炎和克罗恩病,而本研究进行分组研究;其次样本量相对较少仅对处于活动期病人进行观察,N3系脂肪酸干预是否对处于缓解期的病人同样有效仍需后期扩大样本量,进一步探讨。

