双牌泡果荠的组培快繁技术研究※
●胡如芳 吴雪松 杨 亮
(吉安市林业科学研究所 江西 吉安 343011)
双牌泡果荠(Hilliella shuangpaiensis)为十字花科泡果荠属的一种药食同源植物,俗称砍菜,为一种辛辣的风味小吃。1986年张渝华记录并建立十字花科一新属—泡果荠属,1988年李振宇等[1]发现泡果荠属一新种并命名为“双牌泡果荠”,主要特征为基生羽状复叶具小叶3~9片,根茎肉质,其与山葵、芥末口感较为接近。研究发现双牌泡果荠有13种辛辣成分,其中含大量NO.1-烯丙烷、NO.33-丁烯、NO.44-戊烷等异硫氰酸酯类物质,其独特的辛辣风味即来源于异硫氰酸酯类化合物。研究表明异硫氰酸酯类化合物的主要功能有增进食欲、促进维生素B1的合成、抗氧化、抗菌、抗寄生虫、抑制肿瘤细胞生长[2-3]。
双牌泡果荠在民间深受群众喜爱,长期采集其野生植株根茎食用,但几乎无人工种植,导致野生种源逐年减少,其原因在于双牌泡果荠虽有结实,但种子发育不全,发芽率低,自然环境下繁殖困难。本试验以双牌泡果荠茎段为材料,研究不同培养基、生长激素等对外植体增殖、生根的影响,为双牌泡果荠无性快繁提供理论依据。
1 材料和方法
1.1 材料的选择
于2019年在吉安市遂川县营盘圩乡筛选双牌泡果荠优良母株,引种移植在吉安市林科所实验基地内。
1.2 方法
1.2.1 外植体采集分别在4月、6月、8月,天气连续晴好3 d以上,在晴天的上午09∶00~10∶00采集双牌泡果荠茎段,将采集的双牌泡果荠茎段去除叶片,剪成1 cm长的段,用流动自来水冲洗2 h并小心剥去苞叶,处理干净后置于超净工作台备用。
1.2.2 外植体消毒将双牌泡果荠茎段先用75%酒精振荡清洗30 s,用无菌水冲洗3次,再将茎段分为3组,用0.1%升汞分别灭菌4,6,8 min,再用无菌水冲洗3次,将茎段放在无菌滤纸上吸干表面水分,统一接种在MS+1.2 mg/L 6-BA+0.1 mg/L IBA培养基上,每个处理30瓶,每瓶1个茎段,3次重复,接种5~7 d后,统计污染率、褐化率和萌芽率。
1.2.3 初代培养外植体灭菌接种5~7 d后,筛选出无污染、无褐化的材料,在超净工作台内将其接种于以MS为基本培养基,分别添加浓度为6-BA 1~3 mg/L 和NAA 0.2,0.4 mg/L的5种不同激素配比的初代培养基中。每个处理5瓶,每瓶接种6个,3次重复。接种后第5天开始观察愈伤组织诱导和丛生芽萌发情况。
1.2.4 继代培养将培养好的丛生芽在无菌条件下剪成至少带1芽的1 cm小段,转接于以MS为基本培养基,分别添加了浓度为6-BA 0.5~1.5 mg/L 和NAA 0.2~0.6 mg/L的9种不同激素配比的继代增殖培养基中。每处理5瓶,每瓶接种6个,3次重复,每天观察生长情况,30 d后在无菌条件下调查增殖系数。
1.2.5 生根培养在培养好的增殖丛生芽中选取高度3 cm以上、叶片3片以上的粗壮单芽,从芽团上切下,分别转接于以1/2 MS为基本培养基,分别添加了浓度为IAA 0~0.2 mg/L 和IBA 0.1~0.2 mg/L的5种不同激素配比的生根培养基中。每个处理5瓶,每瓶接种6个,3次重复,每天观察生长情况,30 d后打开培养瓶在室内放置2 d,取出试管苗,用水洗掉培养基,调查主根数和生根率。
1.2.6 移栽生根培养25 d左右,将高度4~7 cm,叶片4片以上,已生根良好的组培苗移至透光率20%~35%,温度25~30℃的大棚内炼苗7~10 d,将生根苗移至瓶外,清洗干净生根苗根部的培养基,移栽前用0.5%多菌灵溶液消毒10~15 min,移栽至基质装入穴盘内,移栽后仍然保持空气湿度大于90%,基质保持湿润,移栽30 d后统计成活率。
1.2.7 培养环境
所有培养基均含蔗糖3%,琼脂0.8%,pH值5.8~6.0。培养温度25~28℃,日照时间12 h,光照强度2000 lx。
2 结果与分析
2.1 采集时间对外植体组培情况的影响
由图1可知,随着采集时间的推后,外植体污染率和褐化率均显著升高,萌芽率显著降低,4月采集的外植体污染率、褐化率最低,分别为18.5%,10.3%,显著低于6月和8月;萌芽率最高,为53.1%,显著高于6月和8月,因此,4月是采集双牌泡果荠茎段进行组织培养的最佳时间。

图1 不同采集时间外植体组培情况
2.2 消毒时间对外植体组培情况的影响
由图2可知,随着消毒时间的增加,双牌泡果荠组织培养污染率逐渐降低。用0.1%升汞消毒4 min时,双牌泡果荠外植体污染率达53.16%,显著高于其他处理,且萌芽率最低;消毒8 min外植体污染率最低,萌发率次低;消毒时间6 min时污染率为22.36%,萌发率为56.72%,萌发率最高。因此,双牌泡果荠组织培养外植体消毒6 min为最佳时间。

图2 不同消毒时间外植体组植体组培情况
2.3 初代培养
由表1~3可知,不同处理对外植体初代培养的影响差异极显著,不同浓度的6-BA与NAA组合均可诱导双牌泡果荠的丛生芽萌发,其中6-BA浓度为3.0 mg/L、NAA浓度为0.4 mg/L的组合萌发率为91.13%,优于其他组合,该组合的株高也达到4.2 cm。因此,初代培养较合理的培养基组合为MS+6-BA 3.0 mg/L+NAA 0.4 mg/L。

表1 不同处理外植体初代培养情况

表2 不同处理对外植体初代培养的影响方差分析

表3 不同处理对外植体继代培养的影响显著性差异检验表
2.4 继代培养
由表4~6可知,不同处理对外植本继代培养的影响差异极显著,不同浓度的6-BA和NAA均能诱导萌发丛生芽。当6-BA浓度为1.5 mg/L、NAA浓度为0.4 mg/L时组培苗平均增殖系数达到3.76,优于其他处理,当6-BA浓度为1.5 mg/L、NAA浓度为0.4 mg/L及6-BA浓度为0.5 mg/L、NAA浓度为0.6 mg/L时,增殖苗平均株高分别为4.07 cm和4.21 cm,优于其他处理,因此,双牌泡果荠最佳增殖培养基是MS+6-BA 1.5 mg/L+NAA 0.4 mg/L。

表4 不同处理外植体继代培养情况

表5 不同处理对外植体继代培养的影响方差分析

表6 不同处理对外植体继代培养的影响显著性差异检验表
2.5 生根培养
由表7~9可知,不同浓度的IBA与IAA组合均能促使组培苗生根,其中IBA浓度为0.2 mg/L、IAA浓度为0.1 mg/L时生根率为91.13%,主根数为3.92,毛细根生长情况好,为5个组合中的最优,因此,生根培养最佳培养基为1/2 MS+IBA 0.2 mg/L+IAA 0.1 mg/L。
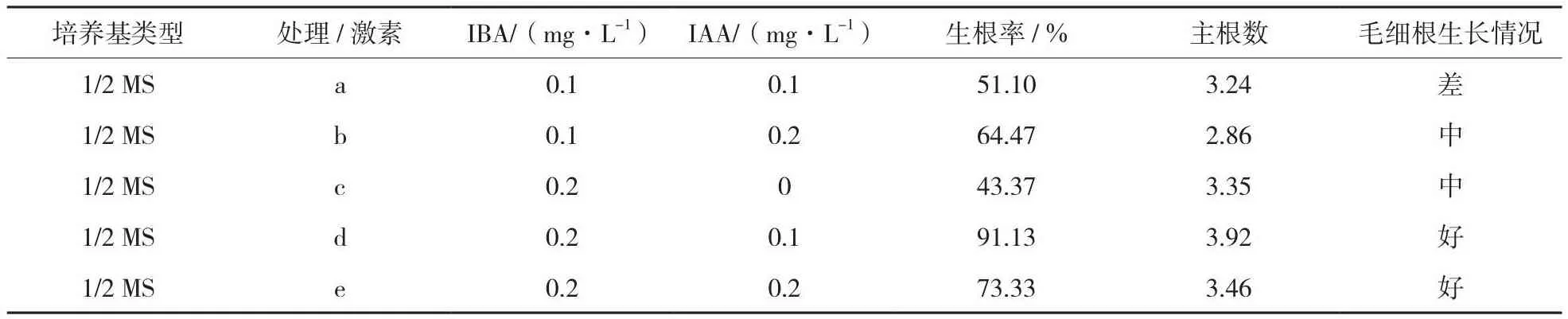
表7 不同处理组培苗生根情况

表8 不同处理组培苗生根率方差分析

表9 不同处理对组培苗生根率的影响显著性差异检验表
2.6 试验苗移栽
生根培养25 d左右移栽,移栽30 d后成活率可达90%以上,苗高15 cm时移入栽培基地定植。
3 讨论与结论
以双牌泡果荠茎段为外植体,研究不同采集时间、消毒时间及植物激素种类及浓度对外植体初代培养、继代培养、生根培养的影响,结果表明,不同采集时间及消毒时间对外植体组织培养情况影响较大,其中4月采集的外植体表现最好,原因可能为幼化程度高,生长期短,受病菌或病毒感染少;消毒时间对污染率和萌发率存在影响,原因可能为消毒时间短,病菌、病毒消灭不彻底,消毒时间过长又对外植体造成损伤,6 min是最佳消毒时长。培养基的配比也对双牌泡果荠影响较大,试验表明双牌泡果荠最佳诱导培养基为MS+6-BA 3.0 mg/L+NAA 0.4 mg/L,最佳增殖培养基为MS+6-BA1.5 mg/L+NAA 0.4 mg/L,最佳生根培养基为1/2 MS+IBA 0.2 mg/L+IAA 0.1 mg/L。综上,植物的外植体诱导、增殖培养、生根培养都与激素的种类与浓度有关。外植体的来源不同,内源激素水平也不同,而且培养基中所含的激素浓度也不同,造成来源不同的外植体分化能力等也存在差异[4]。

