iTRAQ技术在颅内动脉瘤病人血浆差异表达蛋白检测中的应用
王晨辰 韩雨薇 李晓明
颅内动脉瘤破裂是导致蛛网膜下腔出血(subarachnoid hemorrhage,SAH)的主要原因,致残率、病死率高[1,2]。随着医学技术的进步,颅内未破裂动脉瘤的检出率明显增高。目前,颅内未破裂动脉瘤的治疗尚无统一意见,需要权衡动脉瘤破裂的风险和外科治疗的风险之间利弊。动脉瘤的发展变化会引发一系列的分子事件,导致一些具有潜在的生物标志物特征的物质释放到外周血。如果能够在外周血找到与动脉瘤破裂相关的预警生物标记物,则有助于动脉瘤临床治疗方案的选择。我们采用同位素标记相对和绝对定量(isobaric tag for relative and absolute quantitation,iTRAQ)技术检测颅内未破裂动脉瘤和颅内破裂动脉瘤病人血浆蛋白的差异表达谱,并采用生物信息学方法分析,为寻找出血浆潜在的生物标志物提供依据。
1 材料与方法
1.1 血浆来源收集2019年1~12月收治的10例颅内破裂动脉瘤病人血浆10份,同时收集年龄、性别、吸烟史、饮酒史、高血压以及动脉瘤位置等相匹配的10例颅内未破裂动脉瘤血浆10 份作为对照组。两组病人基线资料见表1。本研究经我院伦理委员会批准,所有入组病人均知情并签署同意书。
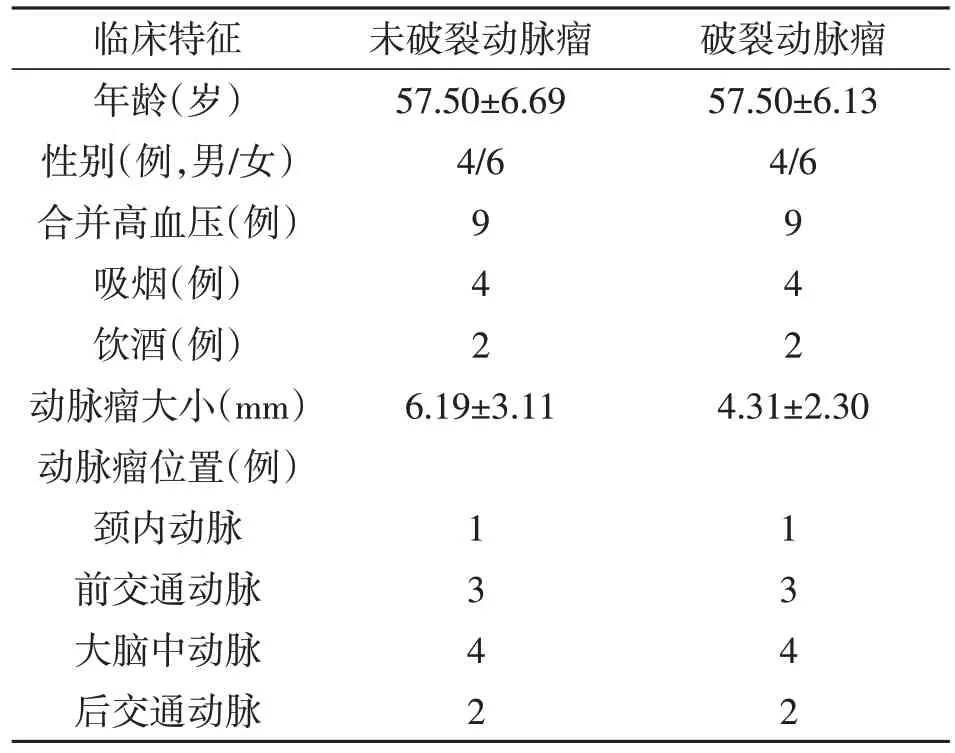
表1 两组病人的基线资料
1.2 病例选择标准纳入标准:DSA或CTA证实存在颅内动脉瘤。排除标准:海绵状血管瘤;非颅内动脉瘤因素(血管畸形等)造成的蛛网膜下腔出血;夹层动脉瘤;恶性肿瘤、自身免疫性疾病等;外院已行手术、介入治疗。
1.3 样本的采集与保存入院2 h内采集静脉,4 ℃条件下3 000 转/min 离心15 min,收集上层血浆分装后-80 ℃保存备用,避免反复冻融。
1.4 标记前样品准备使用ProteoMinerTM 蛋白富集试剂盒(美国Bio-Rad 公司)去除血浆样本中高丰度蛋白,胰蛋白酶消化后得到肽段,并采用C18 Cartridges进行脱盐,肽段真空离心干燥后以40 μl 0.1%甲酸溶液复溶。
1.5 iTRAQ标记和LC-MS/MS分析利用iTRAQ试剂盒(美国AB SCIEX 公司)标记肽。使用AKTA 纯化系统(美国GE Healthcare公司)通过SCX色谱分离标记肽。干燥的肽混合物用缓冲液A(10 mM KH2PO4,25% ACN,pH=3.0)重组和酸化,在PolySULFOETHYL 4.6×100 mM 柱上(5 μm,200 Å;美国polyylc Inc公司)上进行分级。洗脱过程中监测214 nm吸光度值,每隔1 min 收集洗脱组分。真空离心冻干后用C18 Cartridge脱盐。每份样品采用Easy nLC(上海赛默飞世尔科技公司)进行分离,在用Q Exactive 质谱仪(上海赛默飞世尔科技公司)进行分析。
1.6 蛋白鉴定和定量使用MASCOT引擎(Matrix Science,London,UK;版本2.2)嵌入到Proteome Discoverer 1.4 软件中对蛋白进行鉴定和定量。以表达倍数(fold change,FC)变化>1.2倍(上调>1.2倍或下调<0.83 倍)且P<0.05 的筛选标准,得到差异表达蛋白(differentially expressed proteins,DEPs)。
1.7 生物信息学分析利用GO数据库(http://www.geneontology.org/)对DEPs 的反应通路进行注释和分类,使用OmicShare 工具(https://www.omicshare.com/tools)进行KEGG路径富集分析和GO分析。
从GEO 数据库(http://www.ncbi.nlm.nih.gov/)下载动脉瘤破裂的基因芯片数据GSE13353 和GSE54083,在GEO2R 平台内对两组数据进行差异基因分析,选取log2 FC>1或<-1、P<0.05的基因为差异表达基因。将GSE13353和GSE54083的差异表达基因以及本研究血浆样本DEPs联合做韦恩图分析。
1.8 蛋白互作网络的构建将筛选出的DEPs 导入STRING 在线数据库(http://string-db.org/)进行聚类分析,引用Cytoscape软件version 3.8.2绘制蛋白质互作网络图,找出网络核心关键蛋白。
2 结果
2.1 GO分析及KEGG 通路富集分析 经蛋白质组学分析鉴定出806个可定量蛋白,其中DEPs共122个,表达上调59个,表达下调63个。
DEPs 进行BLAST2GO 注释,按照生物过程、细胞成分和分子功能类别进行分类:在生物学过程中,大多数DEPs主要参与“细胞过程”、“生物调节过程”和“代谢过程”等;DEPs的分子功能主要在“结合”功能中集中;而在细胞成分中“细胞”和“细胞组分”具有数量最多的DEPs。
KEGG 通路富集分析结果表明,主要相关疾病为传染性疾病和免疫疾病,也包括心血管疾病;主要富集的通路均与炎症免疫反应相关,主要相关通路包括B细胞受体信号通路、T细胞受体信号通路等与免疫及炎症级联反应显著相关的通路,以及MAPK信号通路、PI3K-Akt 信号通路等与在细胞凋亡中发挥重要作用的通路。
2.2 蛋白相互作用网络DEPs相互作用网络分析显示,白蛋白(albumin,ALB)、血红蛋白β亚基(hemoglobin subunit beta,HBB)、钙调蛋白1(calmodulin-1,CALM1)、转铁蛋白(serotransferrin,TF)和载脂蛋白A1(apolipoprotein A1,APOA1)是网络核心蛋白。
2.3 与GEO数据集交叉结果GSE13353数据集与本研究的共同差异蛋白有14个,GSE54083数据集与本研究的共同差异蛋白有3 个;其中2 个蛋白在GSE13353、GSE54083 数据集和本研究样本中均存在交叉。
2.4 共同DEPs的情况 本研究样本SLMAP、IQGAP3、PTPRJ、PEBP1、S100P、BASP1和AOC3等表达水平与GSE13353 数据集的动脉瘤组织基因表达水平呈现相同变化趋势,而且破裂动脉瘤与未破裂动脉瘤之间具有统计学差异(P<0.05;图1)。

图1 iTRAQ 技术检测颅内动脉瘤病人血浆差异表达蛋白与GEO数据库颅内动脉瘤组织基因表达交叉分析
3 讨论
生物标志物有助于了解颅内动脉瘤生长与破裂的分子机制,从而开发新的治疗方法,并预测临床结果。既往研究都是在基因组学[3]和转录组学[4]水平进行分析,但蛋白的翻译和修饰也会影响其表达和功能,因此蛋白质组水平的研究能直接反映颅内动脉瘤破裂的病理变化。颅内动脉瘤壁的病理改变会导致一些具有潜在的生物标志物特征的物质释放到外周血。血液作为疾病微环境在疾病大环境中的反馈,是最容易获取并且方便检测变化的,也是更具有无创诊疗应用价值的。如果在外周血中能寻找到辅助预警颅内动脉瘤破裂的生物标志物,则能够有助于对颅内未破裂动脉瘤治疗方案的选择提供个体化诊疗的参考依据。
我们的研究以病人血浆为颅内动脉瘤潜在生物标记物的来源,采用iTRAQ 技术与LC-MS/MS 联合的蛋白质组学分析方法,识别和量化蛋白,分析颅内破裂动脉瘤与颅内未破裂动脉瘤的DEPs。首先,通过GO 富集分析和KEGG 通路富集分析关键蛋白与关键功能,同时运用GEO 数据库的基因芯片信息,验证得到的DEPs的动脉瘤组织基因表达水平;再通过iTRAQ 蛋白质组学分析与生物信息学交叉联合,试图寻找潜在的生物标志物。我们确定DEPs共122个,上调59个,下调63个;功能富集分析发现,DEPs参与血管生成与血管通透性调节、血管损伤以及损伤后的血小板脱粒、脂质的代谢等与动脉瘤形成发展密切相关的反应。颅内动脉瘤的特征是血流动力学引发的血管内皮功能障碍,使平滑肌细胞转化为促炎表型,血管壁局灶性恶化,粘液物质在内膜和中层沉积,内弹力板断裂导致动脉壁弹力变弱[5]。动脉壁细胞丢失、泡沫化最终导致动脉瘤破裂[6]。研究证实切应力诱导一氧化氮的产生、平滑肌细胞的表型改变和凋亡、炎症和遗传等因素,都参与动脉瘤的形成和破裂[6]。
本文结果显示APOA1 是蛋白质互作网络的核心蛋白。APOA1 是高密度脂蛋白的主要载脂蛋白,能够诱导清除血管壁细胞内积聚的脂质,从而启动反向胆固醇运输途径。有免疫组化染色研究表明,APOA1 与动脉瘤破裂的临床危险因素呈负相关,这可能和APOA1通过抗动脉粥样硬化、抗炎和抗氧化功能在动脉瘤壁变性中发挥保护作用有关[7]。我们发现颅内未破裂动脉瘤病人血浆APOA1 表达与颅内破裂动脉瘤病人相比显著上升。
ALB 是一种急性相反应物,可以预防或恢复由溶血性磷脂酰胆碱诱导的内皮细胞凋亡等血管功能障碍,同时可以结合游离脂肪酸,阻断病理性脂质过氧化反应[8]。因此,颅内未破裂动脉瘤病人血浆ALB升高可能对动脉瘤具有保护作用。巨噬细胞中铁蛋白的增加对细胞铁代谢起作用,也对炎症反应起作用[9]。而铁缺乏在的炎症性疾病中很常见,是影响发病率和病死率的独立危险因素,其中铁缺乏即可由TF 的饱和度来定义[10]。我们推断TF 在颅内破裂动脉瘤病人血浆中表达下调可能与炎症相关。PTPRJ蛋白在血管生成中显示出重要作用,其过表达会使细胞间黏附分子和血管细胞间黏附分子的mRNA水平显著升高,表明PTPRJ 基因在内皮细胞中具有促炎、促凋亡作用[11]。我们发现PTPRJ 在颅内破裂动脉瘤病人血浆中表达升高。此外,有研究发现基质金属蛋白酶-9 在颅内破裂动脉瘤组织和病人血清中表达升高,ORM1 在颅内未破裂动脉瘤组织中也存在表达升高的现象[12]。
综上所述,我们运用iTRAQ 与LC-MS/MS 联合的蛋白质组学分析方法,成功筛选出与颅内动脉瘤破裂风险相关的血浆候选生物标志物。从本质上讲,颅内动脉瘤的破裂主要与炎症反应、细胞凋亡等相关,多种机制共同作用导致不良结局。我们蛋白质互作用网络分析筛选出介导颅内动脉瘤破裂的关键蛋白,同时通过功能分析发现DEPs与炎症和免疫反应密切相关。这为了解颅内动脉瘤发病的分子机制和潜在的治疗靶点提供了新的线索。当然,这些蛋白质在颅内动脉瘤发生发展过程中的真正作用尚不清楚,还需要更多的实验验证。

