山葡萄‘双优’组织培养生根期愈伤组织的转录组分析
韦 伟,单守明,徐文娣,李光宗
(1.宁夏大学农学院,银川 750021;2.商洛学院生物医药与食品工程学院,陕西商洛 726000)
0 引 言
【研究意义】山葡萄(VitisamurensisRupr)为葡萄科葡萄属,具有抗寒耐旱等优点,被认为是葡萄属中最抗寒的物种,是葡萄抗寒育种的重要种质资源[1,2]。‘双优’为山葡萄品种,东亚种群,原产中国,具有生长旺盛、抗病耐旱和抗寒力强等优点,是加工果汁,酿制山葡萄类甜型葡萄酒的优良品种之一[3,4]。人工繁殖时其生根极为困难,因此常规繁殖方式为嫁接[5]。嫁接繁殖的葡萄苗在盐碱地易出现缺素、嫁接口愈合不好和嫁接口劈裂等现象,不仅会影响苗木成活率,更会严重影响葡萄的产量和质量。研究山葡萄生根的分子机理,对其生产中的繁殖具有重要意义。【前人研究进展】常见葡萄生根一般为插条扦插生根和组织培养生根,都离不开生长素类生长调节剂,主要为IAA、IBA和NAA,合适的生长素及浓度处理下会显著提高‘双优’葡萄的生根数目[5,6]。转录组测序技术能够获得研究对象在特定状态下的基因表达情况,进而深入研究其生物学过程的分子机制[7,8]。【本研究切入点】目前对于山葡萄的组织培养和其生根分子机理的研究并不多。需运用转录组测序技术对‘双优’葡萄组织培养生根期的愈伤组织进行测序和生物信息分析,了解其生根的分子机理,验证转录组测序结果。【拟解决的关键问题】将山葡萄‘双优’组织培养至生根阶段,以不同浓度的IBA、NAA和蔗糖诱导生根,对其愈伤组织进行转录组测序分析。筛选差异表达基因,分析COG注释、GO富集、KEGG富集通路、关键通路表达量等,研究‘双优’葡萄生根的分子机理。
1 材料与方法
1.1 材 料
‘双优’葡萄组织培养所用外植体为宁夏大学农科实训基地内获得的带芽茎段。材料为2 a生的‘双优’葡萄苗,取样时间为2021年7月。
1.2 方 法
1.2.1 外植体的消毒
将外植体取回后,选取较为健康的带芽茎段,立即进行消毒处理。流水充分冲洗10 min后,在超净工作台中70%的乙醇溶液消毒45 s,取出后使用无菌水冲洗3次,之后15%的H2O2溶液消毒6 min,再次使用无菌水冲洗4次。
1.2.2 启动培养
已消毒的带芽茎段切去两端约5 mm,末端接入培养基。启动培养所用的培养基类型、激素、蔗糖和琼脂浓度为MS+1.0 mg/L 6-BA+0.2 mg/L NAA+30 g/L 蔗糖+7 g/L 琼脂,pH为5.8~6.0。光照时间16 h,光照强度2 500 lx,组培室温度25 ℃。
1.2.3 生根培养
启动培养带芽茎段的芽萌发长至5 cm左右,在超净工作台中切取长势较为均一的萌发枝条转接至生根培养基中,每瓶接1个无根苗。设置IBA(0.1、0.3和0.5 mg/L)、NAA(0.1、0.3和0.5 mg/L)和蔗糖(15、25和35 g/L)处理。培养基类型为1/2B5,琼脂浓度均为7.5 g/L,光照时间12 h,光照强度2 500 lx,组培室温度为25℃,每组设置10个生物学重复。观察其生根状况,待茎基部愈伤组织生出较小的根系,于根系数目增长较快时,取下基部愈伤组织切去周围较小根系,迅速液氮冷冻,并保存于-80℃冰箱中用于转录组测序及qRT-PCR验证试验。表1

表1 正交试验设计
1.2.4 RNA提取、文库构建及转录组测序
使用植物RNA提取试剂盒(美吉逾华)提取愈伤组织的总RNA,每组3个生物学重复, 使用Nanodrop 2000(IMPLEN, 美国) 检测RNA的浓度和纯度,使用琼脂糖凝胶电泳(电压5 V/cm, 时间15 min)检测RNA完整性,使用Agilent 2100(Agilent Technologies, 美国)测定RIN值。纯化mRNA利用Oligo (dT)磁珠法,并将mRNA打成片段,构建cDNA文库并进行质检。将cDNA的粘性末端补成平末端,利用合成cDNA文库,由上海美吉生物医药科技有限公司基于Illumina Novaseq 6000 测序平台完成测序。
1.2.5 测序数据
对原始测序数据(Raw data)进行过滤,得到高质量的测序数据(Clean data)。将Clean reads用Hisat2 软件与参考基因组进行比对,并评估比对结果。将组装获得的基因和转录本与数据库进行比对,获得基因和转录本的功能信息并进行统计。以表达差异倍数|log2FoldChange|>1和矫正过的P值(P-adjust<0.05)作为筛选标准进行基因差异表达分析,筛选不同样品差异表达基因,分析GO和KEGG富集。
1.2.6 qRT-PCR验证
从差异表达基因中随机选取6个进行qRT-PCR验证。使用RNAprep Pure Plant Plus Kit(TIANGEN)试剂盒提取总RNA;使用PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKara)试剂盒反转录;使用UltraSYBR Mixture(CWBIO)试剂盒,运用实时荧光定量PCR仪(Jena, 德国)进行qRT-PCR试验,选用VvEF基因作为内参基因,各反应进行3次重复,利用2-△△CT算法计算相对表达量。表2

表2 qRT-PCR引物序列
1.3 数据处理
研究使用Origin Pro 2021处理数据和作图。
2 结果与分析
2.1 转录组测序样品的选择
研究表明,选择根系数目差异较大的S1和S6进行转录组测序,S6明显生根较多。生根处理20 d后,S6主根数显著高于其他组,S1的主根数目最少。图1,图2

图1 各组‘双优’葡萄组织培养主根数

图2 S1和S6‘双优’葡萄生根及组培苗
2.2 总RNA质量特征
研究表明,‘双优’葡萄各样品的OD260/280在2.07~2.15,OD260/230在1.09~2.19,浓度在188.90~454.50 ng/μL,RIN值除S6-1为9.9,其余均为10,各指标检测合格,符合上机要求。样品总RNA条带清晰且无弥散、无污染、无降解,品质较好,符合上机要求。表3,图3

注:M. Trans 2KPlus

表3 样品总RNA 质检
2.3 转录组测序数据统计
研究表明,6组样品一共获得Clean reads 284.40 Gb,各样品Clean reads数在44.18~49.02 Gb,错误率均低于0.03%,Q20均大于98%,Q30均大于94%,各样品cDNA的鸟嘌呤(G)和胞嘧啶(C)核苷酸的GC含量变化范围在45.95%~46.67%。89.15%~90.3%的Clean Reads 比对到参考基因组上,2.99%~3.67%的Reads比对于多个位置,85.66%~87.02%以上比对于唯一位置。表4

表4 样品测序数据统计
2.4 差异表达基因分析
研究表明, S6较S1显著上调的差异表达基因 537个,显著下调的差异表达基因277个,共814个差异表达基因, 差异表达基因的差异倍数大多集中在-5~5,-log10(P-adjust)的0~6,差异表达基因响应高浓度生长素和蔗糖主要以上调表达为主。图4
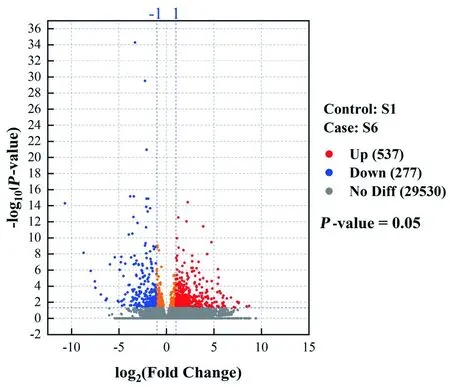
图4 差异表达基因的火山图
2.5 差异表达基因的COG注释
研究表明,共805个差异表达基因注释到COG的21个分类中,其中有450个差异表达基因注释到未知功能;74个注释到防御机制;46个注释到细胞内运输、分泌和囊泡转运;37个注释到信号转导机制。较少注释到RNA加工与修饰、染色质结构与动力学和能源生产和转换等条目。图5
2.6 差异表达基因GO富集
研究表明,分子功能大类中主要包括多糖结合、微管运动活性和碳水化合物结合等条目;细胞组分大类中主要包括驱动蛋白复合体、胞外区和微管相关复合物等条目;生物学过程中主要包括基于微管的运动、生长素激活信号通路和蛋白质磷酸化等条目。差异基因在生物学过程富集到的较多,在分子功能和细胞组分中富集到的较少。图6

图6 差异表达基因的GO富集
2.7 差异基因KEGG代谢通路
研究表明,共涉及通路84条,差异表达基因在苯丙烷生物合成通路中显著富集,涉及相关基因20个,其中8个上调表达,12个下调表达;在类黄酮生物合成通路中显著富集,涉及相关基因12个,其中6个上调表达,6个下调表达;在植物激素信号转导通路中显著富集,涉及相关基因16个,其中13个上调表达,3个下调表达;在托烷、哌啶和吡啶生物碱的生物合成通路中显著富集,涉及相关基因7个,其中2个上调表达,5个下调表达;在β-丙氨酸代谢通路中显著富集,涉及相关基因7个,其中4个上调,3个下调。此外还有9个差异表达基因在淀粉和蔗糖代谢通路中富集。显著富集的代谢途径直接或间接地参与‘双优’葡萄愈伤组织的生根中,其中部分基因可能在生根过程中发挥重要作用。图7,图8

图7 KEGG富集散点图

图8 KEGG富集分析显著富集通路基因数
2.8 植物激素相关基因的表达量
研究表明,H1和H6‘双优’葡萄生根愈伤组织在植物激素信号转导通路中共富集16个。差异基因富集于生长素、细胞分裂素、油菜素内酯和水杨酸途径。生长素途径包括Aux/IAA和GH3基因家族,转运蛋白LAX3,共11个差异表达基因,在S6中均为上调表达;细胞分裂素途径中包含一个A-ARR蛋白相关基因,S6中为上调表达;油菜素内酯途径中包括2个TCH4-2相关基因,在S6中下调表达,1个CYCD3-1相关基因,在S6中上调表达;水杨酸途径包括1个PR1相关基因,S6中下调表达。S6中上调表达基因较多,尤其生长素途径,11个差异表达基因均为上调表达,生长素途径可能与愈伤组织生根关系密切。其中有5个上调表达基因,表达量差异尤为明显,为IAA14、IAA22、IAA27、LAX3和A-ARR基因,5个基因可能对‘双优’葡萄愈伤组织的生根有重要作用。图9

注:使用log10(FPKM)值进行聚类分析。红色代表高表达基因,蓝色代表低表达基因,从蓝色到红色为log10(FPKM)逐渐上升
2.9 差异表达基因的qRT-PCR 验证
研究表明,RNA-seq的表达差异倍数和qRT-PCR相对表达量进行比较,二者趋势相近,表明RNA-seq分析结果可靠。图10

图10 部分基因的qRT-PCR 验证
3 讨 论
林茜等[9]得到阳光玫瑰葡萄组织培养的最佳生根激素配比为0.4 mg/L IBA +0.2 mg/L NAA。齐向丽等[10]得到红国王葡萄组织培养生根阶段的适宜蔗糖浓度为25~30 g/L。目前对于山葡萄组织培养的相关研究并不多,研究中最适处理S6培养基组成为1/2B5+0.5 mg/L NAA+0.5 mg/L IBA+25 g/L蔗糖。愈伤组织转录组测序分析可知差异基因以上调表达为主,在植物激素信号转导通路中有16个差异表达基因显著富集,且IAA14、IAA22、IAA27、LAX3和A-ARR基因表达量差异较大,均为上调表达。
生长素是一种重要的植物激素,在促进不定根的起始和发生过程中有重要作用,可以在植物的嫩叶、根系和子叶中合成[11-13]。生长素的运输包括2种形式,韧皮部的长距离运输和极性运输[14]。极性运输离不开其运输蛋白,包括促进其流入的蛋白(AUX和LAX)和流出蛋白(P-Glycoprotein ABC和PIN)[15],在生长素途径中富集到LAX3基因,在S6中上调表达,且于S1中表达量差异较大。生长素是通过一些早期应答基因以及转录因子等来调控植物的性状的。生长素早期应答响应基因主要包括Aux/IAA、GH3和SAUR基因家族[16]。Aux/IAA家族基因是重要的生长素原初响应基因,其家族多数成员都与根系生长发育有关[17]。生长素能调节Aux/IAA蛋白,之后快速调控一系列响应基因的表达[18]。GH3家族基因是一类功能复杂的生长素原初响应基因,能被植物生长素诱导快速高表达,其功能包括吲哚乙酸(IAA)和茉莉酸(JA)的氨基酸化合成酶功能、在JA和水杨酸(SA) 介导的植物防卫反应中作用、可以与生长素反应因子互作,并参与光反应途径,其中GH3-6属于Ⅱ类GH3基因,在维持生长素的动态平衡和调节植物生长发育中作用,可以控制根的生长[19-21]。在生长素途径中共富集Aux/IAA家族基因7个,GH3家族基因3个,10个基因均在S6中上调表达。生长素途径共11个差异表达基因,包括LAX、Aux/IAA和GH3基因家族,均在S6中上调表达。较高浓度生长素诱导‘双优’葡萄生根,生长素途径在‘双优’葡萄的生根中发挥重要作用,其中涉及到IAA14、IAA22、IAA27和LAX3基因表达差异明显。细胞分裂素途径中包含2种反应调节因子,其中A型ARR在细胞分裂素途径中起负调控作用[22,23]。ARR-A基因在S6中上调表达,与S1中表达量差异明显,调控细胞分裂素的合成。
4 结 论
较高浓度的生长素诱导山葡萄‘双优’组织培养生根,植物激素信号转导通路中的生长素途径在其中作用重要,11个相关基因全部上调表达。植物激素信号转导通路中涉及到表达量差异较大的基因包括IAA14、IAA22、IAA27、LAX3和A-ARR基因,都在S6中上调表达,5个基因可能在‘双优’葡萄的生根中发挥重要作用。

