过氧化物酶体增殖物激活受体对鱼类代谢的调节作用
刘 欣 孙淑倩 赵彦翠* 李明珠
(1.鲁东大学生命科学学院,山东 烟台 264025;2.鲁东大学农学院,山东 烟台 264025)
过氧化物酶体存在于真核细胞器中,参与脂肪酸氧化、磷脂合成和氧化应激等过程[1]。过氧化物酶体在过氧化物酶体增殖物(PP)的刺激下参与细胞代谢,其激活受体被称为过氧化物酶体增殖物激活受体(PPARs)。PPARs 是核激素受体家族中的配体激活受体,在糖脂代谢过程中发挥重要作用。有关PPARs 在高等哺乳动物糖脂代谢中的调节机制的研究比较成熟,但PPARs 调控鱼类的糖脂代谢作用机制的研究仍缺乏。因此,本文就PPARs 调节鱼类糖脂代谢和能量代谢方面的研究进行总结,旨为PPARs在鱼类糖脂代谢中的作用提供参考。
1 PPARs的概述
PPARs的结构见图1。PPARs有A~F共6个区域,可分为4 个功能结构域。氨基端的A/B 区为转录活化区,C区为DNA结合区(DBD),D区为可变铰链区,羧基端的E/F 区为配体结合区(LDB)。DBD 有两个锌指结构。LBD包含13个α螺旋和1个小型4股β片,更易结合饱和脂肪酸,在信号转换过程中发挥重要作用[2-3]。PPARs 根据结构和生理功能可分为PPARα、PPARβ/δ 和PPARγ[4]。PPARs需要配体激活,PPAR的内源性配体有多不饱和脂肪酸、白三烯B4、前列腺素等;人工合成激动剂有贝特类药物、苯氧乙酸衍生物、噻唑烷二酮类药物等。
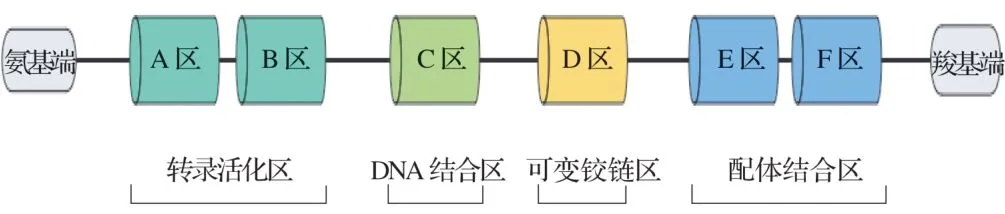
图1 PPARs结构
PPARs作用途径见图2。
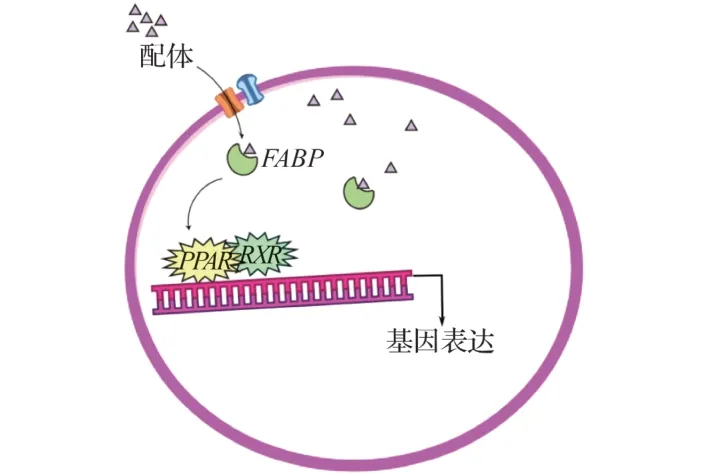
图2 PPARs作用方式
PPARs转录活性由类视黄醇X 受体(RXR)介导[4]。PPARs 在体内被相应配体激活,与RXR 形成异二聚体,结合靶DNA 序列,调节糖脂代谢相关基因的转录。PPARs 与RXR也可以形成异二聚体存在于细胞核中,与过氧化物酶体增殖物反应元件(PPREs)结合,调控靶基因转录[5-6]。
PPAR信号通路包括上游脂肪酸跨膜转运的2个蛋白基因(cd36 和fatp),在哺乳动物中促进脂肪酸β 氧化;配体由CD36 和FATP 蛋白转运,在细胞质中由FABP 转运到PPAR-RXR复合体,与调控下游的肉碱棕榈酰转移酶-1(CPT-1)、酰基辅酶A氧化酶(ACOX)、脂肪酸结合蛋白酶(FABP)、乙酰辅酶A合成酶(ACS)、脂肪酸合成酶(FAS)、乙酰辅酶A 羧化酶(ACC)等基因结合,还与腺苷酸活化蛋白激酶(AMPK)、细胞外因子(Wnt)、核因子κB (NF-κB)、雷帕霉素靶蛋白(mTOR)、固醇调控序列结合蛋白一型(SREBP-1c)等信号通路相互作用[7-10]。FABP 受不同类型的脂肪酸调节发挥作用[11];饱和脂肪酸下调fabp的表达[12],不饱和脂肪酸上调fabp的表达。ACS、FAS、ACC 等负责脂肪酸的合成。ACOX 和CPT-1 是脂肪酸β-氧化的限速酶[13],调节脂肪分解。
2 鱼类PPARs基因的克隆与表达
部分鱼类PPARs基因的克隆见表1。由表1可知,鱼类中编码PPAR的基因有:团头鲂(Megalobrama amblycephala)[14]、鲈鱼(Lateolabrax japonicus)[15]、斜带石斑鱼(Epinephelus coioides)[16]、 大西洋鲑鱼(Salmo salar)[17]、大黄鱼(Pseudosciaena crocea)[18]、牙鲆(Paralichthys olivaceus)[19]。鱼类的PPAR包括3 种类型,分别为PPARα、PPARβ/δ和PPARγ,但同一亚型在不同鱼类中有所差别,如大黄鱼PPARα、PPARβ/δ、PPARγ只有1 种类型[18],斑马鱼(Danio rerio)有2 个PPARα(pparaa、pparab)、 2 个PPARδ(pparda、ppardb)、1个PPARγ(pparg)。大西洋鲑鱼有2个PPARγ(PPARγ1和PPARγ2)[17]。鱼类PPARs分为4个功能结构域,鱼类PPARsDBD在所有物种中保守程度高,但LBD结构保守程度不高。

表1 部分鱼类PPARs基因的克隆
鱼类PPARs的表达量与PPARs的亚型及鱼的种类有关。研究发现,PPARα在肝脏、心脏、肌肉中表达量较高。如:PPARα在黄鲶(Pelteobagrus fulvidraco)肝脏中表达量最高,其次是心脏和肌肉[20];PPARα在褐鳟(Salmo trutta f. fario)的肌肉中表达量最高[21];欧洲鲽(Pleuronectes platessa)和金头鲷(Sparus aurata)在肝脏和心脏中表达量最高[22]; 军曹鱼(Rachycentron canadum)在肌肉、心脏和肝脏表达量较高[23]。同哺乳动物一样,PPARβ/δ在鱼类中也广泛分布,在肝脏、肾脏、胰腺、肠道和性腺中均有表达[24];PPARβ/δ在褐鳟(S.trutta f. fario)的性腺、心脏及肝脏中表达量较高[21];在长鳍篮子鱼鳃(Siganus canaliculatus)中表达最高[25]。PPARγ在鱼类中的表达范围较哺乳动物广泛,在黄鲶肌肉和脂肪组织中表达量较高[20];褐鳟的肝脏是表达PPARγ的主要部位[21];PPARγ在金头鲷和牙鲆(Paralichthys olivaceus)脂肪组织中表达水平最高[19,26];长鳍篮子鱼中的PPARγ在肠和鳃中表达量高[25]。Li 等[14]研究发现,PPARγ在团头鲂(M. amblycephala)中的转录具有组织依赖性和发育阶段依赖性。
3 PPARs在鱼类代谢中的应用
3.1 PPARs在鱼类脂质代谢中的应用
研究发现,PPARα、PPARβ/δ和PPARγ均参与鱼类的脂质代谢,参与脂质的分解与合成[26]。在矛尾复鰕虎鱼(Synechogobius hasta)中,PPARα和PPARγ通过调节fas、acc脂肪酸合成基因以及cpt-1 脂肪分解基因,调节脂质的代谢[27]。斑马鱼中PPARγ的缺失可以使丝氨酸/苏氨酸蛋白激酶TOR (mTOR),核糖体蛋白S6 激酶(RPS6Kb1b)和丝裂原活化的蛋白激酶14A(MAPK14a)高度磷酸化,防止斑马鱼脂肪沉积[28]。鳜鱼(Siniperca chuatsi)饵料中添加乳酸菌可显著增强PPARα的表达,刺激脂质分解,减少肝脏脂肪沉积[29]。在斑马鱼中PPARβ/δ激动剂能够显著降低脂质积累[30]。在食物匮乏的环境中,墨西哥脂鲤(Astyanax mexicanus)肝脏中高表达的PPARγ有利于脂质积累[31]。PPARs还参与鱼类体内长链多不饱和脂肪酸(LC-PUFA)的合成[32]。在卵形鲳鲹(Trachinotus ovatus)中,PPARαb通过调节卵形鲳鲹超长链脂肪酸延伸酶(Elovl4a)的表达,促进LCPUFA的生物合成[33]。PPARγ也会以剂量依赖性的方式上调fabp4的表达,增加卵形鲳鲹肝细胞中的DHA含量[34]。但在长鳍篮子鱼中,PPARγ抑制LC-PUFA合成,当抑制PPARγ的表达后,Δ6Δ5脂肪酰基去饱和酶(Δ6Δ5Fads)的表达增强,LC-PUFA 的合成增多[35]。由此可见,PPARγ对鱼类体内LC-PUFA的合成以及作用方式与鱼的种类相关,这种相关性及机制还有待进一步研究[36]。
研究表明,PPARs对鱼类脂肪代谢的调节作用与饵料中的脂肪含量及来源有关。研究发现,随着饵料中脂肪水平的提高,梭鱼(Liza haematocheila)肝脏、脂肪及肌肉组织中PPARα与PPARγ的表达量均升高,表明高脂喂养能够激活PPARα的脂肪酸氧化代谢,降低脂肪水平[37]。高脂饮食的草鱼(Ctenopharyngodon idellal)也能够通过增强PPARα的表达诱导脂肪酸β 氧化以适应高脂质摄入[38]。虹鳟(Oncorhynchus mykiss)[39]和大西洋鲑鱼(鱼油)[40]中也出现类似结果。饲喂高水平植物油的草鱼也表现出PPARγ、fas、cd36 的显著上调[41-43]。但Guo 等[44]和Yuan 等[45]研究发现,喂养高脂饵料的草鱼表现出肝脏fas表达下降、cpt-1表达增强,acc与PPARα也分别表现出下降和上升的趋势;脂肪组织中的PPARγ和cpt-1 表达显著增强,表明高脂饵料可以影响草鱼PPAR信号通路中相关基因的表达,提高脂肪分解、促进脂肪细胞分化。刘康[46]在卵形鲳鲹和大口黑鲈(Micropterus salmoides)的研究中,发现饲喂鱼油能够使肝脏脂肪酸分解代谢基因cpt-1 表达量增强、脂肪酸合成相关基因fas表达量下调,饲喂豆油则得到相反的结果,表明不同来源脂肪会影响PPAR信号通路中相关基因的表达。
3.2 PPARs在鱼类糖代谢中的应用
PPARs在鱼类糖代谢中具有重要作用。研究发现,PPARα的激活能够上调肝脏糖酵解途径基因gk、pfk、pk的表达,改变尼罗罗非鱼(Oreochromis niloticus)肝脏的糖代谢模式,但对肌肉中糖代谢无显著影响。PPARα还可通过激活TRIB2,抑制Akt磷酸化,降低尼罗罗非鱼中葡萄糖的氧化分解以及胰岛素敏感性[47]。与哺乳动物相似,PPARγ在鱼类中的表达同样可增强脂肪细胞对胰岛素的敏感性,调节鱼类的糖代谢[48]。鱼类利用碳水化合物的能力低,摄食过量的高碳水化合物会导致脂质过量积累[49-51]。Wang 等[52]研究发现,高碳水化合物饮食显著提高了尼罗罗非鱼甾醇调节元件结合蛋白1(srebp1)和accα的基因表达水平,fas表达也有上升。摄食高糖饵料的尼罗罗非鱼还表现出肝脏pparα表达水平显著降低[53-54],表明高碳水化合物水平通过影响PPAR信号通路中相关基因的表达,抑制脂肪的分解代谢,促进肝脏脂肪的生成。饲喂高碳水化合物的草鱼表现出肝脏pparα表达量显著降低[55-56]。高碳水化合物喂养的团头鲂也表现出肝脏PPARγ、fas和accα表达量显著升高,cpt-1、acox、pparα表达量显著降低[57-58]。
3.3 PPARs在鱼类能量代谢中的应用
脂质、糖类和蛋白质的代谢始终保持动态平衡,以维持细胞能量稳态。PPARs是糖类、脂质的关键调节剂,因此,PPARs在糖脂代谢的过程中也伴随着能量代谢调节。Ning 等[59]对尼罗罗非鱼的研究表明,PPARα被激动剂激活后可调节脂肪酸氧化、胆固醇和葡萄糖转运蛋白,增加β氧化相关基因cpt-1、fas、acox的表达量,增加线粒体和过氧化物酶体数量。血清葡萄糖、胰岛素和乳酸盐水平随着PPARα的激活而升高,与糖酵解和糖异生相关的关键酶的活性也显著增强。禁食能够激活PPARα,加速脂肪酸氧化产生能量[60]。PPARαb缺失会使斑马鱼脂肪酸β 氧化受限,通过增加葡萄糖利用率激活AMPK/AKT-mTOR 信号通路,抑制氨基酸分解,维持能量稳态[61]。当高碳水化合物摄入时,鱼体的PPARα表达量下调,降低脂肪酸β 氧化,使鱼类的脂肪酸合成、脂肪沉积[53]。高脂饮食会抑制团头鲂肝脏中cpt-1的表达,上调PPARγ减弱脂肪分解,造成脂肪沉积;高脂饮食还会上调葡萄糖激酶(GCK)和钠依赖性葡萄糖共转运蛋白1(SGLT1)mRNA的表达,通过血糖升高和胰岛素抵抗破坏鱼类的葡萄糖稳态[41]。在极端环境中,PPARα也可帮助鱼类维持能量平衡,热暴露下肝脏PPARα和cpt-1α的mRNA 表达水平显著增加,增强游离脂肪酸β 氧化满足更多的能量消耗[62]。PPARβ/δ主要调节与甘油三酯水解、脂质摄取、脂肪酸氧化和解偶蛋白激活相关基因的活性参与能量代谢[63-64];PPARβ/δ直接或间接调节甘油三酯水解和FA 氧化基因acs、cpt-1。此外,cpt-1 以PPARγ 共激活剂-1 (PGC-1) 依赖性方式直接由骨骼肌中的PPARβ/δ调节,诱导线粒体生物合成、氧化代谢;PPARβ/δ还能够激活线粒体解偶联蛋白UCPs,增加能量消耗。PPARγ在脂肪组织中促进脂肪酸的沉积,分化脂肪组织并消耗能量[65]。此外,PPARγ还参与通过胰岛素信号通路介导脂肪酸途径,将多余的碳水化合物转化为脂肪酸[66]。
4 环境因素通过PPARs影响鱼类代谢
PPARs同样也是水中污染物的靶点,在水污染物例如农药、微塑料、重金属等对鱼类风险评估的研究中,PPARs 信号通路中acox、cpt-1 等得到了探讨[67-69]。研究表明,PPARs可由农药调节,导致鱼类脂质代谢紊乱。雄性石斑鱼上的多效唑和斑马鱼胚胎上的全氟辛烷磺酸会上调fas、acc的表达造成甘油三酯积累[68,70]。斑马鱼胚胎中β 氧化基因的表达会被三氯生破坏,导致脂肪酸在TCA 循环中转化为乙酰辅酶A,导致脂质积累[71]。Qian等[72]研究发现,啶酰菌胺能够通过加速脂肪酸β氧化和抑制脂肪生成,降低甘油三酯和胆固醇含量,导致成年斑马鱼脂质代谢紊乱。研究表明,微塑料通过影响PPARs信号通路,引发斑马鱼消化系统中肝脏炎症和脂质积累[73],引起肠道通透性和炎症[74]。微塑料也可以通过影响PPARs 信号通路破坏草鱼的脂质代谢,降低食物转化率[75]。此外,水中的重金属也通过PPARs影响鱼类的代谢。研究表明,锌暴露是通过增强转录水平的脂肪分解增加能量消耗;水中的锌污染上调了矛尾复鰕虎鱼肝脏细胞中PPARs下游基因acs和线粒体脂肪酸β氧化限速酶acox、cpt-1 的表达,增强能量消耗[76]。短时间铜暴露(30 d)会上调PPARγ和fas、下调PPARα,刺激矛尾复鰕虎鱼脂肪生成,抑制脂肪分解,诱导肝脏脂肪堆积;长时间铜暴露(60 d)会上调PPARα、下调PPARγ和fas等基因,降低肝脂质含量[77]。
5 展望
PPARs在调节鱼类脂肪分解、合成中起到重要作用。PPARs通过影响糖酵解基因,调节鱼类糖代谢,同时伴随着能量代谢。但PPARs在鱼类糖脂代谢中调节机制的相关研究尚不够深入,还需进一步探索。随着多组学技术的联合应用将更全面地揭示PPARs对鱼类糖脂代谢和能量代谢的作用机制,为PPARs调控新型饲料添加剂的研究、开发和应用提供参考。PPARs是环境干扰化合物的主要靶点,对鱼类的生存具有影响。随着水体污染加剧,PPARs对鱼类代谢的影响受到重视,因此需要更深入研究,为水环境处理以及鱼类养殖业的可持续发展提供参考。

