一种快速测定饲料中呕吐毒素的超高效液相色谱串联质谱法
李 艺 霍路曼* 胡 剑 郑百芹 李爱军 董李学 张思宇 庞学良*
(1.唐山市食品药品综合检验检测中心,河北 唐山 063000;2.农业农村部农产品品质评价与营养健康重点实验室,河北 唐山 063000;3.唐山市动物疫病预防控制中心,河北 唐山 063000)
呕吐毒素(DON)是动物饲料中常见的真菌毒素之一,因其分子结构为雪腐镰刀菌烯醇的4-脱氧衍生物,又被称为脱氧雪腐镰刀菌烯醇(DON)。目前,在米、面、油中均不同程度地检出DON[1]。粮食饲料作为动物主要的食物来源,其品质直接影响畜禽产品质量。据调查,每年大约有25%的饲料因贮存、运输不当受到不同程度的霉菌毒素污染[2-3]。
研究表明,饲料中DON污染较普遍[4-6]。当动物摄入了被DON污染的饲料后,会抑制肠道吸收,降低肠道功能,从而导致动物免疫力下降,食欲减退,甚至造成死亡[7-9]。1998 年,在国际癌症研究机构公布的评价报告中,DON 被列为3 类致癌物。Trenholm 等[10]研究发现,当DON 含量在0~14 mg/kg,每增加1 mg/kg,猪的采食量降低6%,当含量达到10 mg/kg 以上时,猪出现拒食现象。
我国《饲料卫生标准》(GB 13078—2017)中对饲料产品DON限量值有着严格的规定,其中犊牛、羔羊、泌乳期精料补充料要求DON含量≤1 mg/kg,其他精料补充料要求DON含量≤3 mg/kg,猪配合饲料要求DON含量≤1 mg/kg,其他配合饲料要求DON 含量≤3 mg/kg[11]。目前,检测饲料中DON常用的国标方法为《饲料中脱氧雪腐镰刀菌烯醇的测定免疫亲和柱净化-高效液相色谱法》(GB/T 30956—2014),该方法检测时间长、成本高。随着检测仪器的不断升级,液相色谱串联质谱法因具有分析范围广、检测限低和灵敏度高等特点,已经被广泛应用于检测行业[12]。
本研究针对饲料中DON检测方法时间长、成本高的问题,建立一种基于超高效液相色谱串联质谱的测定饲料中DON的方法,以期能够达到短时间、大批量饲料样本检测,提高试验效率,节省检测成本的目的。
1 材料与方法
1.1 仪器与材料
G6470B超高效液相色谱串联质谱仪(安捷伦公司),KN-026S 涡旋振荡器(北京科德诺思技术有限公司),KQ-800KDB超声波清洗器(昆山市超声仪器有限公司),离心机、JJ200A电子天平(常熟市双杰测试仪器厂),有机微孔滤膜(0.22 μm),呕吐毒素免疫亲和柱(青岛普瑞邦生物工程有限公司),真菌毒素净化柱(北京科德诺思技术有限公司)。
呕吐毒素标准物质(100 mg/L,天津阿尔塔科技有限公司),饲料样品购自河北省唐山市。
1.2 试验方法
1.2.1 标准储备液的配制
准确移取100 mg/L 的呕吐毒素(DON)标准物质1.00 mL于10 mL容量瓶中,使用乙腈定容至刻度,配制质量浓度为10.0 mg/L的标准溶液,有效期一个月。
1.2.2 标准工作液的配制
使用时,使用空白基质溶液将标准溶液配制成质量浓度分别为0.01、0.02、0.05、0.10、0.20 mg/L的标准工作液,于4 ℃冰箱保存,现用现配。
1.2.3 样品前处理
称取饲料样品2.00 g 于50 mL 离心管中,加入DON标准溶液(外标法),加入10 mL 超纯水,3 000 r/min 振荡20 min,超声提取10 min,8 000 r/min离心10 min,取上层清液,使用真菌毒素净化柱去除杂质,过0.22 μm的有机微孔滤膜,滤液供LC-MS/MS测定。
1.2.4 精密度测定
称取2 g 饲料样品,添加水平分别为0.01、0.05、0.10 μg/kg,每个浓度做3次平行,计算精密度。
式中:RSD为相对标准偏差;S为标准偏差;xˉ为算数平均值;xi为样品测定值;n为样品重复测定次数。
1.2.5 回收率测定
在饲料样品中,添加DON 标准溶液,添加水平为0.01、0.05、0.1 μg/kg,每个水平做3 次平行,每个平行重复6次,计算回收率。
式中:c0为回收浓度(μg/kg);c1为样品添加浓度(μg/kg)。
1.3 液相色谱串联质谱条件
超高效液相色谱条件为C18 色谱柱(100 mm ×2.1 mm)、柱温40 ℃、流速0.30 mL/min、进样体积5 μL;流动相A 为0.1%甲酸水,流动相B 为乙腈。流动相度洗脱时间见表1。

表1 流动相梯度洗脱时间
质谱条件为ESI 正离子扫描模式,干燥气温度300 ℃,干燥气流速7 L/min,喷嘴电压500 V,毛细管电压3 500 V,鞘气温度350 ℃,鞘气流速11 L/min,雾化气45 psi,其他质谱条件见表2。

表2 DON质谱条件
2 结果与分析
2.1 定性分析
0.01 mg/L DON标准溶液定性离子与定量离子色谱结果见图1。由图1 可知,按照1.3 设定的超高效液相色谱与质谱条件,通过分析,DON 在1.69 min 峰形良好,出峰附近无任何杂峰干扰,是理想的色谱检测方法。

图1 0.01 mg/L DON标准溶液定性离子与定量离子色谱结果
2.2 定量分析
经调研与检测发现,饲料样品中大多含有呕吐毒素。进行加标试验前,为保证试验的准确性,对多批次饲料样品进行检测筛选,选取空白样品作为试验基质,空白饲料样品DON色谱结果见图2。
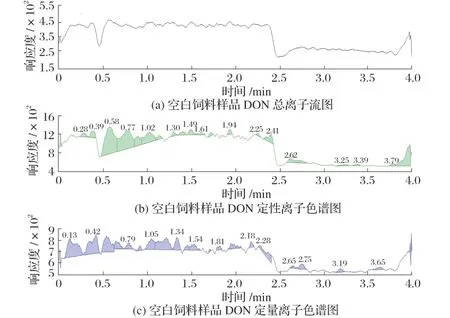
图2 空白饲料样品DON色谱结果
使用空白基质溶液,配制质量浓度分别为0.01、0.02、0.05、0.10 μg/L 的标准工作液,标准曲线见图3,加标样品色谱结果见图4。

图3 DON标准曲线
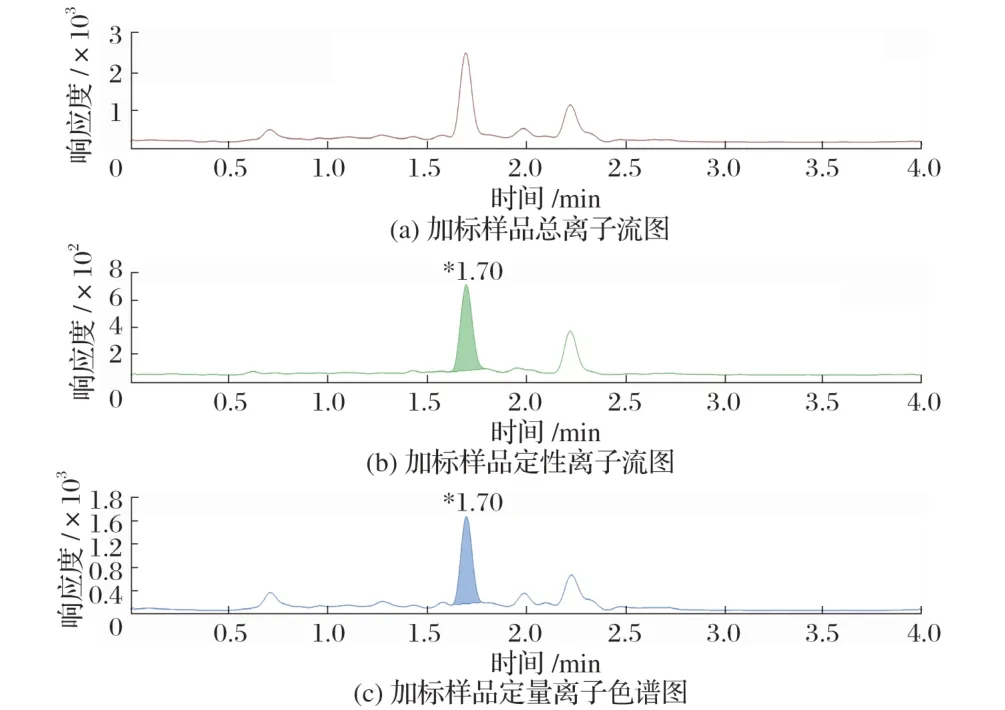
图4 加标样品色谱图
取空白饲料样品,添加一定量的DON标准溶液,使其添加水平分别为0.01、0.05、0.10 μg/kg,每个添加水平做6个平行样品,连续重复3 d,计算样品回收率与相对标准偏差。本研究以DON 回收率80%~120%、相对标准偏差小于10%时的最小添加浓度为定量限,DON的回收率及精密度结果见表3。两种检测方法相关参数对比见表4。
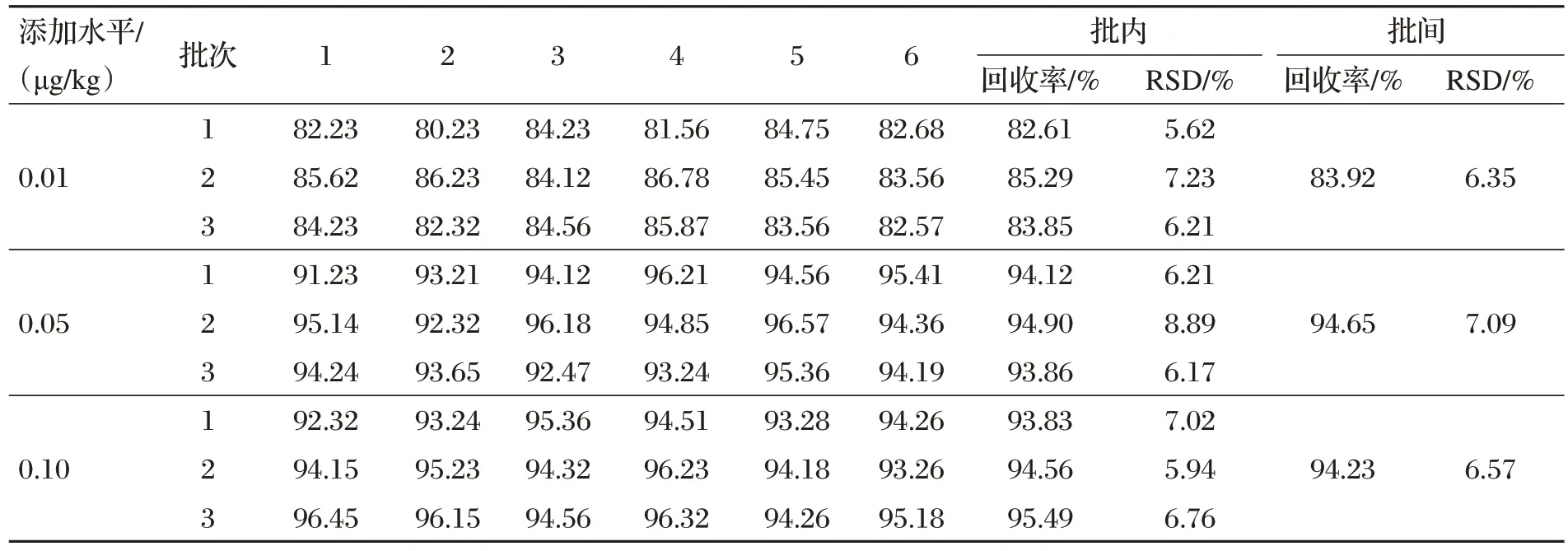
表3 呕吐毒素的回收率及精密度

表4 两种检测方法相关参数对比
由图3、表3和表4可知,DON在饲料样品中线性关系良好,相关系数在0.999 0~0.999 9 范围内,得到的回收率在83.92%~94.65%之间,RSD 值在6.35%~7.09%之间,检出限为0.01 μg/kg,符合检测要求。与《饲料中脱氧雪腐镰刀菌烯醇的测定 免疫亲和柱净化-高效液相色谱法》(GB/T 30956—2014)相比,检测时间由250 min缩短至44 min,检测成本由300 元/批降低至160 元/批。定量限由0.10 mg/kg降低至0.01 mg/kg。
2.3 实际样品测定
采用试验方法测定216批饲料样品,其中有194批样品不同程度地检出DON,但均不超国家限量标准(≤1 000 μg/kg),检出率为89.81%,检出最大值为578.2 μg/kg,见表5、图5。
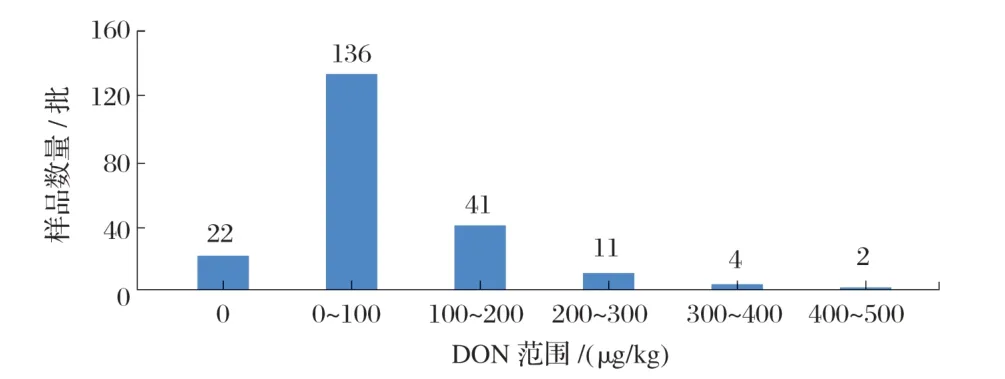
图5 216批饲料样品呕吐毒素分布柱形图

表5 216批饲料样品检测结果单位:μg/kg
由图5可知,大部分饲料中含有DON,DON 含量在0~100 μg/kg 有136 批,100~200 μg/kg 有41 批,200~300 μg/kg有11批,300~400 μg/kg有4批,400~500 μg/kg有2批。
2.4 提取溶液的选择(见图6~图8)
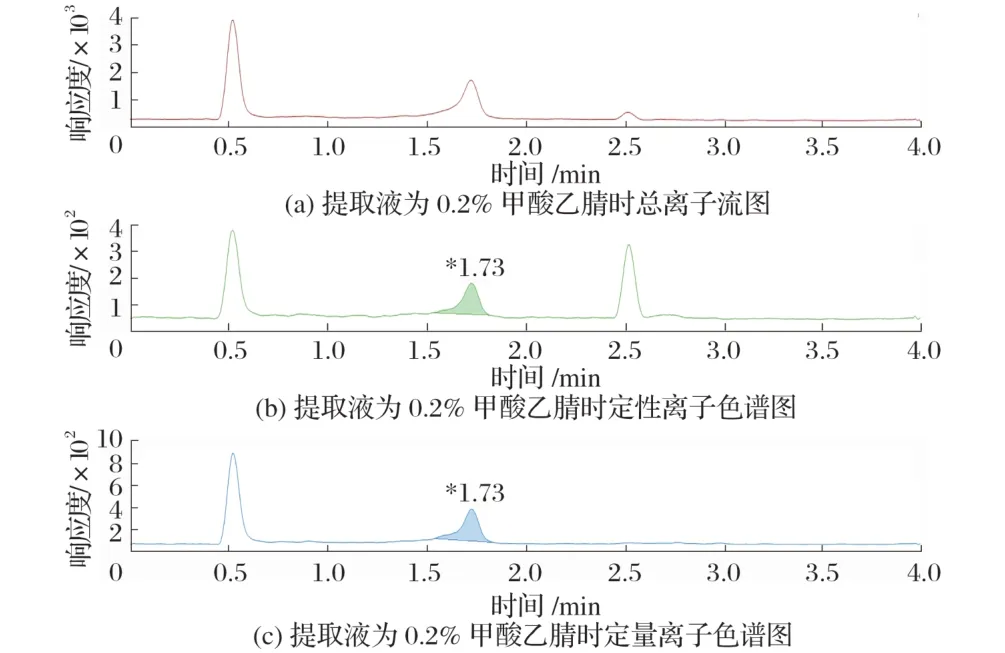
图6 提取液为0.2%甲酸乙腈为时的色谱结果
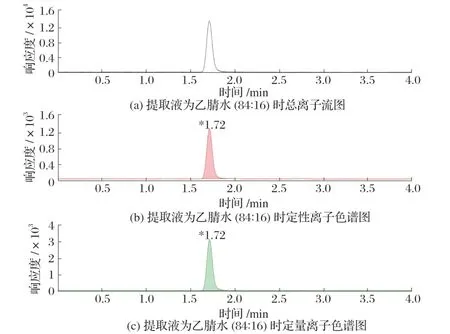
图7 提取液为乙腈水(84∶16)时的色谱结果
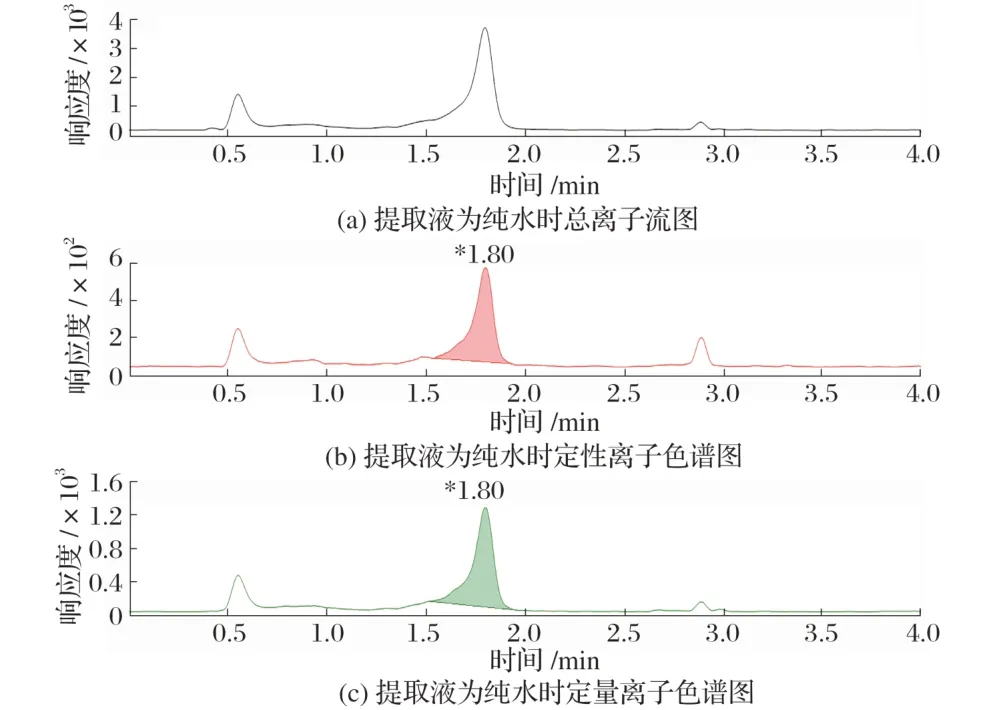
图8 提取液为纯水时的色谱结果
为了验证不同提取溶液对提取效果的影响,试验采用同一方法进行试验,只改变提取溶液种类。由图6、图7、图8 可知,当提取溶液中加入部分超纯水后,回收率要高于提取液全部为乙腈,当提取溶剂全部为超纯水时,响应强度最高、峰形最好、回收率最高。
免疫亲和柱和真菌毒素净化柱等不同固相萃取小柱对呕吐毒素提取效果的影响见表6。由表6可知,当提取溶剂为超纯水时,免疫亲和柱回收率为90.53%,净化柱回收率为88.75%,两者回收率相差不大,但从检测成本分析,真菌毒素净化柱要低于免疫亲和柱。
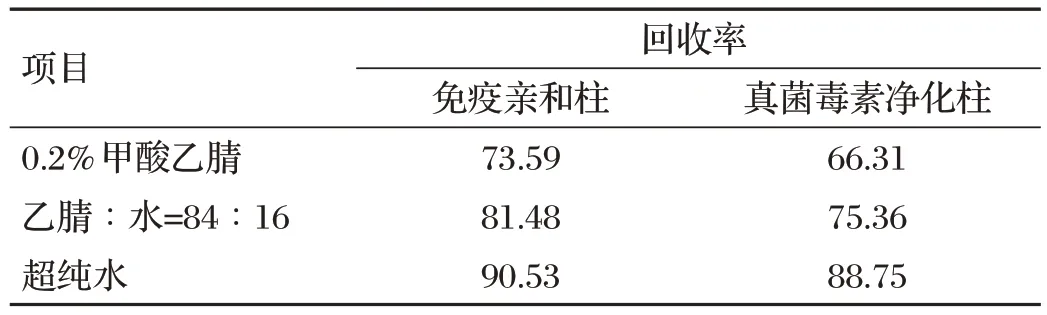
表6 不同固相萃取小柱对DON提取效果的影响 单位:%
3 讨论
施琦等[13]使用乙腈水(4∶1)为提取溶剂,建立了虾饲料中DON液相色谱串联质谱方法,检出限12.63 μg/kg。张大伟等[14]以50%乙腈水溶液为提取溶剂,建立了饲料中DON液相色谱串联质谱检测方法,检出限为2 μg/kg。符金华等[15]使用乙腈-水-乙酸溶液(70∶29∶1)作为提取溶剂,建立饲料中DON液相色谱串联质谱检测方法。范志辰等[16]使用5 mL水和5 mL含1%甲酸的乙腈溶液作为提取液,建立了饲料中DON检测方法,检出限为20 μg/kg。
本试验对比了酸化乙腈、乙腈水和纯水等不同溶液作为提取溶剂时对饲料中呕吐毒素提取效果的影响,以添加水平为0.01 μg/kg 的回收率为判定依据,结果发现,当提取溶液中加入部分超纯水后回收率要高于提取液全部为乙腈时的回收率,当提取溶剂全部为超纯水时,响应强度最高、峰形最好、回收率最高,这可能与呕吐毒素属于醇类物质,易溶于水有关。本试验表明,免疫亲和柱回收率要高于真菌毒素净化柱,但相差不大,真菌毒素净化柱比免疫亲和柱低140元/批。
4 结论
本研究基于超高效液相色谱串联质谱法,结合优化的前处理与上机条件,建立了一种操作简单、检测时间短、成本低、准确性高、实用性强的饲料中呕吐毒素快速定量检测技术,为进行大规模饲料监测提供了参考。

