2022年中国眼科药物临床试验进展
胡健萍,张 麟,辛 晨,彭楚芝,焦永红
0 引言
眼科具有庞大的患者群体及上升的患病率趋势,视觉损伤负担逐年增长,中国视觉损伤人数由1990年的2683万上升至2019年的5928万[1-2]。具备更优疗效的创新型眼科药物的出现可为患者带来更多治疗可能性。而药物临床试验则为评价药物有效性及安全性提供循证证据。然而国产眼科药品和器械研发仍处于初期阶段,与发达国家存在较大差距[3]。自2016年以来,我国开展的眼科药物临床试验数量逐年上升,相关的费用支出、对于研究资源的需求也随之增加。了解药物临床试验的变化趋势及实施现状对于新药研发、临床试验的开展、研究资源的配置、提高临床试验效率与质量具有重要意义。然而国内外相关报告较少,因此本研究团队于2022-10和2023-03基于国家药品监督管理局(National Medical Products Administration,NMPA)药品审评中心的药物临床试验登记与信息公示平台数据库(网址:http://www.chinadrugtrials.org.cn,以下简称平台)汇总分析了2014~2021年我国眼科药物临床试验的总体情况及实施效率,包括注册数量的变化趋势、适应证、试验分期、国际多中心研究、主要研究者所在单位、申办方情况、试验完成率、暂停/终止的原因、启动耗时、完成耗时等情况[3-4]。本研究进一步分析2022年的最新数据和新的趋势,旨在为眼科药品研发、临床试验的实施提供最新数据参考,为相关决策提供依据。
1 对象和方法
1.1 对象本研究采用横断面研究,纳入2022-01-01/12-31登记平台中适应证为眼科疾病的临床试验项目信息。数据检索日期为2023-01-26。检索方法为:在登记平台搜索框中分别输入眼、视、白内障、黄斑变性进行4次独立检索,以登记号为唯一识别码,将检索结果合并,并去重。继而由两名眼科医生分别独立对结果的适应证进行人工复核,以确保所纳入的试验适应证均为眼科疾病,且公示日期为2022年。最终纳入55项试验(图1)。记录登记号、试验状态、药物名称、适应证、试验通俗题目、药物类型、目标入组人数、试验分类、试验分期、伦理委员会批准日期、首次公示日期、申请人名称、试验范围、主要研究者(principal investigator,PI)姓名、主要研究者单位名称、主研机构所在省-市、第1例受试者签署知情的日期等。

图1 2022年中国眼科药物临床试验筛选流程图。
1.2 方法采用Excel 2003进行数据整理。对药物名称、适应证、试验分期、PI单位名称等先行归一化整理再行数据分析。平台中药物名称可能为申办方的药品代码而非真正的商品名或成分名称,故药品名称的统计依据系统中的填写内容进行。登记号CTR20221608、CTR20222868试验分期分别填写为Ⅰ/Ⅱ/Ⅲ期、Ⅰ/Ⅱ期,因该两项试验均为单臂设计,目标入组分别为30、9例,且该申办方均为首次登记临床试验,更符合Ⅰ期临床试验的特点,为便于分类汇总归为Ⅰ期。登记号CTR2022063试验分期填写为Ⅱ/Ⅲ期,因其为随机双盲的多中心研究设计、目标入组396例,更符合Ⅲ期临床试验的特点,为便于分类汇总归为Ⅲ期。糖尿病性黄斑水肿(diabetic macular edema,DME)与视网膜静脉阻塞所致的黄斑水肿合并为黄斑水肿进行分析。重组人血管内皮生长因子受体-抗体融合蛋白归类为重组抗VEGF人源化单克隆抗体。填写了首例知情同意书(informed consent form,ICF)日期的31项试验被纳入启动耗时分析。启动耗时=首例ICF日期-伦理委员会批准日期。主要研究者通常为1个,如有2个则均计入分析,CTR20221092填写为51个主要研究者,仅取第一位作为主要研究者。

2 结果
2.1 试验登记总体概况2022年我国眼科药物临床试验共公示55项,占所有临床试验的1.66%(55/3321),2020、2021年的占比分别为1.58%(40/2536)、1.65%(54/3279),呈逐步上升趋势。与2020年生物制品占比最高、2021年生物制品与化学药物占比均等不同,2022年以化学药物占比最高为58.18%(图2)。7个药物品种开展≥2项临床试验,其中以治疗近视的硫酸阿托品、治疗黄斑变性/DME/视网膜分支静脉阻塞的重组抗VEGF人源化单克隆抗体开展数量最多,分别为7、5项(表1)。55项试验中国际多中心研究3项,其中1项为国内制药企业,2项为全球制药企业。

表1 2022年中国眼科开展的≥2项临床试验的药物品种 项

图2 2020~2022年中国眼科药物临床试验数量趋势。
2.2 适应证及试验分期2022年中国眼科药物临床试验中治疗年龄相关性黄斑变性(age-related macular degeneration,AMD)、近视、干眼的临床试验最多,分别为10、8、6项(表2)。其中AMD的药物类型以生物制品为主,而近视和干眼均为化学药物。2022年眼科领域仅开展1项中药/天然药物的临床试验,为治疗AMD的QA108。其中,治疗干眼的酒石酸伐尼克兰为鼻喷雾剂剂型。另外,FT-001、基因治疗药物均为治疗RPE65双等位基因突变相关的遗传性视网膜变性(inherited retinal degeneration,IRD)的基因治疗药物,均尚未填报首例受试者入组时间。此前眼科领域的基因治疗仅有1项,为2021年公示的用于治疗的ND4突变相关的Leber遗传性视神经病变的基因治疗临床试验,已入组18例。试验分期以Ⅰ期、Ⅲ期为主,分别为36.36%、27.27%(表3)。

表2 2022年中国眼科药物临床试验的适应证及其药品名称
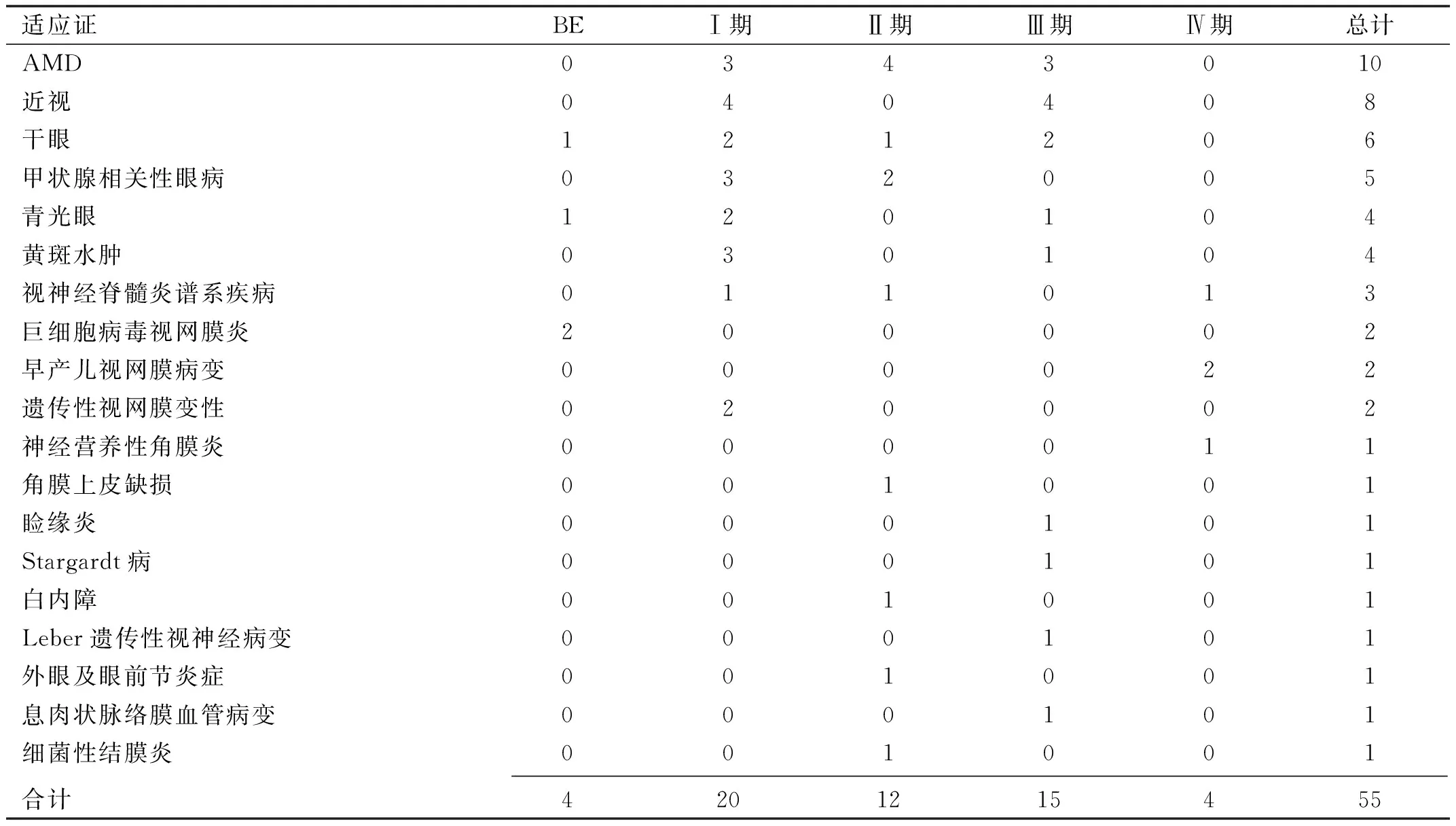
表3 2022年中国眼科药物临床试验的适应证及试验分期 项
2.3 实施效率纳入研究的56.36%(31/55)的试验已登记首例知情同意(ICF)日期,启动耗时范围为11d~10.5mo(平均3.95±2.42mo)。与2014~2021年相比,2022年Ⅰ期试验的启动时间显著缩短,差异有统计学意义(P=0.009),其他各期比较差异均无统计学意义(P>0.05,表4)。2022年当年获批且当年完成的试验有3项,分别为治疗近视的硫酸阿托品的Ⅰ期、治疗角膜上皮缺损的ZKY001的Ⅱ期、治疗/预防巨细胞病毒视网膜炎的盐酸缬更昔洛韦的BE试验,实际入组人数分别为24、120、52例。

表4 2022年中国眼科药物临床试验的启动耗时 mo
2.4 主要研究者单位的地域分布2022年承担试验的PI所在城市以上海、北京、浙江为主(图3)。排名前三的主要研究者所在单位为温州医科大学附属眼视光医院、中国医学科学院北京协和医院、上海市第一人民医院,均为6项。
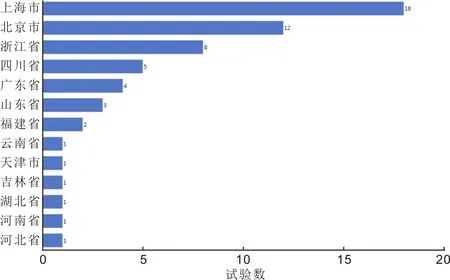
图3 2022年中国眼科药物临床试验的主要研究者所在省市。
3 讨论
为解决公众用药需求,为患者提供更优(更有效、更安全或更便利等)的治疗选择,提高审评审批质量、解决注册申请积压、鼓励研究和创制新药, 2015-08国务院发布了《国务院关于改革药品医疗器械审评审批制度的意见》,标志着我国药品监管改革的开始[5]。此后NMPA发布并更新了一系列的指导原则用于指导、规范新药研发与审评审批。其中《国家药品监督管理局关于调整药物临床试验审评审批程序的公告(2018年第50号)》中规定:自受理缴费之日起60d内,未收到药审中心否定或质疑意见的,申请人可以按照提交的方案开展临床试验,标志着中国的新药临床试验行政许可,由审批制正式转为更加高效的默示许可制[6]。在此背景之下中国的新药研发与药物临床试验迅猛发展,眼科领域也同样蓬勃发展[3,7]。2022年,我国药物临床试验共公示3321项,其中适应证为眼病的为55项,开展数量及占比均较2020、2021年稳步提升。7个药物品种开展≥2项临床试验,其中硫酸阿托品、重组抗VEGF人源化单克隆抗体两种药物开展的临床试验遥遥领先,分别为7、5项。这与我国近视、AMD、DME的疾病负担较重有关,也意味着该两种药物的研发较为成熟且为目前眼科领域的研发热点。此种趋势与clinical trial.gov注册平台中眼科药物的主要适应证为角膜、视网膜疾病及青光眼的情况一致[8]。2022年我国眼科开展国际多中心研究3项,1项为国内制药企业发起。而2014~2021年我国眼科领域开展国际多中心研究24项,2项为国内企业发起[3]。显示国内企业的药品研发及临床试验开展能力有所提高,但与全球企业相比仍有一定差距。试验分期以Ⅰ期和Ⅲ期为主,这与国际上以Ⅳ期、Ⅱ期为主的趋势不同[8],表明在我国处于早期研发和临近上市状态的新药较多,而国际上则以研发中期和上市后研究为主。
2022年我国眼科领域公示了2项基因治疗药物的临床试验,适应证均为RPE65双等位基因突变相关的IRD,目前均尚未填报首例受试者入组时间。眼部高度生理分隔的局部解剖特点、血-视网膜屏障的免疫豁免状态使得眼睛成为基因治疗的理想靶器官[9-10]。2017-12,美国FDA批准voretigene neparvovec (Luxturna)用于治疗RPE65基因突变相关的Leber先天性黑矇,成为第一个获批的基因治疗药物,眼科领域的基因治疗迅速发展[11]。虽然基因治疗仍处于起步阶段,但已受到世界范围的高度关注,因此我国也出台了《中国视网膜下基因治疗药物注射术操作规范推荐专家共识(2022)》,旨在制定一个详细完整的基因治疗药物视网膜下注射术操作流程专家推荐意见,以规范临床医生和研究者在相关疾病治疗过程中的应用,促进IRD等眼底病变相关基因治疗临床研究的顺利开展和进步[12]。截止本研究数据检索日期2023-01-26,平台中共公示了3项眼科领域的基因治疗临床试验。
在2022年疫情防控形势严峻的情况下,2022年试验的启动耗时与2014~2021年相比,Ⅰ期的启动耗时明显缩短,其他分期无显著变化,说明了我国眼科药物临床试验具有强劲的发展动力。但因本研究进行数据检索时,尚未上报首例受试者入组时间的试验可能实际尚未入组,其启动耗时更长,此类试验未被纳入分析使得2022年的启动耗时分析可能存在一定偏倚。PI以上海、北京、浙江为主。与2014~2021相比,2022年温州医科大学附属眼视光医院取代北京同仁医院成为承担试验数量最多的前三个机构,另2个机构仍然为北京协和医院和上海市第一人民医院[3]。
虽然,NMPA规定已获得NMPA药物临床试验许可文件并在我国进行的临床试验、及已完成化学药生物等效性试验备案并获得备案号的临床试验、依据药品注册证书或者药品监督管理部门发布的通知要求进行的Ⅳ期临床试验及上市后研究均应在开展药物临床试验前在本登记平台进行信息登记,并根据试验进展持续更新。但仍存在尚处于研发早期或以研究者发起的临床研究方式开展的临床试验因未被要求在本平台中登记而存在未被纳入的情况,此为本研究的局限性。
2022年,在疫情防控形势严峻的情况下,我国眼科药物临床试验仍然蓬勃发展,开展的数量、实施效率均稳步增长。以处于早期研发和临近上市状态的新药为主。适应证主要为AMD、近视、干眼。硫酸阿托品、重组抗VEGF人源化单克隆抗体为研究的热点药物。截止2022-12,共开展了3项基因治疗临床试验,用于靶向治疗RPE65双等位基因突变相关的IRD和ND4突变相关的Leber遗传性视神经病变。我国眼科药物临床试验具有强劲的发展潜力。

